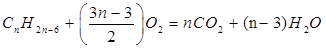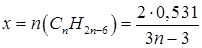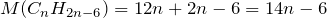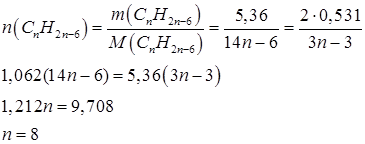Формула воздуха
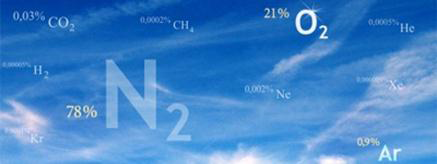
Газовый состав воздуха
От уровня моря до высоты около 11000 м (слой тропосферы) газовый состав воздуха практически не изменяется и выглядит следующим образом:
| Вещество | Формула | Объемная доля, % | Массовая доля, % |
|---|---|---|---|
| Задание | Плотность некоторого газа по воздуху равна 2. Какую массу будет иметь этот газ объемом 5,6 л (н.у.)? |
| Решение | Молекулярная масса воздуха равна 29 г/моль. |
Рассчитаем молекулярную массу данного газа:
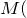
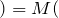
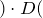
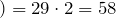
Согласно следствию из закона Авогадро молярный объем газа при нормальных условиях равен 22,4л.
Составим пропорцию и рассчитаем массу 5,6 л газа:
58г газа занимает объем 22,4л
х г газа занимает объем 5,6л
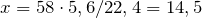
| Задание | При сжигании 5,36 г некоторого гомолога бензола было израсходовано 56,7 л воздуха (н.у). Определите формулу исходного соединения. |
| Решение | Запишем уравнение реакции горения: |
Содержание кислорода в воздухе – 21%. Рассчитаем объем кислорода, израсходованного в процессе горения:
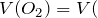
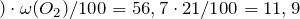
Количество вещества кислорода будет равно:
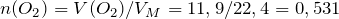
По уравнению реакции
Отсюда количество вещества гомолога бензола, вступившего в реакцию, будет равно:
Следовательно, формула вещества C8H10
Воздух с точки зрения химии, его основные свойства
На страницах блога мы много рассказываем о самых разных химических веществах и смесях, но у нас еще не было рассказа об одном из важнейших сложных веществ — о воздухе. Исправим это и расскажем о воздухе. В первой статье: немного истории изучения воздуха, его химический состав и основные факты о нем.
Немного истории изучения воздуха
В настоящее время под воздухом понимают смесь газов, 
В XVII веке было доказано, что воздух — это материальная сущность, вещество, свойства которого, например, плотность и вес, можно измерить.
В XVIII веке ученые проводили в запаянных химических сосудах реакции воздуха с различными веществами. Так было установлено, что поглощается примерно пятая часть объема воздуха, а оставшаяся часть горения и дыхания не поддерживают. В результате был сделан вывод, что воздух вещество сложное, состоящее из двух составляющих, одна из которых, кислород — поддерживает горение, а вторая — азот, «испорченный воздух», не поддерживает горение и дыхание. Так был открыт кислород. Чуть позднее получен в чистом виде азот. И только в самом конце XIX века были открыты аргон, гелий, криптон, ксенон, радон и неон, тоже имеющиеся в составе воздуха.
Химический состав

Существует еще такое понятие, как загрязненный воздух, то есть воздух, состав которого отличается от природного атмосферного за счет наличия загрязняющих веществ. Эти вещества бывают:
• естественного происхождения (вулканические газы и пыль, морская соль, дымы и газы от природных пожаров, растительная пыльца, пыль от эрозии почв и т.п.).
• антропогенного происхождения — возникшие в результате промышленной и бытовой деятельностью человека (выбросы соединений углерода, серы, азота; угольной и другой пыли от горнодобычи и промышленных предприятий; отходы сельскохозяйственного производства, промышленные и бытовые свалки, аварийные разливы нефти и других опасных для окружающей среды веществ; газовые выхлопы транспортных средств и т.п.).
Свойства
Чистый атмосферный воздух не имеет цвета и запаха, он невидим, хотя его можно ощутить. Физические параметры воздуха определяются следующими характеристиками:
• массой;
• температурой;
• плотностью;
• атмосферным давлением;
• влажностью;
• теплоемкостью;
• теплопроводностью;
• вязкостью.
Большая часть параметров воздуха зависят от его температуры, поэтому существует множество таблиц параметров воздуха для различных температур. Температуру воздуха измеряют с помощью метеорологического термометра, а влажность — с помощью гигрометра.
Воздух проявляет окислительные свойства (за счет большого содержания кислорода), поддерживает горение и дыхание; плохо проводит тепло, хорошо растворяется в воде. Его плотность уменьшается по мере увеличения температуры, а вязкость увеличивается.
Из следующей статьи вы узнаете о несколько несколько интересных фактов о воздухе и его применении.
Воздух
Содержание:
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Воздух
Молекулярная и химическая формула воздуха, в основном азот N₂ и кислород О₂. Воздух – естественная смесь газов, образующая атмосферу Земли.
В 1774 г. французский ученый А. Лавуазье доказал, что воздух — это смесь в основном двух газов: азота и кислорода, содержание азота составляет 4/5 и 1/5 кислорода (по объему).
Качественный состав воздуха можно доказать посредством следующего опыта. Заполненный воздухом колокол опускают в воду. В железную ложечку помешают кусочек фосфора, его зажигают и вносят под колокол. При этом вода в колоколе поднимается на 1/5, так как при горении фосфора расходуется только кислород. Газ, оставшийся под колоколом — азот, он в реакцию не вступает (рис. 16).
Рис. 16. Сжигание фосфора пои колоколом: а — горение фосфора; б — уровень волы поднялся на 1/5 объема
В конце XIX в. было установлено, что в состав воздуха, кроме кислорода и азота, входят пять газообразных веществ: аргон (Аr), ксенон (Хе), криптон (Кг), гелий (Не), неон (Ne). Эти газы называются благородными из-за их химической неактивности.
Кроме того, в воздухе содержатся оксид углерода (IV) и водяные пары. Примерный состав воздуха показан в табл. 6.
Антуан Лоран Лавуазье (1743—1794)
Французский ученый в 1774 г. установил состав воздуха, ввел понятия «химический элемент» и «химическое соединение». Лавуазье был автором первой классификации химических веществ и учебника «Элементарный курс химии».
Содержание углекислого газа (СО2) и водяных паров изменяется в зависимости от условий. Например, при сырой и теплой погоде в воздухе содержится больше водяных паров, а при сухой и прохладной — меньше. Процессы горения увеличивают долю оксида углерода (IV) и уменьшают содержание кислорода.
Состав воздуха
| Составные части | Содержание газов (в %) | |
| по объему | по массе | |
| Азот | 78,08 | 75,50 |
| Кислород | 20,95 | 23,10 |
| Благородные газы (в основном аргон) | 0,94 | 1,30 |
| Оксид углерода (IV) | 0,03 | 0,046 |
В результате природных явлений и деятельности человека (при землетрясении, вулканических извержениях, при сгорании топлива и выбросах из заводских труб) в атмосферу поступают такие газы, как оксиды азота — NO и NO2, оксиды серы — SO2 и SO3, сероводород — H2S.
В настоящее время на долю автомобильного транспорта приходится больше половины всех вредных выбросов в окружающую среду, которые являются главным источником загрязнения атмосферы, особенно в мегаполисах. В среднем при пробеге 15 тыс. км в год каждый автомобиль сжигает 2 т топлива и около 26—30 т воздуха, в том числе 4,5 т кислорода, что в 50 раз больше потребностей человека.
Атмосферный воздух является одним из основных жизненно важных элементов окружающей среды.
Средства защиты атмосферы
Средства защиты атмосферы должны ограничивать наличие вредных веществ в воздухе на уровне не выше ПДК (предельно допустимой концентрации).
Для очистки газов от частиц широко применяют сухие пылеуловители — циклоны различных типов.
Один из наиболее совершенных видов очистки газов от взвешенных в них частиц пыли и тумана — электрическая очистка (электрофильтр).
Для высокоэффективной очистки выбросов применяют аппараты многоступенчатой очистки.
В крупных городах для снижения вредного влияния загрязнения воздуха на человека применяют специальные градостроительные мероприятия. Построены и строятся автомагистрали в обход городов, принявшие весь поток транзитного транспорта, который раньше нескончаемой лентой тянулся по городским улицам.
Предприятия или их отдельные здания и сооружения, технологические процессы которых являются источником выделения в атмосферный воздух неприятно пахнущих веществ, отделяют от жилой застройки санитарно-защитными зонами.
Для повышения эффективности санитарно-защитных зон на их территории высаживают древесно-кустарниковую и травянистую растительность, снижающую концентрацию промышленной пыли и газов.
Знаешь ли ты?
Атмосфера земного шара весит 5 300 000 000 000 000 т. Если бы, например, потребовалось перевезти из Астаны в Алматы груз, равный весу земной атмосферы, и если бы каждый поезд имел 100 вагонов и проходил весь путь за 10 ч, на перевозку этого груза было бы потрачено почти 4 млрд. лет.
Самое важное
В воздухе содержится (по объему) 78% азота, 21% кислорода, 1% инертных и других газов. Кроме вышеприведенных простых веществ, в составе воздуха находятся углекислым газ и водяные пары, содержание которых может изменяться в зависимости от условии.
Горение
В повседневной жизни мы часто наблюдаем, как горит такое топливо, как природный газ. дрова, уголь. Знаете ли вы, что горение происходит с участием кислорода, входящего в состав воздуха? Кислород при нагревании энергично реагирует со многими веществами, при этом выделяются теплота и свет. Такие реакции называются реакциями горения. При горении атомы простых веществ соединяются с атомами кислорода и образуются оксиды. Общая схема взаимодействия простых веществ с кислородом такова:
| простое вещество + кислород = оксид |
Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
Оксиды — это сложные вещества, которые состоят из двух элементов, один из которых кислород. При горении веществ в воздухе образуются те же продукты, т. е. оксиды. Однако горение веществ в воздухе происходит медленнее, чем в кислороде, так как последнего в воздухе содержится примерно в пять раз меньше.
Если опустить в сосуд с кислородом О2, тлеющий уголек (рис. 17а), то он раскаляется добела и сгорает, образуя оксид углерода (IV) СО2 (углекислый газ):
Чтобы определить, какое образовалось вещество, в сосуд наливают известковую воду — она мутнеет. Это доказывает наличие углекислого газа.
В железную ложечку поместим кусочек серы и подожжем над пламенем спиртовки, затем внесем в сосуд с кислородом. Сера S горит в кислороде О2 ярким синим пламенем (рис. 17 б) с образованием газа с резким запахом оксида серы (IV) (опыт проводится под тягой):
| сера + кислород = оксид серы (IV) |
Фосфор Р сгорает в кислороде О2 ярким пламенем с образованием белого дыма, состоящего из твердых частиц оксида фосфора (V) (рис. 17 в):
| фосфор + кислород = оксид фосфора (V) |
В кислороде горят и такие вещества (рис. 17 г), которые обычно считают негорючими, например железо. Если к тонкой стальной проволоке прикрепить спичку, зажечь ее и опустить в сосуд с кислородом, то от спички загорится и железо. Горение железа происходит с треском и разбрасыванием ярких раскаленных искр — расплавленных капель железной окалины Fe3O4. Реакцию горения железа в кислороде можно выразить следующим уравнением:
| железо+кислород | железная окалина — (смесь оксидов железа) |
Другие металлы также могут взаимодействовать с кислородом, хотя эти реакции не всегда сопровождаются горением. Если сильно нагреть медь в кислороде, она, не сгорая, превратится в черный порошок — оксид меди (II):
Рис. 17. Горение в кислороде: а — угля; б — серы; в — фосфора; г — железа
Вам уже известно, что при горении простых веществ образуются оксиды, теперь выясним, как происходит горение сложных веществ. При горении парафиновой свечи в химическом стакане на его стенках появляются капельки воды. Если в стакан налить известковую воду, то она мутнеет, что доказывает наличие оксида углерода. Таким образом, при горении сложного вещества образовались оксиды тех элементов, которые входят в состав сложного вещества. Парафин состоит из двух элементов — углерода и водорода.
Медленное окисление
Если какое-либо вещество медленно реагирует с кислородом, то теплота выделяется постепенно. Такой процесс называется медленным окислением.
Это явление наблюдается довольно часто. Например, в процессе гниения (окисления) навоза выделяется теплота, которая может использоваться в парниках.
♦ Вещества, при горении которых выделяется большое количество теплоты, называют топливом. На практике используют топливо трех видов: твердое, жидкое и газообразное.
К твердому топливу относятся антрацит, каменный уголь, бурый уголь, торф и дрова; к жидкому — продукты переработки нефти: бензин, керосин, мазут и др.; к газообразному — природный и попутный нефтяной газы, а также другие промышленные газы.
Условия возникновения и прекращения горения
Огонь возникает, когда есть три составляющие (схема 5). Первая — это топливо, которым может служить дерево, бумага, спирт, газ и т. д Второе, что необходимо, — это кислород, который взаимодействует с топливом, результатом чего является горение. Третья необходимая составляющая — это тепло. Только нагретое до определенной температуры топливо будет гореть в воздухе. Для того чтобы погасить огонь, необходимо или перекрыть доступ кислорода, или максимально понизить температуру, или устранить источник возгорания (то, что горит).
При тушении огня на пламя направляют углекислый газ или пену, которые затрудняют доступ воздуха к горючему веществу. Небольшие очаги пожара можно потушить, накрыв их сверху брезентом или одеялом. Можно также использовать песок. Для тушения угля или горящей древесины используют воду. Она охлаждает их, а образующиеся водяные пары затрудняют доступ воздуха.
Самое важное
Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света. Горение веществ в воздухе происходит медленнее, чем в кислороде. При горении простых и сложных веществ образуются оксиды. Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород.
Образование основных и кислотных оксидов
Изучая горение серы, фосфора и железа, вы убедились, что металлы и неметаллы горят в воздухе, образуя оксиды. Для изучения свойств оксидов проделаем следующие опыты.
Опыт 1
В фарфоровую чашку помещаем немного свежепрокаленного оксида кальция СаО, (жженая известь), обливаем его водой. При этом выделяется большое количество теплоты, что свидетельствует о протекании химической реакции. В результате образуется рыхлый порошок гашеной извести, при растворении которого в воде получается мыльный на ощупь раствор. Изменение окраски лакмуса в синюю подтверждает об образовании основания. Схема реакции оксида кальция с водой следующая:
оксид кальция + вода  гидроксид кальция (основание) гидроксид кальция (основание) |
Растворимые в воде основания изменяют цвет индикаторов*.
* Информация индикаторах дана в § 11.
Из этого можно заключить, что оксиды металлов являются основными оксидами.
Опыт 2
Наливаем в химический стакан немного горячей воды, добавляем несколько капель раствора фиолетового лакмуса и сжигаем над водой в металлической ложечке красный фосфор. Образовавшийся в виде белого дыма оксид фосфора постепенно растворяется в воде, и образуется фосфорная кислота. Это подтверждает изменение окраски лакмуса на красную. Как видим, оксидам неметаллов соответствует кислота. Таким образом, оксиды неметаллов являются кислотными оксидами. Схема реакции:
оксид фосфора (V) + вода  фосфорная кислота фосфорная кислота |
Самое важное
При горении металлов образуется основной оксид. Основным оксидам соответствуют основания. Растворимые основания называются щелочами. При горении неметаллов образуются кислотные оксиды, им соответствуют кислоты. Существуют вещества, которые под действием кислот и щелочей изменяют свой цвет. Эти вещества называются индикаторами.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Воздух
Во́здух — естественная смесь газов, главным образом азота и кислорода, образующая земную атмосферу. Воздух необходим для нормального существования подавляющего числа наземных живых организмов: кислород, содержащийся в воздухе, в процессе дыхания поступает в клетки организма и используется в процессе окисления, в результате которого происходит выделение необходимой для жизни энергии (метаболизм, аэробы). В промышленности и в быту кислород воздуха используется для сжигания топлива с целью получения тепла и механической энергии в двигателях внутреннего сгорания. Из воздуха методом сжижения получают инертные газы. В соответствии с Федеральным Законом «Об охране атмосферного воздуха» под атмосферным воздухом понимается «жизненно важный компонент окружающей среды, представляющий собой естественную смесь газов атмосферы, находящуюся за пределами жилых, производственных и иных помещений».
Химический состав
В 1754 году Джозеф Блэк экспериментально доказал, что воздух представляет собой смесь газов, а не однородное вещество. [1]
| Вещество | Обозначение | По объёму, % | По массе, % |
|---|---|---|---|
| Азот | N2 | 78,084 | 75,50 |
| Кислород | O2 | 20,9476 | 23,15 |
| Аргон | Ar | 0,934 | 1,292 |
| Углекислый газ | CO2 | 0,0314 | 0,046 |
| Неон | Ne | 0,001818 | 0,0014 |
| Метан | CH4 | 0,0002 | 0,000084 |
| Гелий | He | 0,000524 | 0,000073 |
| Криптон | Kr | 0,000114 | 0,003 |
| Водород | H2 | 0,00005 | 0,00008 |
| Ксенон | Xe | 0,0000087 | 0,00004 |
Состав воздуха может меняться: в крупных городах содержание углекислого газа будет выше, чем в лесах; в горах пониженное содержание кислорода, вследствие того, что кислород тяжелее азота, и поэтому его плотность с высотой уменьшается быстрее. В различных частях земли состав воздуха может варьироваться в пределах 1-3 % для каждого газа. [источник не указан 924 дня]
Воздух всегда содержит пары воды. Так, при температуре 0 °C 1 м³ воздуха может вмещать максимально 5 граммов воды, а при температуре +10 °C — уже 10 граммов.
Физические свойства
| Параметр | Значение | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Средняя относительная молярная масса | 28,98 г/моль | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Средняя удельная теплоемкость при постоянном давлении cp | 1,006 кДж/(кг·К) | ||||||||||||||||||||||||||||||||
| Средняя удельная теплоемкость при постоянном объёме cv | 0,717 кДж/(кг·К) | ||||||||||||||||||||||||||||||||
| Показатель адиабаты | 1,40 | ||||||||||||||||||||||||||||||||
| Скорость звука (при н.у.) | 331 м/с (1193 км/ч) [2] | ||||||||||||||||||||||||||||||||
| Средний коэффициент теплового расширения в интервале температур 0—100 °C | 3,67·10 −3 1/К | ||||||||||||||||||||||||||||||||
| Коэффициент динамической вязкости воздуха (при н.у.) | 17,2 мкПа·с | ||||||||||||||||||||||||||||||||
| Растворимость воздуха в воде | 29,18 см 3 /л | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Показатель преломления (при нормальных условиях) | 1,0002926 | ||||||||||||||||||||||||||||||||
| Коэффициент изменения показателя преломления | 2,8·10 −9 1/Pa | ||||||||||||||||||||||||||||||||
| Средняя поляризуемость молекулы | 2·10 −30 | ||||||||||||||||||||||||||||||||
| Константа Сатерленда Sat | 171·10 −7 | ||||||||||||||||||||||||||||||||
Воздух в философии
Первый символ – общепринятое изображение стихии воздух.
Второе – алхимический символ.
Третье изображение – триграмма воздуха в Книге Перемен.
Немецкий мыслитель Фридрих Вильгельм Ницше писал [источник не указан 144 дня] о воздухе, что это наивысшая и самая тонкая из материй. Из воздуха соткана свобода человека. Поэтому символ воздуха в первую очередь это символ свободы. Это свобода, для которой нет никаких преград, ведь воздух нельзя ограничить, нельзя поймать и придать ему форму. [источник не указан 144 дня]
Это символ не только физической, но и духовной свободы, свободы мысли. [источник не указан 144 дня]
Воздух в искусстве
См. также
Примечания
Полезное
Смотреть что такое «Воздух» в других словарях:
воздух — 1. ВОЗДУХ, а; мн. нет; м. 1. Смесь газов (преимущественно азота и кислорода), из которых состоит атмосфера Земли; дыхательная среда человека, живого организма. Давление, влажность, температура воздуха. Морской, горный, лесной в. Чистый в.… … Энциклопедический словарь
ВОЗДУХ — 1. ВОЗДУХ1, воздуха, мн. нет, муж. Сложное газообразное тело, составляющее атмосферу земли (физ.). Воздух состоит гл. обр. из кислорода и азота. || Земная атмосфера; то, чем дышит живое существо. Спертый воздух. Выйти подышать воздухом. Лесной… … Толковый словарь Ушакова
ВОЗДУХ — 1. ВОЗДУХ1, воздуха, мн. нет, муж. Сложное газообразное тело, составляющее атмосферу земли (физ.). Воздух состоит гл. обр. из кислорода и азота. || Земная атмосфера; то, чем дышит живое существо. Спертый воздух. Выйти подышать воздухом. Лесной… … Толковый словарь Ушакова
воздух — Атмосфера. Ср … Словарь синонимов
ВОЗДУХ — ВОЗДУХ, смесь газов, составляющая атмосферу Земли. Сухой воздух содержит азот (78,1% по объему у поверхности Земли), кислород (21%), благородные газы (0,9%), углекислый газ (0,03%) и др.; во влажном воздухе до 3% водяных паров. Масса (5,1… … Современная энциклопедия
Воздух — ВОЗДУХ, смесь газов, составляющая атмосферу Земли. Сухой воздух содержит азот (78,1% по объему у поверхности Земли), кислород (21%), благородные газы (0,9%), углекислый газ (0,03%) и др.; во влажном воздухе до 3% водяных паров. Масса (5,1… … Иллюстрированный энциклопедический словарь
ВОЗДУХ — смесь газов, из которых состоит атмосфера Земли: азот (78,09% по объему), кислород (20,95%), благородные газы (0,94%), углекислый газ (0,03%); суммарная масса ок. 5,2.1015 т. Плотность 1,2928 г/л, растворимость в воде 29,18 см³/л. Благодаря… … Большой Энциклопедический словарь
ВОЗДУХ — смесь газов, образующих атмосферу Земли и используемых для дыхания всеми сухопутными живыми организмами. Экологический энциклопедический словарь. Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989. ВОЗДУХ (В.) важный… … Экологический словарь
ВОЗДУХ — ВОЗДУХ, а, муж. 1. Смесь газов, составляющая атмосферу Земли. Струя воздуха. В воздухе носится или чувствуется что н. (перен.: заметно появление каких н. идей, настроений). Повиснуть в воздухе (перен.: о ком чём н., оказавшемся в неопределённом… … Толковый словарь Ожегова
ВОЗДУХ — одна из фундаментальных стихий мироздания. Как и огонь, В. соотносится с мужским, лёгким, духовным началом в противоположность земле и воде, относящимся чаще всего к началу женскому, тяжёлому, материальному. Становящийся доступным органам чувств… … Энциклопедия мифологии