Урок 1. Схема строения атомов
В уроке 1 «Схема строения атомов» из курса «Химия для чайников» рассмотрим основы строение атома и состав атомного ядра; выясним, что такое атомная единица массы, порядковый номер атома и атомная масса элемента. Обязательно просмотрите основные понятия и определения к разделу «Атомы, молекулы и ионы», чтобы лучше воспринимать суть изложенного материала в данной главе.
Основы строения атома
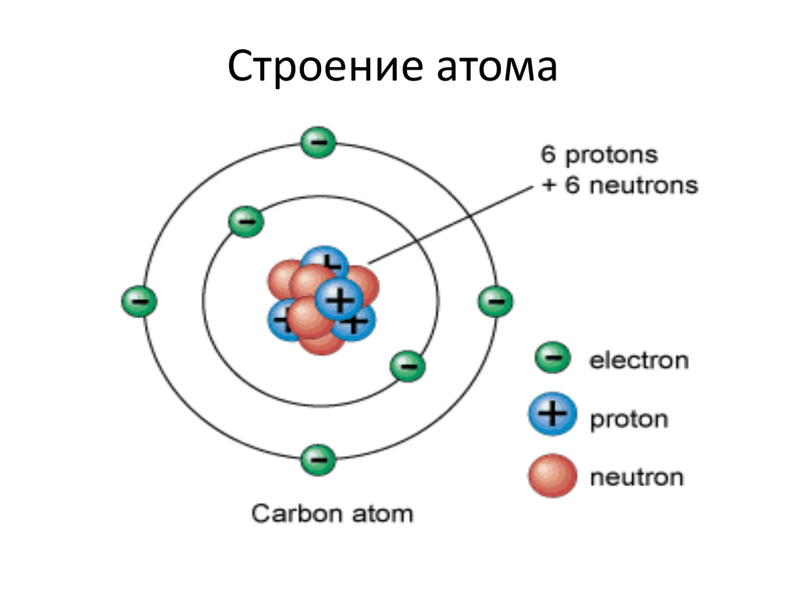
Пока не будем говорить, кто и когда узнал о существовании атома, а сразу перейдем к основам его строения: Атом — это мельчайшая частица вещества, которая состоит из ядра (заряд «+»), окруженного электронами (заряд «–»).
Электроны расположены на электронных оболочках атома: чем больше заряд ядра, тем больше электронов и электронных оболочек. Сам атом заряда не имеет, так как он является электрически нейтральным: заряд ядра (+) равен сумме зарядов электронов (-), вращающихся вокруг ядра.
Состав ядра атома
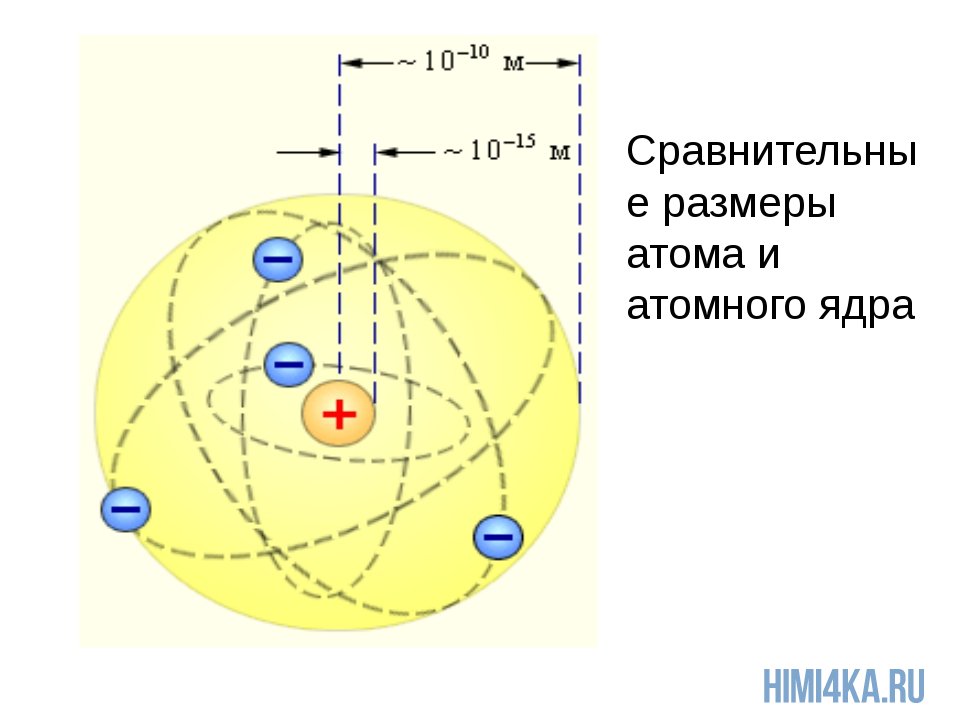
Ядро атома состоит из нуклонов. Нуклоны в ядре — это протоны и нейтроны. Массы протона и нейтрона почти одинаковые. Заряд ядра атома обозначается знаком «+» и зависит исключительно от количества протонов, ведь протоны — это носители положительного заряда, а нейтроны заряда не имеют никогда. Почти вся масса атома сконцентрирована в ядре, поэтому оно супер-тяжелое по отношению к остальному содержимому атома, однако, очень маленькое по сравнению с общим размером атома.
Чтобы вы понимали насколько оно мало, приведу пример: если атом увеличить до размеров Земли, то ядро атома будет в диаметре всего 60 метров. Надеюсь, что теперь у вас возникло некоторое представление об основах строения атома и составе атомного ядра.
Атомная единица массы
Весы, которые могли бы взвесить атом, электрон или нуклон, пока еще не изобрели. Поэтому химики выражают массу частиц не в граммах, а в атомных единицах массы (а.е.м.). 1 атомная единица массы равна 1/12 массы атома углерода, ядро которого состоит из 6 протонов и 6 нейтронов. Получается, что масса 1 протона
Порядковый номер атома и атомная масса элемента
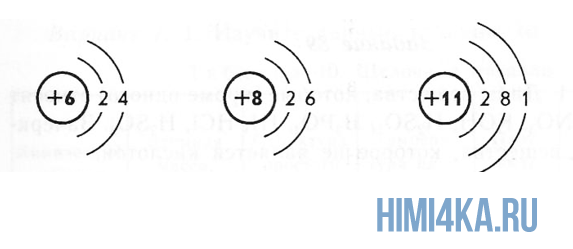
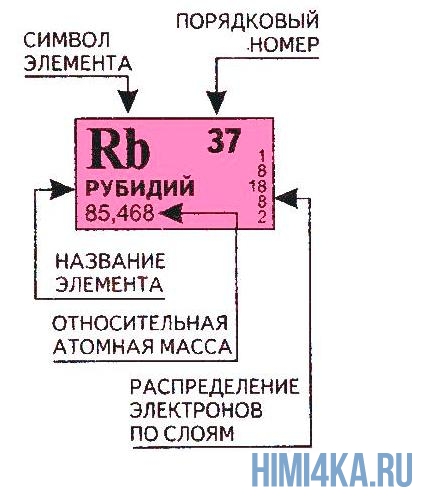
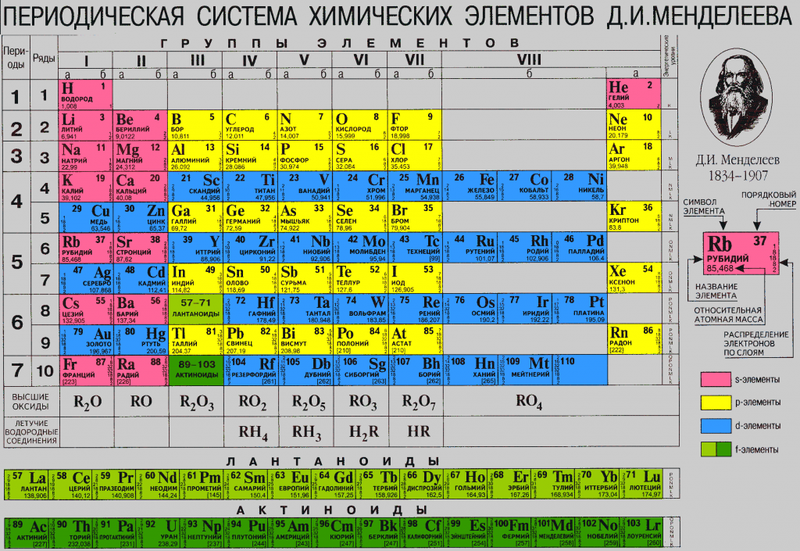
Переходим к двум фундаментальным понятиям. Порядковый (атомный) номер Z — это число протонов в ядре и оно же обозначает число электронов, потому как атом должен быть электрически нейтральным. Атомная масса элемента (относительная атомная масса, атомный вес) — это масса всех субатомных частиц (протонов, нейтронов, электронов) в атоме, выражается в а.е.м. Относительная атомная масса элемента один в один то же самое, что и атомная, но является безразмерной величиной и показывает, во сколько раз масса рассматриваемого атома превышает массу 1/12 части атома углерода. Порядковые номера и атомные массы химических элементов отмечены в таблице Менделеева.
Все атомы в природе с одинаковым порядковым номером в химическом отношении ведут себя практически одинаково и, поэтому их можно считать как атом одного и того же химического элемента. Каждый элемент обозначается одно- или двухбуквенным символом, заимствованный в большинстве случаев из греческого или латинского названия. Например, символ углерода — C, натрия — Na, азота — N и т.д. В качестве символа натрия Na, взяты две первые буквы его латинского названия натриум, чтобы отличить его от азота N (латинское название нитроген). В таблице Менделеева приведен алфавитный перечень элементов и их символов, их порядковый номер и атомные массы.
Надеюсь урок 1 «Схема строения атомов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Основы строения атома. Просто о сложном
Все в мире состоит из атомов. Но откуда они взялись, и из чего состоят сами? Сегодня отвечаем на эти простые и фундаментальные вопросы. Ведь многие люди, живущие на планете, говорят, что не понимают строения атомов, из которых сами и состоят.
Естественно, уважаемый читатель понимает, что в данной статье мы стараемся изложить все на максимально простом и интересном уровне, поэтому не «грузим» научными терминами. Тем, кто хочет изучить вопрос на более профессиональном уровне, советуем читать специализированную литературу. Тем не менее, сведения данной статьи могут сослужить хорошую службу в учебе и просто сделать Вас более эрудированными.
Атом – это частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, которая является носителем его свойств. Иными словами, это мельчайшая частица того или иного вещества, которая может вступать в химические реакции.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
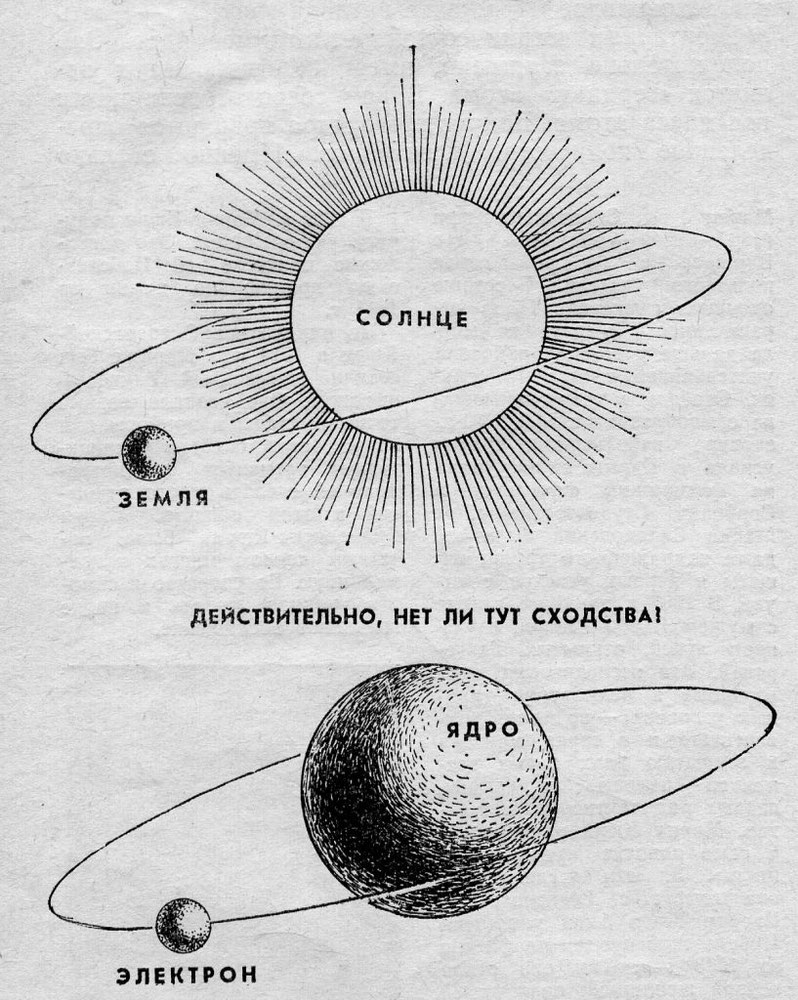
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
Ниже приведем элементарную схему строения атома углерода.
Схема строения атома
Свойства атомов
Масса
Массу атомов принято измерять в атомных единицах массы – а.е.м. Атомная единица массы представляет собой массу 1/12 части свободно покоящегося атома углерода, находящегося в основном состоянии.
В химии для измерения массы атомов используется понятие «моль». 1 моль – это такое количество вещества, в котором содержится число атомов, равное числу Авогадро.
Размер
При этом, масштабы вещей таковы, что, по сути, атом на 99% состоит из пустоты. Ядро и электроны занимают крайне малую часть его объема. Для наглядности, рассмотрим такой пример. Если представить атом в виде олимпийского стадиона в Пекине (а можно и не в Пекине, просто представьте себе большой стадион), то ядро этого атома будет представлять собой вишенку, находящуюся в центре поля. Орбиты электронов при этом находились бы где-то на уровне верхних трибун, а вишня весила бы 30 миллионов тонн. Впечатляет, не так ли?
Если предсавить атом в виде стадиона, ядро будет размером с вишню в центре поля
Откуда взялись атомы?
В самом начале формирования Вселенной никаких атомов не было и подавно, существовали лишь элементарные частицы, под воздействием огромных температур взаимодействующие между собой. Как сказал бы поэт, это был настоящий апофеоз частиц. В первые три минуты существования Вселенной, из-за понижения температуры и совпадения еще целой кучи факторов, запустился процесс первичного нуклеосинтеза, когда из элементарных частиц появились первые элементы: водород, гелий, литий и дейтерий (тяжелый водород). Именно из этих элементов образовались первые звезды, в недрах которых проходили термоядерные реакции, в результате которых водород и гелий «сгорали», образуя более тяжелые элементы. Если звезда была достаточно большой, то свою жизнь она заканчивала так называемым взрывом «сверхновой», в результате которого атомы выбрасывались в окружающее пространство. Так и получилась вся таблица Менделеева.
Так что, можно сказать, что все атомы, из которых мы состоим, когда-то были частью древних звезд.
Почему ядро атома не распадается?
В физике существует четыре типа фундаментальных взаимодействий между частицами и телами, которые они составляют. Это сильное, слабое, электромагнитное и гравитационное взаимодействия.
Именно благодаря сильному взаимодействию, которое проявляется в масштабах атомных ядер и отвечает за притяжение между нуклонами, атом и является таким «крепким орешком».
Не так давно люди поняли, что при расщеплении ядер атомов высвобождается огромная энергия. Деление тяжелых атомных ядер является источником энергии в ядерных реакторах и ядерном оружии.
Итак, друзья, познакомив Вас со структурой и основами строения атома, нам остается только напомнить о том, что наши авторы готовы в любой момент прийти Вам на помощь. Не важно, нужно Вам выполнить диплом по ядерной физике, или самую маленькую контрольную – ситуации бывают разные, но выход есть из любого положения. Подумайте о масштабах Вселенной, закажите работу в Zaochnik и помните – нет поводов для беспокойства.
Строение атома
Темы кодификатора ЕГЭ: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов.
Одну из первых моделей строения атома — « пудинговую модель » — разработал Д.Д. Томсон в 1904 году. Томсон открыл существование электронов, за что и получил Нобелевскую премию. Однако наука на тот момент не могла объяснить существование этих самых электронов в пространстве. Томсон предположил, что атом состоит из отрицательных электронов, помещенных в равномерно заряженный положительно «суп», который компенсирует заряд электронов (еще одна аналогия — изюм в пудинге). Модель, конечно, оригинальная, но неверная. Зато модель Томсона стала отличным стартом для дальнейших работ в этой области.
И дальнейшая работа оказалась эффективной. Ученик Томсона, Эрнест Резерфорд, на основании опытов по рассеянию альфа-частиц на золотой фольге предложил новую, планетарную модель строения атома.
Согласно модели Резерфорда, атом состоит из массивного, положительно заряженного ядра и частиц с небольшой массой — электронов, которые, как планеты вокруг Солнца, летают вокруг ядра, и на него не падают.
Модель Резерфорда оказалась следующим шагом в изучении строения атома. Однако современная наука использует более совершенную модель, предложенную Нильсом Бором в 1913 году. На ней мы и остановимся подробнее.
Атом — это мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Рассмотрим основные характеристики протонов, нейтронов и электронов:
| Протон | Нейтрон | Электрон | |
| Масса | 1,00728 а.е.м. | 1,00867 а.е.м. | 1/1960 а.е.м. |
| Заряд | + 1 элементарный заряд | 0 | — 1 элементарный заряд |
Следовательно, заряд ядра Z равен числу протонов, т.е. номеру атома в Периодической системе химических элементов.
Атом — это электронейтральная частица, следовательно, число протонов равно числу электронов: Ne = Np = Z.
Масса атома ( массовое число A ) примерно равна суммарной массе крупных частиц, которые входят в состав атома — протонов и нейтронов. Поскольку масса протона и нейтрона примерно равна 1 атомной единице массы, можно использовать формулу:
Массовое число указано в Периодической системе химических элементов в ячейке каждого элемента.
Обратите внимание! При решении задач ЕГЭ массовое число всех атомов, кроме хлора, округляется до целого по правилам математики. Массовое число атома хлора в ЕГЭ принято считать равным 35,5.
Таким образом, рассчитать число нейтронов в атоме можно, вычтя из массового числа номер атома: Nn = M – Z.
В Периодической системе собраны химические элементы — атомы с одинаковым зарядом ядра. Однако, может ли меняться у этих атомов число остальных частиц? Вполне. Например, атомы с разным числом нейтронов называют изотопами данного химического элемента. У одного и того же элемента может быть несколько изотопов.
Попробуйте ответить на вопросы. Ответы на них — в конце статьи:
Химические свойства атомов определяются строением электронной оболочки и зарядом ядра. Таким образом, химические свойства изотопов одного элемента практически не отличаются.
Поскольку атомы одного элемента могут существовать в форме разных изотопов, в названии часто указывается массовое число, например, хлор-35, и принята такая форма записи атомов:
Еще немного вопросов:
3. Определите количество нейтронов, протонов и электронов в изотопе брома-81.
4. Определите число нейтронов в изотопе хлора-37.
Строение электронной оболочки
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n.
| Тип орбитали | s | p | d | f | g |
| Значение орбитального квантового числа l | 0 | 1 | 2 | 3 | 4 |
| Число атомных орбиталей данного типа 2l+1 | 1 | 3 | 5 | 7 | 9 |
| Максимальное количество электронов на орбиталях данного типа | 2 | 6 | 10 | 14 | 18 |
Получаем сводную таблицу:
АО
 2
2 2
2

 6
6Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда. На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону. Только когда во всех орбиталях данного подуровня распределено по одному электрону, занимаем орбитали вторыми электронами, с противоположными спинами.
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l. Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.
| АО | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| n | 1 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 |
| l | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | 4 |
| n + l | 1 | 2 | 3 | 3 | 4 | 5 | 4 | 5 | 6 | 7 | 5 | 6 | 7 | 8 | 9 |
Таким образом, энергетический ряд орбиталей выглядит так:
1s энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например, энергетическая диаграмма для атома углерода:
Электронная формула — это запись распределения электронов по орбиталям атома или иона. Сначала указывается номер уровня, затем тип орбитали. Верхний индекс справа от буквы показывает число электронов на орбитали. Орбитали указываются в порядке заполнения. Запись 1s 2 означает, что на 1 уровне s-подуровне расположено 2 электрона.
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
1s 2 = [He]
1s 2 2s 2 2p 6 = [Ne]
1s 2 2s 2 2p 6 3s 2 3p 6 = [Ar] и так далее.
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s 1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s 2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s 2 2s 1 1s 
У бериллия 2s-подуровень заполнен:
+4Be 1s 2 2s 2 1s 
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s 2 2s 2 2p 1 1s 

+6C 1s 2 2s 2 2p 2 1s 

Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s 2 2s 2 2p 6 1s 

У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s 2 2s 2 2p 6 3s 1 1s 


От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
+19K 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 1s




Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K [Ar]4s 1 [Ar] 4s
У кальция 4s-подуровень заполнен:
+20Ca [Ar]4s 2 [Ar] 4s
+21Sc [Ar]3d 1 4s 2 [Ar] 4s 
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия :
+22Ti [Ar]3d 2 4s 2 [Ar] 4s 
+23V [Ar]3d 3 4s 2 [Ar] 4s 
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr [Ar]3d 5 4s 1 [Ar] 4s 
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца :
+25Mn [Ar]3d 5 4s 2
+29Cu [Ar]3d 10 4s 1
На цинке завершается заполнение 3d-подуровня:
+30Zn [Ar]3d 10 4s 2
+31Ga [Ar]3d 10 4s 2 4p 1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны.
Валентные электроны — электроны в атоме, которые могут участвовать в образовании химической связи. Например, у хрома (+24Cr [Ar]3d 5 4s 1 ) валентными являются не только электроны внешнего энергетического уровня (4s 1 ), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Основное и возбужденное состояние атома
+5B 1s 2 2s 2 2p 1 1s 

На втором уровне (внешнем) одна спаренная электронная пара, один одиночный электрон и пара свободных (вакантных) орбиталей. Следовательно, есть возможность для перехода электрона из пары на вакантную орбиталь, получаем возбуждённое состояние атома бора (обозначается звёздочкой):
+5B* 1s 2 2s 1 2p 2 1s 

Попробуйте самостоятельно составить электронную формулу, соответствующую возбуждённому состоянию атомов. Не забываем проверять себя по ответам!
15. Углерода
16. Бериллия
17. Кислорода
Электронные формулы ионов
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
+11Na 1s 2 2s 2 2p 6 3s 1 -1е = +11Na + 1s 2 2s 2 2p 6 3s 0
+17Cl 1s 2 2s 2 2p 6 3s 2 3p 5 +1e = +17Cl — 1s 2 2s 2 2p 6 3s 2 3p 6
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са 2+
19. Ион S 2-
20. Ион Ni 2+
Таким образом, ионы Na + и F — — изоэлектронные. Также они изоэлектронны атому неона.
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота :
+7N 1s 2 2s 2 2p 3 1s 

6. Электронная формула кислорода :
+8О 1s 2 2s 2 2p 4 1s 

7. Электронная формула фтора :
8. Электронная формула магния :
+12Mg 1s 2 2s 2 2p 6 3s 2 1s 


9. Электронная формула алюминия :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 



10. Электронная формула кремния :
+14Si 1s 2 2s 2 2p 6 3s 2 3p 2 1s 



11. Электронная формула фосфора :
+15P 1s 2 2s 2 2p 6 3s 2 3p 3 1s 



12. Электронная формула серы :
+16S 1s 2 2s 2 2p 6 3s 2 3p 4 1s 



13. Электронная формула хлора :
14. Электронная формула аргона :
+18Ar 1s 2 2s 2 2p 6 3s 2 3p 6 1s 



15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s 2 2s 1 2p 3 1s 

16. Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s 2 2s 1 2p 1 1s 

17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са 2+ : +20Ca 2+ 1s 2 2s 2 2p 6 3s 2 3p 6
19. Электронная формула аниона серы S 2- : +16S 2- 1s 2 2s 2 2p 6 3s 2 3p 6
Теперь вы знаете какие однокоренные слова подходят к слову Как написать строение атома, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову "Как написать строение атома", предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.