Ацетат натрия
| Ацетат натрия | |
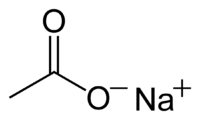 | |
| Общие | |
|---|---|
| Систематическое наименование | sodium acetate (ИЮПАК) sodium ethanoate (систематическое) ацетат натрия натрия этаноат |
| Химическая формула | CH3COONa |
| Эмпирическая формула | C2H3O2Na |
| Физические свойства | |
| Состояние (ст. усл.) | белый гигроскопичный порошок |
| Молярная масса | 82.03 грамм/моль (безводная форма) 136.08 грамм/моль (тригидрат) г/моль |
| Плотность | 1,45 г/см³ |
| Термические свойства | |
| Температура разложения | 324 °C |
| Удельная теплота плавления | 264—289 к Дж/кг |
| Химические свойства | |
| Растворимость в воде | 76 г/100 мл |
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты, производится и широко применяется в промышленных масштабах.
Содержание
Область применения
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
На этом свойстве основан довольно красивый опыт — «горячий лёд»
Способы получения
Ацетат натрия недорог и его легче приобрести в хим. магазинах, чем синтезировать в лабораторных условиях. В лабораторных условиях получается при взаимодействии уксусной кислоты, например, с карбонатом натрия, гидрокарбонатом натрия или гидроксидом натрия.
Это — хорошо известная реакция «гашения» пищевой соды и винного уксуса, происходящая в тесте. 84 грамма гидрокарбоната натрия реагируют с 750 граммами 8 % винного уксуса (или же с 86 граммами 70 % уксусной эссенции) с образованием 82 грамм ацетата натрия в растворе. Выпариванием воды можно получить чистый кристаллический ацетат натрия или его концентрированный раствор.
Характерные реакции
Ацетат натрия может быть использован для образования эфира с алкил галогенидами такими как бромэтан:
При сильном нагревании (более 324 °C) ацетат натрия разлагается на карбонат натрия и ацетон:
Одновременно может проходить разложение до оксида натрия, ацетона и диоксида углерода:
Галерея
Химический обогреватель, содержащий перенасыщенный раствор ацетата натрия, выделяющего тепло при фазовом переходе в кристаллическую форму тригидрата ацетата натрия.
Ацетат натрия
| Ацетат натрия | |
|---|---|
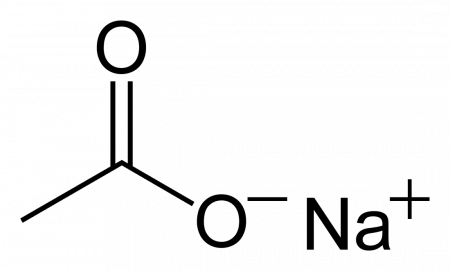 | |
| Систематическое наименование | sodium acetate (ИЮПАК) sodium ethanoate (систематическое) ацетат натрия натрия этаноат натрий уксуснокислый |
| Хим. формула | C2H3O2Na |
| Рац. формула | CH3COONa |
| Состояние | белый гигроскопичный порошок |
| Молярная масса | 82.03 грамм/моль (безводная форма) 136.08 грамм/моль (тригидрат) г/моль |
| Плотность | 1,45 г/см³ |
| Температура | |
| • плавления | 328 °C |
| • разложения | 324 °C |
| Удельная теплота плавления | 264—289 кДж/кг |
| Растворимость | |
| • в воде | 76 г/100 мл |
| Рег. номер CAS | 127-09-3 |
| PubChem | 517045 |
| Рег. номер EINECS | 204-823-8 |
| SMILES | |
| Кодекс Алиментариус | E262 |
| ChEBI | 32954 |
| ChemSpider | 29105 |
| Токсичность | ирритант, малотоксичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты, кристаллы со слабым солёным вкусом и уксусным запахом, производится и применяется в промышленных масштабах.
Содержание
Область применения
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
Также ацетат натрия является источником углерода для бактерий, выращиваемых на питательной среде.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
Ацетат натрия также используется в быту как составная химических грелок (англ. heating pad ) или химических обогревателей (англ. Hand warmer ), применяется как составная часть смеси «горячего льда» (англ. «hot ice» ), при кристаллизации ацетата натрия выделяется тепло — это экзотермический процесс. При нагреве тригидрата ацетата натрия (имеющего точку плавления в 58 °C) до 100 °C (обычно ёмкость с ним кладут в кипящую воду) он расплавляется (вернее, растворяется в собственной кристаллизационной воде) и переходит в водный раствор ацетата натрия. При охлаждении этого раствора образуется перенасыщенный раствор ацетата натрия в воде. Этот раствор прекрасно переохлаждается до комнатной температуры без образования твёрдой фазы, затем нажатием на металлический диск в ёмкости образуется центр кристаллизации, который, вырастая, заставляет перенасыщенный раствор переходить в твёрдую фазу тригидрата ацетата натрия. Этот процесс сопровождается значительным выделением тепла (экзотермическая реакция), теплота фазового перехода составляет 264-289 кДж/кг.
На этом свойстве основан довольно красивый химический опыт — «горячий лёд».
Способы получения
Это — хорошо известная реакция «гашения» пищевой соды и винного уксуса, происходящая в тесте. 84 г гидрокарбоната натрия реагируют с 750 г 8%-го винного уксуса (или же с 86 г 70%-й уксусной эссенции) с образованием 82 г ацетата натрия в растворе. Выпариванием воды можно получить чистый кристаллический ацетат натрия. Для получения тригидрата ацетата натрия без выпаривания необходимо смешать 84 г гидрокарбоната натрия (пищевой соды) с 86 г 70%-ной уксусной кислоты и 10 г воды.
Характерные реакции
Ацетат натрия может быть использован для образования сложного эфира по реакции с алкилгалогенидами, такими как, например, бромэтан:
При сильном нагревании (более 324 °C) ацетат натрия разлагается на карбонат натрия и ацетон:
2CH3COONa → Na2CO3 + (CH3)2CO 
Влияние на организм
Ацетат натрия может всасываться в организм при проглатывании. Является ирритантом. LD50 25956 мг/кг. По другим данным из того же источника: LD50(крысы, орально): 3500 мг/кг, LD50(мыши, орально): 4960 мг/кг.
Ацетат натрия: свойства, формула, получение, польза и вред, применение
Ацетат натрия – это разновидность соли уксусной кислоты. Данное соединение наиболее широко применяется в пищевой промышленности в качестве регулятора кислотности, усилителя вкуса и запаха и вещества, продлевающего срок хранения консерванта. Он известен под номером Е262. Ацетат натрия применяют в текстильном производстве. Добавку используют с целью нейтрализации серной кислоты в отработанных жидкостях и как фоторезиста анилиновых красителей. Ацетат натрия применяют и в дубильной промышленности в сочетании с солями хрома и в производстве резины. В дегидрированном виде ацетат натрия – это кристаллы среднего размера, цвет которых изменяется от бледно-желтого до яркой охры.
Что такое ацетат натрия?
Ацетат натрия (E262) – это гомогенный порошок из твердых гранул желтоватого или коричневатого оттенка. Особенно широко он применяется в производстве продуктов питания – его вводят для продления срока хранения. В роли консерванта применяется только неокрашенное вещество, без посторонних добавок.
Специалисты утверждают, что этот вид соли уксусной кислоты полностью безопасен для человеческого организма и окружающей среды. Ацетат натрия – это недорогая добавка, которую можно получить и самостоятельно. Так, хозяйки могут воспроизвести ацетат натрия прямо на своей кухне посредством смешивания соды и уксуса. Если полученную смесь выпарить, получится гомогенный порошок, аналог Е262. Ацетат натрия также распространен в естественной среде: его можно обнаружить в клетках растений и животных, он часто содержится в различных фруктах.
Порошок характеризуется слабым, едва ощутимым солоноватым вкусом и таким же невыраженным уксусным запахом. Производством вещества в наши дни занимаются крупные промышленные предприятия. В изготовлении продуктов питания его применяют как стабилизатор уровня кислотности и ароматизатор. Вещество используют в качестве консерванта при производстве консервированных овощей и фруктов для смягчения вкуса уксусной кислоты. Помимо этого, этот вид соли уксусной кислоты вводят в пекарскую муку с целью защиты готовой выпечки от «картофельной болезни». Добавка бывает в чипсах – там она отвечает за усиление аромата. Ацетат натрия увеличивает срок хранения соусов, джемов, супов и рыбной продукции.
Кроме пищевой промышленности, ацетат натрия встречается в текстильной, резинотехнической и лакокрасочной отраслях, в производстве клеев и полимеров. Часто добавку вводят в состав кормов для животных: благодаря ей домашние птицы могут ощутимо прибавить в весе. Ацетат натрия повышает яйценоскость.
Формула и свойства ацетата натрия
Формула ацетата натрия выглядит следующим образом:
Ацетат натрия – это кристаллический порошок с едва ощутимым соленым привкусом и уксусным запахом. Он хорошо растворяется в воде. Так, для растворения 76 грамм вещества потребуется 100 миллилитров жидкости. В спиртах ацетат натрия практически не растворяется. Оно характеризуется гигроскопичностью. Вещество не относится к категории горючих. Добавка обладает низкой степенью токсичности и практически не несет вреда окружающей среде.
Формула ацетата натрия
Для перевозки ацетата натрия рекомендуется использовать специальную устойчивую к влаге прослойку. Это необходимо для того, чтобы вещество не контактировало с жидкостью и не вступало с ней в реакцию.
Плотность ацетата натрия составляет 1,45 г/см³.
Температура разложения – 324°С.
Получение ацетата натрия
Получать ацетат натрия возможно разными способами. В лабораторных условиях вещество образуется при взаимодействии уксусной кислоты с карбонатом натрия:
Это наиболее распространенная реакция, происходящая при приготовлении теста. 84 грамма гидрокарбоната натрия смешивают с 750 граммами винного уксуса, в результате получают 82 грамма ацетата натрия.
В результате вышеописанной реакции образуется не только ацетат натрия, но и угольная кислота.
Ацетат натрия можно получить в процессе реакции растворения металлического натрия в уксусной кислоте:
Его также можно вывести в процессе реакции сложного эфира с алкилгалогенидами:
При воздействии повышенными температурами ацетат натрия распадается на карбонат натрия и ацетон:
Ацетат натрия получают и посредством сухой перегонки древесины.
Сферы применения ацетата натрия
Ацетат натрия – это вещество, которое считается абсолютно безвредным как для человека, так и для окружающего мира. Данная особенность объясняет распространенность этого вида соли уксусной кислоты в самых разных сферах. Наиболее широко вещество применяется в пищевой промышленности.
В ней добавку ценят за способность регулировать показатель кислотности и возможность выступать прекрасным консерватором и стабилизатором. Главной задачей вещества является сохранение вкусовых и ароматических качеств пищевого продукта, формы и текстуры, улучшение консистенции.
Ацетат натрия наиболее часто добавляют в муку, дабы предотвратить развитие «картофельной болезни» в готовой выпечке. Он предотвращает развитие спор, провоцирующих возникновение заболевания.
Ацетат натрия добавляют в консервированные овощи и фрукты с целью нейтрализации уксусного вкуса и запаха. С участием добавки производят чипсы, сухарики и прочие снеки – она утрирует их вкус и аромат. Е262 встречается в различных соусах, бульонных кубиках и сублимированных продуктах.
Ацетат натрия широко используют не только на постсоветском пространстве, но и в Европе и Соединенных Штатах. Такая популярность обусловлена его низкой токсичностью и отсутствию вреда человеческому здоровью и окружающей среде.
Ацетат натрия пользуется большой популярностью в следующих отраслях:
Ацетат натрия в пищевой промышленности
В международной кодификации добавок ацетат натрия значится под индексом Е262. Оно одновременно выступает в роли консерванта, усилителя запаха и регулятора кислотности. Ацетат натрия смягчает уксусный запах и вкус в маринованных плодах и ягодах. В выпечке он предотвращает развитие вредных бактерий и микроорганизмов, способных оказать негативное влияние на качество продукции. В снеки его добавляют для улучшения вкуса и усиления аромата. Ацетат натрия добавляют в соусы, в частности – в майонез, в бульонные кубики и сублимированные супы.
Влияние ацетата натрия на организм человека
Сама по себе добавка не является опасной для человеческого организма. Но от употребления продуктов, в состав которых она входит, стоит воздержаться людям с аллергией на уксус – неосмотрительность в выборе пищи может привести к ухудшению состояния и даже вызвать анафилактический шок. Так, при наличии аллергии лучше не употреблять в пищу мучные изделия, чипсы, консервированные овощи и рыбные консервы.
Е262 широко используется в производстве снеков, которые сложно отнести с категории полезных продуктов. Добавка усиливает их вкус и аромат, продлевает срок хранения. Употреблять подобного рода продукты не рекомендуется тем, у кого имеются заболевания желудочно-кишечного тракта.
Эксперты утверждают, что добавка полностью безопасна и пригодна к употреблению практически в любых объемах. Но злоупотреблять продуктами с ней все же не стоит.
Добавка официально разрешена в Соединенных Штатах, Канаде, Украине, Российской Федерации, Австралии, государствах Европы. Никаких официальных данных о ее связи с появлением и развитием злокачественных образований, генных мутаций, нарушений работы репродуктивной системы и отравлений не выявлено. По крайней мере, если речь идет о пищевых продуктах. Но было зафиксировано несколько случаев развития аллергических реакций у людей.
Специалисты советуют воздержаться от употребления ацетата натрия людям, имеющим проблемы с функционированием вегетативной системы, желчного пузыря, органов желудочно-кишечного тракта, печени, почек и органов сердечно-сосудистой системы.
Превышение суточной нормы может обернуться длинным списком не самых приятных симптомов: мигренью, нарушением координации, дискомфортом в области желудка, судорогами, затруднением дыхания, изменением цвета кожного покрова и слизистой оболочки.
Вред ацетата натрия
По некоторым данным, ацетат натрия может оказывать минимальный вред здоровью человека при употреблении слишком большого объема ацетата натрия. Так, ацетат натрия имеет свойства канцерогена: в кишечнике он преобразуется в нитрат, способный вызывать образование злокачественных опухолей или аллергии. Но подобная реакция организма возникает крайне редко.
Специалисты также советуют ограничить потребление продуктов, в состав которых входит ацетат натрия, у детей. При длительном вдыхании паров или употреблении чрезмерного количества ацетата натрия, могут возникнуть: конъюнктивит, кожные высыпания и покраснения, не тяжелые аллергические реакции, раздражения верхних дыхательных путей и затруднение дыхания, нарушение метаболизма.
Полезные свойства ацетата натрия
Ацетат натрия нередко применяют в фармацевтике для изготовления разного рода лекарств. В частности, обеззараживающих мазей. Это обусловлено способностью ацетата натрия останавливать жизнедеятельность вредоносных бактерий и микроорганизмов.
Показания к применению ацетата натрия
Добавку рекомендуется применять при регидратации и интоксикации. Ацетат натрия показан при гиперкалиемии, обезвоживании, разных пищевых инфекциях и дизентерии.
Противопоказания к применению ацетата натрия
Употреблять продукты, содержащие в своем составе ацетат натрия, не рекомендуется при наличии аллергических реакций. Речь идет не только об аллергии на саму добавку, но и об аллергии на уксус. Помимо этого, не рекомендуется употреблять добавку ацетат натрия при почечной недостаточности и заболеваниях сердечно-сосудистой системы. От употребления продуктов с добавкой стоит воздержаться беременным женщинам и малышам.
Инструкция по применению ацетата натрия
Ацетат натрия в составе самых разных препаратов рекомендуется принимать под надзором лечащего врача. Растворы вводят внутривенно – струйно или капельно. Дозировка препарата зависит от заболевания и его степени тяжести. Если пациент находится в особенно тяжелом состоянии, лекарство сперва вводят струйно, а затем переходят к капельницам.
Класс опасности пищевой добавки Е262
Ацетат натрия относят к 3 классу опасности, то есть, умеренно опасным продуктам. Они могут вызывать негативные реакции организма только при употреблении за один раз огромного объема ацетата натрия. В этом случае добавка может спровоцировать образование конъюнктивита, аллергических реакций, высыпаний и покраснений кожного покрова, затруднения работы сердечно-сосудистой системы, нарушение метаболизма.
Перечень продуктов, содержащих ацетат натрия
Ацетат натрия содержится в следующих продуктах питания:
Конкретных дозировок производители не приводят. Ацетат натрия безопасен, поэтому даже превышение объема его потребления не вызывает негативных реакций.
Где купить ацетат натрия и сколько он стоит
Наиболее оптимальный способ приобретения ацетата натрия – это купить его в интернете. Килограмм вещества обойдется вам примерно в 900 рублей. Приобрести ацетат натрия оптом можно прямо на производстве.
Заключение
Ацетат натрия – это относительно безвредное химическое соединение, производимое в лабораторных условиях. В пищевой промышленности он известен под индексом Е262 и применяется как консервант, регулятор кислотности и усилитель вкуса. Представляет собой однородный порошок белого, желтоватого или коричневатого цвета с легким солоноватым привкусом и запахом уксуса. В пищевой промышленности применяется только белый порошок, без примесей. Ацетат натрия прекрасно растворяется в воде.
Помимо пищевой промышленности, ацетат натрия получил важное место в химической и биохимической отраслях, в медицине, строительстве, текстильной промышленности и аграрном хозяйстве, в быту и при изготовлении гигиенических средств.
Для организма добавка ацетат натрия не несет особой опасности даже в больших количествах. Канцерогенное воздействие и провоцирование аллергических реакций отмечается в редких случаях. Но от употребления ацетата натрия все же рекомендуется воздержаться людям с проблемами со здоровьем, беременным женщинам и детям.
Натрия Ацетат
Химическое название
Натриевая соль уксусной кислоты, натрия этаноат.
Химические свойства
Белый гигроскопичный мелкий порошок, растворимый в воде. Разлагается при 324 градусах Цельсия. Молекулярная масса = 82 грамма на моль для безводной формы, 136,1 грамм на моль – для тригидрата. Формула Натрия Ацетата: CH3COONa; рацемическая формула: C2H3O2Na; формула тригидрата: C2H3O2Na х 3H2O.
Химические свойства
Вещество можно получить с помощью реакции уксусной кислоты с карбонатом или гидрокарбонатом натрия, с NaOH. В домашних условиях — это реакция винного уксуса с пищевой содой, к 1 грамму соды добавляют 9 грамм уксуса.
Реакция электролиза Ацетата Натрия. Во время превращения происходит диссоциация CH3COONa до CH3COO- и Na+. У анода выделяется этан и углекислый газ. Далее углекислый газ вступает в реакцию с гидроксидом бария или натрия (NaOH), во втором случаев пробирке останется чистый этан.
Достаточно популярна в химии реакция гидролиза Ацетата Натрия. Для наглядности, образованную слабой к-ой и сильным основанием соль, смешивают с индикатором-фенолфталеином. Смесь нагревают, при этом соль частично плавится и в расплаве появляются гидроксид-ионы. Затем пробирку охлаждают, соль кристаллизуется, и смесь утрачивает фиолетовую окраску. Соединение также реагирует с алкилгалогенидами, бромэтаном с образованием сложных эфиров.
Качественная реакция на Ацетат Натрия проводится в два этапа. Сначала определяют наличие в соединении ионов Na, а затем – кислотного ацетат-остатка. Натрий будет гореть ярко желтым пламенем, если небольшое количество раствора (или сухого вещ-ва) внести в пламя спиртовой горелки. Качественную реакцию на ацетат ион можно провести с помощью любой растворимой соли трехвалентного железа. Раствор станет красно-коричневого цвета, а при нагревании выпадет темно-коричневый осадок Fe(OH)3.
Химическое соединение используют при производстве текстиля; в качестве фоторезиста после применения анилиновых красителей; при вулканизации и в кожевенном производстве. Вещество получило широкое применение в виде пищевой добавки E262, используется в качестве консерванта; его применяют для сохранения стабильного рН в биохимии. Соединение используют при производстве химических обогревателей и грелок, («горячий лёд»). В медицине также используют тригидрат Натрия Ацетата.
Фармакологическое действие
Восстанавливает водно-солевой баланс.
Фармакодинамика и фармакокинетика
Натрия Ацетат применяют в комбинации с другими хим. соединениями. Вещество используют для дезинтоксикации и регидратации. Средство обладает способностью восстанавливать водный и электролитный баланс во время обезвоживания. Стимулирует диурез и предотвращает развитие метаболического ацидоза. Обладает дезинтоксикационным, регидратирующим и плазмозамещающим действием.
Показания к применению
Применяется при регидратации, интоксикации, гиперкалиемии, обезвоживании у пациентов с пищевыми инфекциями, холерой, острой дизентерией и так далее.
Противопоказания
Побочные действия
Редко при применении растворов для внутривенного введения с данным лекарственным средством возникает отечность, тахикардия, озноб.
Инструкция по применению (Способ и дозировка)
Натрия Ацетат в составе различных препаратов для внутривенного введения применяется в условиях стационара, под контролем лабораторных показателей. Растворы вводят струйно или капельно. Дозировка зависит от состояния пациента и тяжести состояния. Как правило, если пациент находится в тяжелом состоянии, то сначала вводят лекарство струйно, затем переходят на инфузии.
Передозировка
Нет сведений о передозировке средством.
Взаимодействие
Вещество часто применяют в комбинации с другими электролитами.
Ацетат Натрия можно сочетать с натрия хлоридом и натрием фумаровокислым, при этом необходимо визуально следить за совместимостью растворов.
Условия продажи
Может потребоваться рецепт.
Особые указания
Лечение препаратом проводят под контролем уровня электролитов крови и гематокрита.