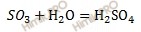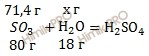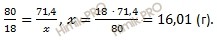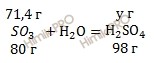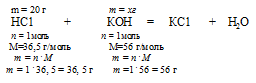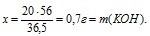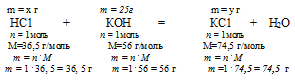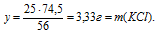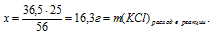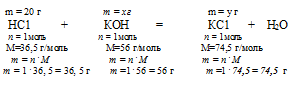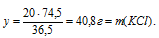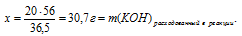Как пишется избыток в химии
Репетитор по химии и биологии
100 баллов ЕГЭ по химии!
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
РГМУ по химии 2010
РНИМУ им. Н.И. Пирогова
выпускница репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускник репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускница репетитора В. Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
Секретная шпаргалка по химии.
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
В ряде задач представлены данные для обоих реагентов. Как в таких случаях выполнять расчеты по уравнения реакций? Что брать в качестве точки расчета? Давайте разбираться. Вначале определимся с понятиями.
Для того, чтобы понять, в каких соотношениях представлены количества веществ-реагентов в конкретной задаче, необходимо начать анализ задачи по уже известным Четырем Заповедям. После выполнения Предварительных Расчетов (Третья Заповедь), следует выписать количества веществ над формулами реагентов в уравнении реакции и произвести пересчет количества одного вещества через количество другого. После определения избытка-недостатка дальнейшие расчеты в задаче производим по недостатку.
Как определить избыток-недостаток и провести дальнейшие расчеты, лучше разобрать на конкретной задаче. Читайте внимательно и попробуйте записать решение задачи на отдельном листе бумаги.
На 47 г оксида калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося нитрата калия.
1) Первая Заповедь. Выписать данные задачи в разделе «Дано».
2) Вторая Заповедь. Написать уравнение реакции.
Немного теории химии. Оксиды щелочных металлов проявляют ярко выраженные основные свойства. Они легко реагируют с кислотами с образованием солей.
3) Третья Заповедь. Сделать предварительные расчеты по данным условия задачи
На этой стадии необходимо определить, кто из реагентов в избытке, а кто в недостатке. Для этого следует провести пересчет количества одного вещества через количество другого. Покажу два способа пересчета и анализа. Можете пользоваться любым, какой понятней.
2) Считаем количество вещества оксида калия по количеству вещества азотной кислоты (обычный расчет по уравнению реакции). Я мысленно произношу: «Пусть вся азотная кислота вступила в реакцию. Сколько тогда прореагирует оксида калия?» Оксида калия, по расчетам, требуется меньше, чем дано, значит, оксид калия в избытке.
4) Четвертая заповедь. Составить алгоритм решения задачи.
Формулизируем вопрос задачи «Найдите массу образовавшегося нитрата калия», т.е. записываем формулу расчета массы, которая для нас, как для химиков, должна быть представлена произведением количества вещества на молярную массу.
Анализируем компоненты формулы: молярную массу нитрата калия определяем по таблице Менделеева, количество вещества нитрата калия рассчитываем по уравнению реакции исключительно по недостатку!
Смешали 7,3 г хлороводорода и 4 г аммиака. Какая масса соли при этом образуется?
Последовательность действия, выполняемых при решении задачи:
1 ) Выписать данные в разделе «Дано»
2) Написать уравнение реакции
3) Сделать предварительные расчеты
4) Определить избыток-недостаток
5) Сделать расчет по уравнению реакции (по недостатку!)
6) Составить алгоритм решения
7) Сделать окончательный расчет
На 36 г алюминия подействовали 64 г серы. Найдите массу образовавшегося сульфида алюминия.
При поджигании смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с образованием сульфида алюминия, который полностью гидролизуется водой, поэтому не может быть получен обменными реакциями в водных растворах.
Последовательность действия, выполняемых при решении задачи:
1) Выписать данные в разделе «Дано»
2) Написать уравнение реакции
3) Сделать предварительные расчеты.
4) Определить избыток-недостаток
5) Сделать расчет по уравнению реакции (по недостатку!)
6) Составить алгоритм решения
7) Сделать окончательный расчет
Секрет таланта и успеха на ЕГЭ
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами.
Химик.ПРО – решение задач по химии бесплатно
Cколько граммов серной кислоты (H2SO4) можно получить, если в реакцию вступило 20 литров серного газа (SO3) и 20 грамм воды (H2O)? Определить воды избыток недостаток.
Решение задачи
Запишем уравнение реакции получения серной кислоты (H2SO4):
Найдем массу серного газа (SO3) по формуле:
m (SO3) = 80 ⋅ 20 /22,4 = 71,4 (г).
Рассчитаем молярные массы интересующих нас веществ: серного газа (SO3), воды (H2O), серной кислоты (H2SO4).
M (SO3) = 32 + 3 ⋅ 16 = 80 (г/моль);
M (H2O) = 2 ⋅ 1 + 16 = 18 (г/моль);
M (H2SO4) = 2 ⋅ 1 + 32 + 4 ⋅ 16 = 98 (г/моль).
Для удобства расчета за х примем массу воды (H2O) и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке. Определить воды избыток недостаток.
80 г серного газа (SO3) вступает в реакцию с 18 г воды (H2O)
71,4 г серного газа (SO3) вступает в реакцию с х г воды (H2O)
Следовательно, вода (H2O) дана в избытке, так как по условию ее 20 г, а по расчету необходимо 16,01 г, поэтому расчет ведем по серному газу (SO3):
80 г серного газа (SO3) участвует в реакции образования 98 г серной кислоты (H2SO4)
71,4 г серного газа (SO3) участвует в реакции образования х г серной кислоты (H2SO4)
Задачи на определение избытка-недостатка в реакциях нейтрализации
Составляем пропорцию:
20 г НС1 реагируют без остатка с x: г КОН (по условию)
36,5 г НС1 реагируют без остатка с 56 г КОН (по уравнению)
Ответ: 30,7 г КОН потребуется для полной нейтрализации раствора, содержащего 20 г НС1.
Задача 2.
Представим себе ситуацию, когда мы вместо 30,7 г КОН добавили недостаточное его количество, например, 25г. Тогда часть НС1 прореагирует с КОН, а часть останется. В этом случае КОН будет в недостатке, а НС1 — в избытке. Посмотрим, какие вещества и в каких количествах будут находиться в растворе после реакции, если к раствору, содержащему 20 г НС1 добавить недостаточное для полной нейтрализации количество КОН, например, 25 г.
Дано: масса хлороводорода: m(НС1) = 20 г;
масса гидроксида калия: m(КОН) = 25 г.
Найти: Массы всех веществ в растворе после реакции.
Решение:
Так как КОН взят в недостатке, он израсходуется весь в химической реакции. Количество НС1, по отношению к количеству КОН, находится в избытке, следовательно, часть хлороводорода останется после реакции. Кроме того, в процессе химической реакции образуется соль КСl, которая тоже будет содержаться в растворе. Образующаяся вода разбавит имеющийся раствор.
Итак, качественный состав раствора после реакции мы установили:
1) избыточная хлороводородная кислота (НС1);
2) образующаяся соль КС1;
3) вода в виде растворителя.
Определим массы НС1 и КС1 в конечном растворе. Массу КС1 легко определить путем расчета по химической реакции.
Массу оставшейся НС1 можно найти по разности:
m(HCl)оставшейся после р-ции = m(HCl)исх. – m(HCl)израсходованной в р-ци
Массу израсходованной НС1 также необходимо найти по уравнению реакции.
В задачах на избыток-недостаток расчет по уравнению реакции всегда ведут по веществу, взятому в недостатке. Вещество, взятое в недостатке, всегда в реакции расходуется полностью. А вещество, взятое в избытке, расходуется лишь частично, и какая часть его участвует в химической реакции нам неизвестно. Поэтому вести расчет по веществу, взятому в избытке, невозможно.
В данном случае в недостатке у нас КОН. По нему и ведем расчет образовавшейся соли КС1 и расходовавшейся НС1:
Найдем массу образовавшейся соли КС1. Для этого составим пропорцию:
25 г КОН дают у г КС1 (по условию)
56 г КОН дают 74,5 г КС1 (по уравнению)
Находим массу НС1, которая расходовалась в реакции. Для этого составим пропорцию:
х г НС1 расходуется на 25 г КОН (по условию)
36,5 г НС1 расходуется на 56 г КОН (по уравнению)
Теперь мы можем определить массу НС1, которая осталась неизрасходованной:
m(НС1)осталось послс р-ции = m(НС1)исх. – m(НС1)расх. в р-ции = 20 – 16,3 = 3,7 г.
Итак, в результате добавления 25 г КОН к раствору, содержащему 20 г НС1, образовалось 33,3 г КС1 и осталось 3,7 г неизрасходованной НС1. Таким образом, в итоге получился раствор двух веществ (КС1 и НС1) в воде.
Ответ: m(KCl) = 33,3 г; m(HCl) = 3,7г.
Задача 3.
Теперь рассмотрим обратную ситуацию, когда к раствору НС1 мы добавили больше КОН, чем это необходимо для полной нейтрализации. В этом случае КОН будет в избытке, а НС1 — в недостатке. Посмотрим, какие вещества и в каких количествах будут находиться в растворе после реакции, если к раствору, содержащему 20 г НС1 добавить избыточное количество КОН, например, 40 г.
Дано:
масса хлороводорода: m(НС1) = 20 г;
масса гидроксида калия: m(КОН) = 40 г.
Найти: Массы всех веществ в растворе после реакции.
Решение:
КОН взят в избытке, следовательно, НС1 находится в недостатке. НС1 в реакции израсходуется весь, а КОН частично израсходуется и частично останется. В результате реакции образуется соль КС1. Образующаяся вода разбавит имеющийся раствор. Следовательно, качественный состав раствора после реакции будет следующим:
1. Избыточный гидроксид калия (КОН);
2. Образующаяся соль КС1;
3. Вода в виде растворителя.
Массу образовавшейся соли КС1 можно определить путем расчета по химической реакции, а массу оставшегося КОН по разности:
m(КОН)оставшийся после р-ии = m(КОН)исх – m(КОН)расход в р-ии
Массу расходовавшегося КОН можно определить по уравнению реакции.
Напомним, что в задачах на избыток-недостаток расчет по уравнению реакции всегда ведут по веществу, взятому в недостатке. В данном случае по НС1:
Находим массу образовавшейся соли. Для этого составим пропорцию:
20г НС1 даютуг x г КСl (по условию)
36,5г НС1 дают 74,5 г КС1 (по уравнению)
Находим массу расходовавшегося КОН. Для этого составим пропорцию:
20 г НС1 расходуется на х г КОН (по условию)
36,5 г НС1 расходуется на 56 г КОН (по уравнению)
Теперь мы можем определить массу КОН, который остался неизрасходованным:
Итак, в результате добавления 40 г КОН к раствору, содержащему 20 г НС1, образовалось 40,8 г КС1 и осталось 9,3 г неизрасходованного КОН. Таким образом, получился раствор двух веществ (КС1 и КОН) в воде.
Комментарии:
1 В условиях задач на определение избытка-недосатка не указывается, какое вещество в избытке, а какое в недостатке. Более того, в условии нет прямого указания на то, что это задача на избыток-недостаток. Поэтому, в первую очередь, перед нами стоит два вопроса:
1. Как отличить задачу на избыток-недостаток от всех остальных задач?
2. Как определить, какое вещество взято в избытке?
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
Очень часто при проведении реакции между веществами оказывается, что один реагент прореагировал полностью, а другой нет. В таком случае говорят, что вещество, которое полностью израсходовалось, было в недостатке, а то вещество, которое осталось – в избытке. Поскольку избыток реагента не участвует в реакции, количество продукта зависит только от количества вещества, которое было в недостатке.
Предположим, что осуществляется реакция между веществами А и B, которая протекает в соответствии с уравнением:
Для осуществления этой реакции было взято количество вещества A, равное nA, и количество вещества B, равное nB. Определить то, какое вещество в избытке, а какое в недостатке, можно, сравнив выражения:
В зависимости от того, какое выражение окажется меньше, то вещество соответственно и будет в недостатке.
Примечание: распространенной ошибкой является то, что вместо выражений (1) сравнивают просто количества веществ. Так делать категорически не допускается! Если n(A) > n(B), то это еще не значит, что вещество A в избытке!
После того, как будет установлено то, какое вещество было в недостатке, расчеты ведутся по его количеству аналогично рассмотренным в главе 4.3.3.
Пример задачи на избыток и недостаток
Нагрели смесь 54 г алюминия и 80 г серы. Вычислите массу образовавшегося сульфида алюминия.
Решение
Запишем уравнение реакции:
Рассчитаем количества веществ алюминия и серы:
n(Al) = m(Al)/M(Al) = 54/27 = 2 моль;
n(S) = m(S)/M(S) = 80/32 = 2,5 моль
Для того чтобы выяснить, какое из исходных веществ в недостатке, разделим количества молей веществ на коэффициенты перед этими веществами в уравнении и сравним рассчитанные выражения:
Значит сера в недостатке. Расчеты далее ведем по количеству вещества серы.
Исходя из уравнения реакции
следует, что количество прореагировавшей серы и образовавшегося в результате реакции сульфида алюминия связаны выражением:
где 3 и 1 – коэффициенты перед S и Al2S3 соответственно. Отсюда:
Следовательно, масса сульфида алюминия будет равна:
В случае, если вместо массовой доли чистого вещества дается массовая доля примесей, то учитывая, что:
мы можем записать, что:
Пример задачи на расчет количества продукта, зная массу реагента с примесями
Какой объем углекислого газа (н.у.) выделится при действии избытка соляной кислоты на технический карбонат кальция массой 150 г, содержащий 10% некарбонатных примесей.
Решение:
Запишем уравнение взаимодействия карбоната кальция с соляной кислотой:
Массовая доля примесей в техническом карбонате кальция составляет 10%, значит массовая доля чистого карбоната кальция будет составлять:
ω(CaCO3) = 100% — ω(прим.) = 100% — 10% = 90%.
Масса чистого карбоната кальция будет равна:
m(CaCO3) = ω(CaCO3) ∙ m(CaCO3 техн.)/100% = 90% ∙ 150 г/100% = 135 г,
Следовательно, количество вещества карбоната кальция равно:
n(CaCO3) = m(CaCO3)/M(CaCO3) = 135 г / 100 г/моль = 1,35 моль
В соответствии с уравнением реакции:
Количества веществ карбоната кальция и углекислого газа равны (одинаковые коэффициенты в уравнении), следовательно:
Тогда, зная, что один моль любого газа при нормальных условиях занимает объем 22,4 л, мы можем рассчитать объем выделившегося CO2:
V(CO2) = n(CO2) ∙ Vm = 1,35 моль ∙ 22,4 л/моль = 30,24 л
Как пишется избыток в химии
В условиях задач такого типа указаны массы или объёмы двух реагирующих веществ, одно из которых дано в избытке, поэтому при решении таких задач нужно определить, какое вещество взято в избытке. Расчёт массы или объёма продукта реакции ведётся по данным вещества взятого в недостатке.
I. Алгоритм решения задачи: «Вычисление массы или количества продукта реакции, если один из реагентов взят в избытке»
Пример 1. Смешали два раствора, содержащих соответственно 33,3г хлорида кальция и 16,4г фосфата натрия. Вычислите массу осадка.
Последовательность выполнения действий
Оформление решения задачи
1. Записываем условие задачи
2. Вычислим молярные массы для формул, записанных вдано
3. Вычислим количества веществ, масса которых дана в условии
4. Запишем УХР. Расставим коэффициенты.
Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби.
CaCl2 – взят в избытке, расчёт ведём по недостатку, т.е. поNa3PO4.
6. Вычислим количество вещества, массу которого нужно найт
7.Вычислим искомую массу
Пример 2. Вычислите объём водорода (н.у.), который образуется при взаимодействии 6,5 г цинка с соляной кислотой массой 7,5 г.
Последовательность выполнения действий
Оформление решения задачи
1. Записываем условие задачи
2. Вычислим молярные массы для веществ с известной массой, записанных в дано
3. Вычислим количества веществ, масса которых дана в условии
ν(Zn) = m/M= 6,5/65г/моль=0,1моль
4. Запишем УХР. Расставим коэффициенты.
Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби.
НCl – взят в избытке, расчёт ведём по недостатку, т.е. по Zn.
6. Вычислим количество вещества, объём которого нужно найти
7.Вычислим искомый объём
Расчёты по уравнению реакции, если один из реагентов взят в избытке
Дано: m (ν, V, W) реагентов
Найти: m (ν, V, W) продукта
1. Составляем уравнение реакции
2. Нахождение количества вещества реагентов ν(А) и ν(В):
3. Сравнение дробей – нахождение недостатка:
Если, ν(А)/a > ν(В)/b, то вещество В в недостатке, расчёт ν(С) ведём по ν(В)
© 2017 Персональный сайт учителя химии Кардаевой Татьяны Александровны. Все права защищены.
Hекоторые файлы и информация, находящиеся на данном сайте, были взяты из методической литературы, найдены в сети Интернет, как свободно распространяемые (авторство данных материалов сохранено). Если Вы являетесь правообладателем той или иной продукции или информации, и условия, на которых она представлена на данном ресурсе, не соответствуют действительности, просьба сообщить об этом с целью устранения правонарушения.





m.jpg)
m.jpg)
m.jpg)

m.jpg)
m.jpg)
m.jpg)
_1.jpg)
_2.jpg)
_3.jpg)