Метанол: химические свойства и получение
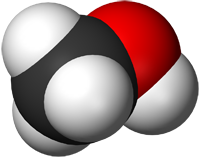
Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Строение метанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5 о С).
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Метанол смешивается с водой в любых соотношениях.
Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
| Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
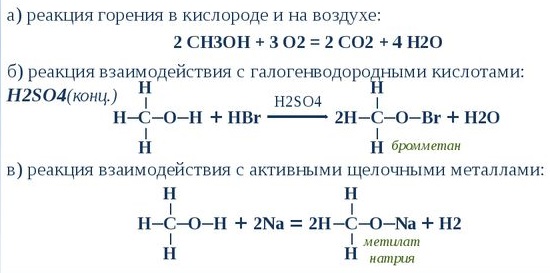
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, метилат калия разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, метанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии метанола с аммиаком образуется метиламин. |
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, метанол взаимодействует с азотной кислотой : |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140 о С образуется диметиловый эфир: |
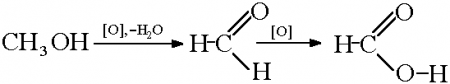
4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
Получение метанола
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании формальдегида образуется метанол |
CH2=O + H2 → CH3-OH
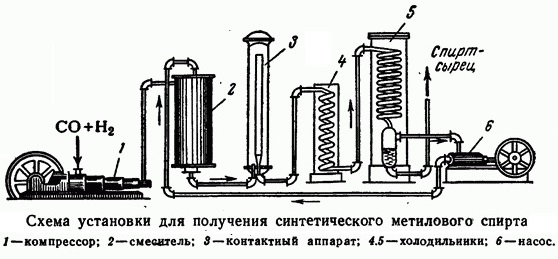
4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
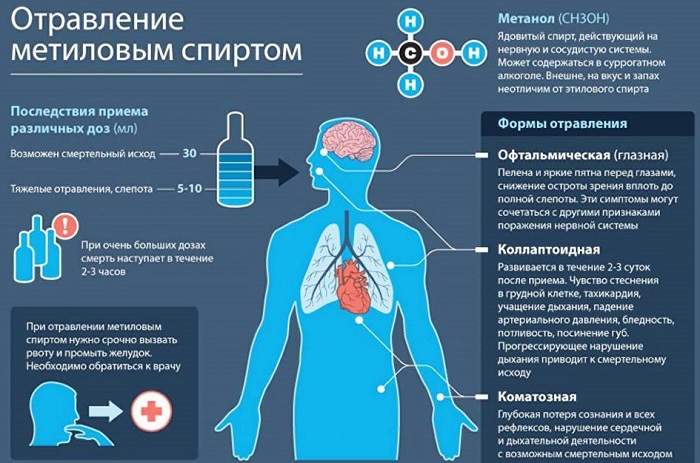
Метанол это химическое вещество, называемое древесным или метиловым спиртом. Его получение не является сложным, поскольку он относится к одноатомным продуктам. Использование в алкогольных напитках может привести к пищевому отравлению. Он также может образовывать взрывоопасные смеси при температуре 8 градусов по Цельсию.
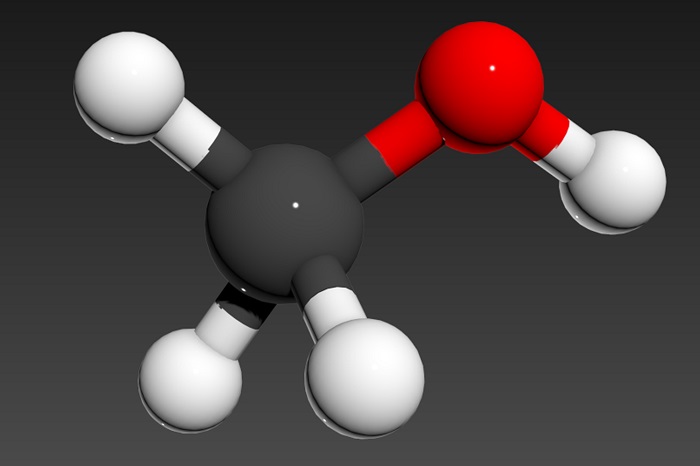
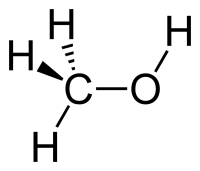
Молекулярная и структурная формула метанола
Чтобы правильно понимать суть происходящего, стоит обратить внимание на название вещества. В его составе 4 атома водорода и по одному атому углерода и кислорода.
Молекулярная формула выглядит так — CH3OH.
Структура отображается в таблице следующим образом:
Процент содержания массы
Молярный вес каждого по отдельности
История открытия
Впервые это вещество обнаружил Роберт Бойль. В 1661 г. он успешно завершил первую сухую перегонку древесины. В чистом виде метанол получилось выделить только через 170 лет.
В 1834 г. два французских химика установили его химическую формулу. А еще через 23 года впервые получили через омыление метилхлорида.
Производство метанола
Промышленность занимается его выпуском в крупных масштабах. Причем способов для этого довольно много. Одним из самых востребованных является синтезирование метана.
Процесс реакции связан с неполным окислением и образованием формы эфира. Еще один способ, разрешенный стандартами ГОСТ, связан с разложением солевых отложений муравьиной кислоты.
Применение метилового спирта
Органическая химия использует его как растворитель. Нефтегазовая и техническая промышленность с его помощью предотвращает появление кристаллических соединений. Это связано с низкой температурой порога замерзания.
В домашних условиях синтез подразумевает окрашивание с помощью лакокрасочных продуктов. Ведь их получение и начальная консистенция зависит от нескольких составляющих.
Насчет суррогатного алкоголя стоит понять одну простую вещь. При попадании в организм, вред неизбежен и необратим вообще. Вероятность отравления и смертельного исходя очень высока.
Физические свойства
По сути, метанол это бесцветная жидкость. Теплопроводные свойства древесного спирта в два раза меньше, чем у бензина. Участвует в образовании взрывоопасных веществ из-за собственной горючести. Температура кипения метанола 64,7 0 С.
Температура горения начинается от 460 градусов. Смешивается с различными жидкостями без каких-либо проблем. Таким способом получения добиваются образования веществ на жидкой основе, не содержащих алифатические углеводы. Азеотропные смеси появляются после тщательного смешивания с ацетоном или дихлорэтаном. Очень токсичен.
Химические свойства и реакции
Как и горючие смеси, метанол имеет собственное октановое число, даже в газообразном состоянии. Оно равняется 111 единицам, что допускает использование в двигателях внутреннего сгорания. Причем это получается даже в состоянии метилового спирта.
Также возможен вариант замены водорода щелочными металлами. Сложные эфиры получаются при взаимодействии с карбоновыми кислотами или минеральными. Положительно реагирует на галогениды фосфора.
Нахождение в природе
Очень редко такое вещество можно обнаружить в свободном состоянии. Даже если удается случайно наткнуться, то количество будет крайне мало. Зато компоненты для производства находятся практически везде. Это растительные масла, различные породы деревьев, почвы и даже минералов.
Класс опасности древесного спирта
Влияние на человеческий организм
Патологические изменения наступают после превышения допустимой нормы. Но слепота это только начало. Дальнейшие действия приведут к поражению участков головного мозга, полному нарушению работы мочевыводящих органов.
Заключение
В высокоразвитых странах метанол добавляют в топливо для автомобилей. Ведь благодаря его свойствам и взаимодействию с горючими веществами, получается экологически чистый продукт. В Российской Федерации использование в качестве товаров для потребителей запрещено по закону. Очень много случаев отравления с летальным исходом.
Метанол ГОСТ 2222-95
| Метанол | |
|---|---|
 | |
 | |
 | |
| Систематическое наименование | Метанол |
| Традиционные названия | Метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила |
| Хим. формула | СН3OH |
| Состояние | жидкость |
| Молярная масса | 32,04 г/моль |
| Плотность | 0,7918 г/см³ |
| Динамическая вязкость | 5.9×10 −4 Па·с |
| Энергия ионизации | 10,84 ± 0,01 эВ |
| Т. плав. | -97 °C |
| Т. кип. | 64,7 °C |
| Т. разл. | 320-380 °C |
| Т. всп. | 6 °C |
| Т. воспл. | 13 °C |
| Т. свспл. | 440 °C |
| Пр. взрв. | 6,98-35,5 % |
| Тройная точка | 175,45 K (−97,7°C) |
| Кр. точка | 513,15 K (240 °C), 7,85 МПа |
| Энтальпия образования | -238 кДж/моль |
| Энтальпия сгорания | 726 000 Дж/моль |
| Энтальпия плавления | 3167,29 ± 0,01 Дж/моль |
| Энтальпия кипения | 37 400 Дж/моль |
| Удельная теплота испарения | 37,4 кДж/моль |
| Давление пара | 11,8 кПа (при 20 °С) |
| pKa | 15,5 |
| Дипольный момент | 1,65 Д |
| ГОСТ | ГОСТ 2222-95 ГОСТ 6995-77 |
| Рег. номер CAS | 67-56-1 |
| PubChem | 887 |
| Рег. номер EINECS | 200-659-6 |
| SMILES | |
| RTECS | PC1400000 |
| ChEBI | 17790 |
| Номер ООН | 1230 |
| ChemSpider | 864 |
| Токсичность | умеренно-токсичен для мелких животных, высокотоксичен для крупных животных и человека, поражает зрительный нерв   |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Метанол (метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила) — CH3OH, простейший одноатомный спирт, бесцветная ядовитая жидкость, контаминант. Метанол — это первый представитель гомологического ряда одноатомных спиртов.
С воздухом в объёмных концентрациях 6,98—35,5 % образует взрывоопасные смеси (температура вспышки 8 °C). Метанол смешивается в любых соотношениях с водой и большинством органических растворителей.
Содержание
История
Метанол был впервые обнаружен Бойлем в 1661 году в продуктах сухой перегонки древесины. Через два столетия, в 1834 году, его выделили в чистом виде Ж. Б. Дюма и Э. М. Пелиго. Тогда же была установлена химическая формула метанола. В 1857 году Бертло получил метанол омылением метилхлорида.
Получение
Известно несколько способов получения метанола: сухая перегонка древесины и лигнина, термическое разложение солей муравьиной кислоты, синтез из метана через метилхлорид с последующим омылением, неполное окисление метана и получение из синтез-газа. Первоначально в промышленности был освоен метод получения метанола сухой перегонкой древесины, но впоследствии он потерял своё промышленное значение. Современное производство метанола из монооксида углерода и водорода впервые было осуществлено в Германии компанией BASF в 1923 году. Процесс проводился под давлением 10—35 МПа на цинк-хромовом катализаторе (ZnO/Cr2O3) при температуре 320—450 °C. Впоследствии распространение получил синтез метанола на медьсодержащих катализаторах, промотированных цинком, хромом и др., при 200—300 °C и давлении 5-10 МПа, разработанный в Англии.
Современный промышленный метод получения — синтез из оксида углерода(II) и водорода на медь-цинковом оксидном катализаторе при следующих условиях:
Схема механизма каталитического получения метанола сложна и суммарно может быть представлена в виде реакции:
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В настоящее время этот способ неактуален.
Молекулярная формула — CH4O или CH3—OH
Производство метанола (в тыс. тонн):
| год | США | Германия | Мир | Цена продажи($/т) |
|---|---|---|---|---|
| 1928 | 24 | 18 | 140 | 84,7 |
| 1936 | 97 | 93 | 305 | 88,9 |
| 1950 | 360 | 120 | 349 | 83,1 |
| 1960 | 892 | 297 | 3930 | 99,7 |
| 1970 | 2238 | нет данных | 5000 | 89,7 |
| 1980 | 3176 | 870 | 15000 | 236,1 |
| 2004 | 3700 | 2000 | 32000 | 270 |
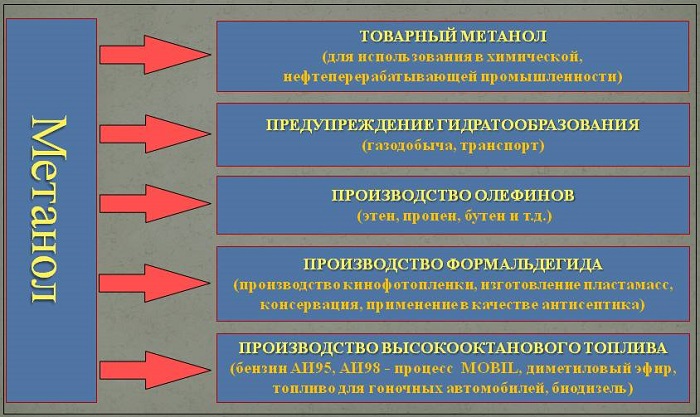
Применение
В органической химии метанол используется в качестве растворителя.
Метанол используется в газовой промышленности для борьбы с образованием гидратов (из-за низкой температуры замерзания и хорошей растворимости). В органическом синтезе метанол применяют для выпуска формальдегида, формалина, уксусной кислоты и ряда эфиров (например, МТБЭ и ДМЭ), изопрена и др.
Наибольшее его количество идёт на производство формальдегида, который используется для производства карбамидоформальдегидных и фенолформальдегидных смол. Значительные количества CH3OH используют в лакокрасочной промышленности для изготовления растворителей при производстве лаков. Кроме того, его применяют (ограниченно из-за гигроскопичности и отслаивания) как добавку к жидкому топливу для двигателей внутреннего сгорания.
Благодаря высокому октановому числу, позволяещему увеличить степень сжатия до 16, увеличивая тем самым удельную мощность двигателя; метанол используется для заправки гоночных мотоциклов и автомобилей. Метанол горит в воздушной среде, и при его окислении образуется двуокись углерода и вода:
Для получения биодизеля растительное масло переэтерифицируется метанолом при температуре 60 °C и нормальном давлении приблизительно так: 1 т масла + 200 кг метанола + гидроксид калия или натрия.
Во многих странах метанол применяется в качестве денатурирующей добавки к этанолу при производстве парфюмерии. В России использование метанола в потребительских товарах запрещено. В России запрещено использование метилового спирта в средствах по уходу за автотранспортом, а также продажа населению указанных средств, содержащих метанол.
Используется в топливных элементах. Работа топливных элементов основана на реакции окисления метанола на катализаторе в диоксид углерода. Вода выделяется на катоде. Протоны (H + ) проходят через протонообменную мембрану к катоду где они реагируют с кислородом и образуют воду. Электроны проходят через внешнюю цепь от анода к катоду снабжая энергией внешнюю нагрузку.
Общая для топливного элемента:
Получение муравьиной кислоты окислением метанола:
Получение диметилового эфира дегидратацией метанола при 300—400 °C и 2-3 МПа в присутствии гетерогенных катализаторов — алюмосиликатов — степень превращения метанола в диметиловый эфир — 60 % или цеолитов — селективность процесса близка к 100 %. Диметиловый эфир (C2H6O) — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38-53.
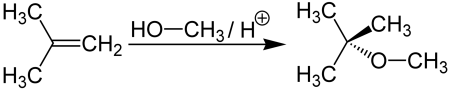
Метил-трет-бутиловый эфир получается при взаимодействии метанола с изобутиленом в присутствии кислых катализаторов (например, ионообменных смол):
Метил-трет-бутиловый эфир (C5H12O) применяется в качестве добавки к моторным топливам, повышающей октановое число бензинов (антидетонатор). Максимальное законодательное содержание МТБЭ в бензинах Европейского союза — 15 %, в Польше — 5 %. В России в среднем составе бензинов содержание МТБЭ составляет до 12 % для АИ92 и до 15 % для АИ95, АИ98.
Отдельным направлением является использование метанола для переэтерификации жиров в производстве биодизеля.
Гомологизация метанола
Гомологизация, то есть превращение органического соединения в свой гомолог путём внедрения одной или нескольких метиленовых групп, для спиртов была впервые осуществлена в 1940 году — на основе метанола каталитическим путём под воздействием высокого давления был синтезирован этанол:
Реакция гомологизации по своему механизму близка реакции гидроформилирования алкенов и в настоящее время с помощью модифицированных катализаторов кобальта и рутения и добавления йодид-ионов в качестве промоторов удаётся добиться 90 % выхода по этанолу.
Исходный метанол также получают из окиси углерода (катализаторы на основе оксидов меди и цинка, давление 5—10 МПа, температура 250 °C), так что общая схема выглядит следующим образом:
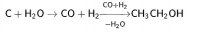
Побочными продуктами реакции в случае синтеза этанола будут ацетальдегид, этилен и диэтиловый эфир.
В 1940 году впервые была осуществлена катализируемая оксидом кобальта при давлении 600 атм реакция метанола с синтез-газом с образованием в качестве основного продукта этанола… Впоследствии эта реакция, названная гомологизацией, вызвала огромный интерес у химиков. Её привлекательность связана с возможностью получения этилена из угольного сырья Применение в качестве катализаторов карбонила кобальта Со2(СО)8 позволило понизить давление до 250 атм, при этом степень превращения метанола составила 70 %, а основной продукт — этанол образовывался с селективностью 40 %. В дальнейшем были предложены более селективные катализаторы на основе соединений кобальта и рутения с добавками фосфиновых лигандов и было установлено, что реакцию можно ускорить с помощью введения промоторов — иодид-ионов. В настоящее время удалось достичь селективности по этанолу 90 %. Хотя механизм гомологизации до конца не установлен, можно считать, что он близок к механизму карбонилирования метанола.
Биометанол
Промышленное культивирование и биотехнологическая конверсия морского фитопланктона рассматривается как одно из наиболее перспективных направлений в области получения биотоплива.
В начале 80-х рядом европейских стран совместно разрабатывался проект, ориентированный на создание промышленных систем с использованием прибрежных пустынных районов. Осуществлению этого проекта помешало общемировое снижение цен на нефть.
Первичное производство биомассы осуществляется путём культивирования фитопланктона в искусственных водоёмах, создаваемых на морском побережье.
Вторичные процессы представляют собой метановое брожение биомассы и последующее гидроксилирование метана с получением метанола.
Основными доводами в пользу использования микроскопических водорослей являются следующие:
С точки зрения получения энергии данная биосистема имеет существенные экономические преимущества по сравнению с другими способами преобразования солнечной энергии.
Метанол в качестве топлива
При применении метанола в качестве топлива следует отметить, что объёмная и массовая энергоёмкость (теплота сгорания) метанола (удельная теплота сгорания = 22,7 МДж/кг) на 40—50 % меньше, чем бензина, однако при этом теплопроизводительность спиртовоздушных и бензиновых топливовоздушных смесей при их сгорании в двигателе различается незначительно по той причине, что высокое значение теплоты испарения метанола способствует улучшению наполнения цилиндров двигателя и снижению его теплонапряженности, что приводит к повышению полноты сгорания спиртовоздушной смеси. В результате этого мощность двигателя повышается на 7—9 %, а крутящий момент на 10—15 %. Двигатели гоночных автомобилей, работающих на метаноле с более высоким октановым числом, чем бензин, имеют степень сжатия, превышающую 15:1, в то время как в обычном ДВС с искровым зажиганием степень сжатия для неэтилированного бензина как правило, не превышает 11,5:1. Метанол может использоваться как в классических двигателях внутреннего сгорания, так и в специальных топливных элементах для получения электричества.
Отдельно следует отметить увеличение индикаторного КПД при работе классического ДВС на метаноле по сравнению с его работой на бензине. Такой прирост вызван снижением тепловых потерь и может достигать единиц процентов.
| Топливо | Плотность энергии | Смесь воздуха с топливом | Удельная энергия смеси воздуха | Удельная теплота испарения | Октановое число (RON) | Октановое число (MON) |
|---|---|---|---|---|---|---|
| Бензин | 32 МДж/л | 14,6 | 2,9 МДж/кг воздух | 0,36 МДж/кг | 91—99 | 81—89 |
| Бутанол-1 | 29,2 МДж/л | 11,1 | 3,2 МДж/кг воздух | 0,43 МДж/кг | 96 | 78 |
| Этанол | 19,6 МДж/л | 9,0 | 3,0 МДж/кг воздух | 0,92 МДж/кг | 132 | 89 |
| Метанол | 16 МДж/л | 6,4 | 3,1 МДж/кг воздух | 1,2 МДж/кг | 156 | 92 |
Низкий уровень примесей метанола может быть использован в топливе существующих транспортных средств с использованием надлежащих ингибиторов коррозии. Т. н. европейская директива качества топлива (European Fuel Quality Directive) позволяет использовать до 3 % метанола с равным количеством присадок в бензине, продаваемом в Европе. Сегодня в Китае используется более 1000 млн галлонов метанола в год в качестве транспортного топлива в смесях низкого уровня, используемых в существующих транспортных средств, а также высокоуровневые смеси в транспортных средствах, предназначенных для использования метанола в качестве топлива.
Помимо применения метанола в качестве альтернативы бензина существует технология применения метанола для создания на его базе угольной суспензии, которая в США имеет коммерческое наименование «метакол» (methacoal). Такое топливо предлагается как альтернатива мазута, широко используемого для отопления зданий (Топочный мазут). Такая суспензия в отличие от водоуглеродного топлива не требует специальных котлов и имеет более высокую энергоемкость. С экологической точки зрения такое топливо имеет меньший «углеродный след», чем традиционные варианты синтетического топлива получаемого из угля с использованием процессов, где часть угля сжигается во время производства жидкого топлива.
Свойства метанола и его реакции
Метанол — бесцветная жидкость с алкогольным запахом (запах этилового спирта). Температура кипения +64,7 °C.
Удельный вес при 0°/0° = 0,8142 (Копп); при 15°/15° = 0,79726; при 25°/25° = 0,78941 (Perkin); при 64,8°/4° = 0,7476 (Шифф); при 0°/4° = 0,81015; при 15,56°/4° = 0,79589 (Dittmar и Fawsitt). Капиллярная постоянная при температуре кипения a ² =5,107 (Шифф); Критическая температура 241,9° (Шмидт). Упругость пара при 15° = 72,4 мм; при 29,3° = 153,4 мм; при 43° = 292,4 мм; при 53° = 470,3 мм; при 65,4° = 756,6 мм (Д. Коновалов). Теплота горения равна 170,6, теплота образования 61,4 (Штоман, Клебер и Лангбейн).
Метанол смешивается во всех отношениях с водой, этиловым спиртом и эфиром; при смешении с водой происходит сжатие и разогревание. Горит синеватым пламенем. Подобно этиловому спирту — сильный растворитель, вследствие чего во многих случаях может заменять этиловый спирт. Безводный метанол, растворяя небольшое количество медного купороса, приобретает голубовато-зеленое окрашивание, поэтому безводным медным купоросом нельзя пользоваться для открытия следов воды в метаноле; но он не растворяет CuSO4∙7H2O (Клепль).
Метанол (в отличие от этанола) с водой не образует азеотропной смеси, в результате чего смеси вода-метанол могут быть разделены ректификационной перегонкой. Температура кипения водных растворов метанола:
| Молярная доля метанола % | Т кип. °C, 760 мм. рт. ст. |
|---|---|
| 0 | 100 |
| 5 | 92,8 |
| 10 | 88,3 |
| 15 | 84,8 |
| 20 | 82 |
| 25 | 80,1 |
| 30 | 78,2 |
| 35 | 76,8 |
| 40 | 75,6 |
| 45 | 74,5 |
| 50 | 73,5 |
| 55 | 72,4 |
| 60 | 71,6 |
| 65 | 70,7 |
| 70 | 69,8 |
| 75 | 68,9 |
| 80 | 68 |
| 85 | 67,1 |
| 90 | 66,3 |
| 95 | 65,4 |
| 100 | 64,6 |
Метанол дает со многими солями соединения, подобные кристаллогидратам (сольваты), например: CuSO4 ∙ 2CH3OH; LiCl ∙ 3CH3OH; MgCl2 ∙ 6CH3OH; CaCl2 ∙ 4CH3OH представляет собой шестисторонние кристаллы, разлагаемые водой, но не разрушаемые нагреванием до 100° (Kane). Соединение BaO ∙ 2CH3OH ∙ 2H2O получается в виде блестящих призм при растворении BaO в водном метаноле и испарении на холоде полученной жидкости при комнатной температуре (Форкранд).
С едкими щелочами метанол образует соединения 5NaOH ∙ 6CH3OH; 3KOH ∙ 5CH3OH (Геттиг). При действии металлических калия и натрия легко даёт алкоголяты, присоединяющие к себе кристаллизационный метанол и иногда воду.
При пропускании паров метанола через докрасна накалённую трубку получается C2H2 и другие продукты (Бертло). При пропускании паров метанола над накалённым цинком получается окись углерода, водород и небольшие количества болотного газа (Jahn). Медленное окисление паров метанола при помощи раскаленной платиновой или медной проволоки представляет лучшее средство для получения больших количеств формальдегида: 2CH3OH+O2=2HCHO+2H2O. При действии хлористого цинка и высокой температуры метанол даёт воду и алканы, а также небольшие количества гексаметилбензола (Лебедь и Грин). Метанол, нагретый с нашатырём в запаянной трубке до 300°, даёт моно-, ди- и триметиламины (Бертло).
При пропускании паров метанола над KOH при высокой температуре выделяется водород и образуются последовательно формиат, ацетат и, наконец, карбонат калия.
Концентрированная серная кислота даёт метилсерную кислоту CH3HSO4, которая при дальнейшем нагревании с метанолом даёт метиловый эфир. При перегонке метанола с избытком серной кислоты в отгон переходит диметилсерная кислота (CH3)2SO4. При действии серного ангидрида SO3 получается CH(OH)(SO3H)2 и CH2(SO3H)2 (см. Метилен).
Метанол при действии соляной кислоты, пятихлористого фосфора и хлористой серы даёт хлористый метил CH3Cl. Действием HBr и H2SO4 получают бромистый метил. Подкисленный 5%-й серной кислотой и подвергнутый электролизу, метанол даёт CO2, СО, муравьинометиловый эфир, метилсерную кислоту и метилаль CH2(OCH3)2 (Ренар). При нагревании метанола с хлористо-водородными солями ароматических оснований (анилином, ксилидином, пиперидином) легко происходит замещение водорода в бензольном ядре метилом (Гофман, Ладенбург); реакция имеет большое техническое значение при приготовлении метилрозанилина и других искусственных пигментов.
Нахождение в природе
В свободном состоянии метиловый спирт встречается в природе лишь изредка и в очень небольших количествах (например в эфирных маслах), но производные его распространены довольно широко. Так, например, многие растительные масла содержат сложные эфиры метилового спирта: масла гаултерии — метиловый эфир салициловой кислоты C6H4(OH)COOCH3, масло жасмина — метиловый эфир антраниловой кислоты C6H4(NH2)COOCH3. Простые эфиры метилового спирта чрезвычайно часто встречаются среди природных веществ, например природных красителей, алкалоидов и т. п.
В промышленности метиловый спирт раньше получали исключительно путём сухой перегонки дерева. В жидких погонах, так называемом «древесном уксусе», наряду с уксусной кислотой (10 %), ацетоном (до 0,5 %), ацетальдегидом, аллиловым спиртом, метилацетатом, аммиаком и аминами содержится также 1,5—3 % метилового спирта. Для отделения уксусной кислоты продукты сухой перегонки пропускают через горячий раствор известкового молока, задерживающий её в виде уксуснокислого кальция. Значительно труднее отделить метиловый спирт от ацетона, так как температуры кипения их очень близки (ацетон, т.кип. 56,5°; метиловый спирт, т.кип. 64,7°). Все же путём тщательной ректификации на соответствующих колоннах в технике удается почти полностью отделить метиловый спирт от сопутствующего ему ацетона. Неочищенный метиловый спирт называется также «древесным спиртом».
Токсичность
В США максимальное допустимое суточное употребление метанола (референтная доза), подразумевая несвязанное с какими-либо эффектами на здоровье, установлено в размере 2 мг на кг веса тела (с 1988 года).
Предельно допустимая концентрация метанола в воздухе рабочей зоны равна 5 мг/м³ (у изопропилового спирта 10 мг/м³, у этанола — 1000 мг/м³), ПДК в воздухе населенных мест равна 1,0 мг/м³ (у изопропилового спирта 0,6 мг/м³, у этанола — 5 мг/м³).
Наиболее легкая форма отравления характеризуется наличием головной боли, общей слабостью, недомоганием, ознобом, тошнотой, рвотой.
Токсичность метанола состоит в том, что при попадании в организм он с течением времени окисляется до ядовитого формальдегида, который вызывает слепоту, вредно влияет на нервную систему, вступает в реакции с белками. Происходит так называемый летальный синтез.
Особая опасность метанола связана с тем, что по запаху и вкусу он неотличим от этилового спирта, из-за чего и происходят случаи его употребления внутрь. Йодоформная реакция: с этиловым спиртом выпадет йодоформ жёлтого цвета, а с метанолом ничего не выпадает (реакция не подходит для определения содержания метанола в растворе этанола).
Как указано в руководстве для врача скорой медицинской помощи, при отравлении метанолом антидотом является этанол, который вводится внутривенно в форме 10 % раствора капельно или 30—40 % раствора перорально из расчёта 1—2 грамма раствора на 1 кг веса в сутки. Полезный эффект в этом случае обеспечивается отвлечением фермента АДГ I на окисление экзогенного этанола.
Следует учесть, что при недостаточно точном диагнозе за отравление метанолом можно принять алкогольную интоксикацию, отравление 1,2-дихлорэтаном или четырёххлористым углеродом — в этом случае введение дополнительного количества этилового спирта опасно.
Отравления метанолом довольно часты. Так, в США в течение 2013 года зафиксировано 1747 случаев.
Массовые отравления метанолом
Известно множество массовых отравлений метанолом. Источником метанола могут быть фальсифицированные незамерзающие жидкости для автомобилей, контрафактный алкоголь, метанол, выдаваемый за этиловый спирт.