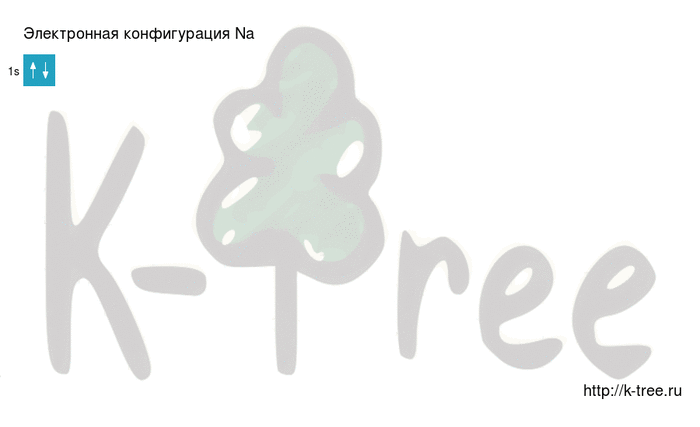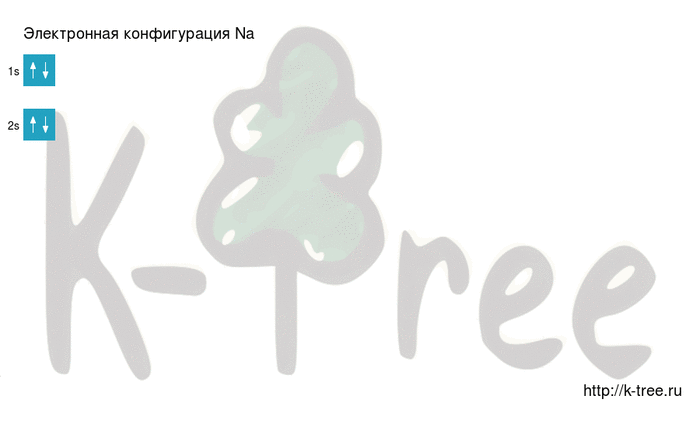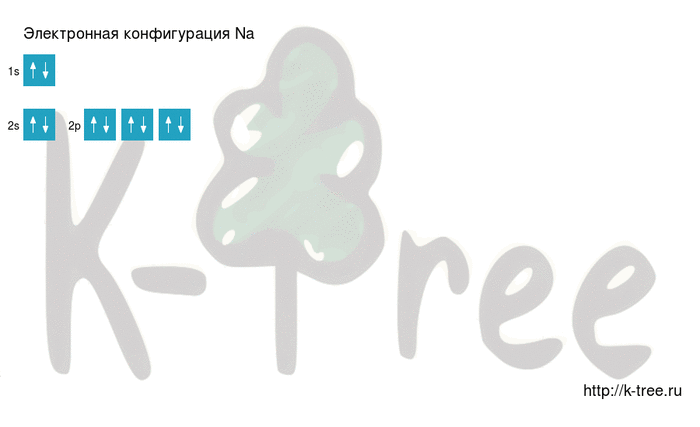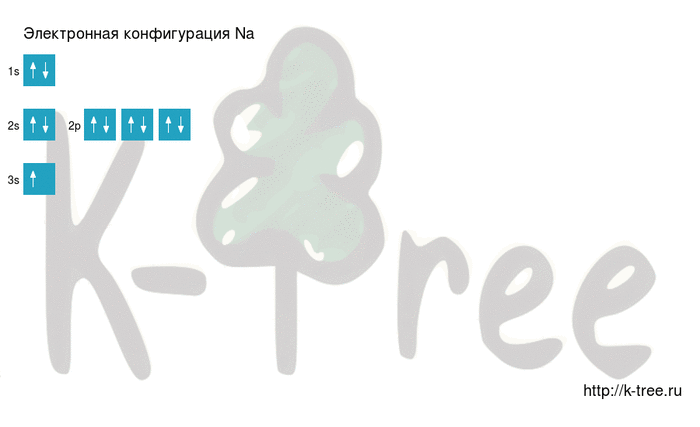Натрий (Na, Natrium)
История натрия
Натрий в чистом виде получил в 1807 году Хемфри Дэви – английский химик, который незадолго до натрия открыл калий. Дэви проводил процесс электролиза одного из соединений натрия – гидроксида, расплавив который и получил натрий. Соединениями натрия человечество пользовалось со времён глубокой древности, содой природного происхождения пользовались ещё в Древнем Египте (calorizator). Называли элемент содий (sodium), иногда именно это название можно встретить даже сейчас. Привычное название натрий (от латинского natrium – сода) было предложено шведом Йенсом Берцелиусом.
Общая характеристика натрия
Натрий является элементом I группы III третьего периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 11 и атомную массу 22,99. Принятое обозначение – Na (от латинского natrium).
Нахождение в природе
Соединения натрия содержатся в земной коре, морской воде, в виде примеси, имеющей свойство окрашивать каменную соль в синий цвет из-за действия радиации.
Физические и химические свойства
Натрий является мягким пластичным щелочным металлом, имеет серебристо-белый цвет и блеск на свежем срезе (натрий вполне возможно разрезать ножом). При применении давления превращается в прозрачное вещество красного цвета, при обычной температуре кристаллизуется. При взаимодействии с воздухом быстро окисляется, поэтому хранить натрий необходимо под слоем керосина.
Суточная потребность в натрии
Натрий – важный для организма человека микроэлемент, суточная потребность в нём для взрослых составляет 550 мг, для детей и подростков – 500-1300 мг. В период беременности норма натрия в сутки составляет 500 мг, а в некоторых случаях (обильное потоотделение, обезвоживание, приём мочегонных препаратов) должна быть увеличена.
Продукты питания богатые натрием
Натрий содержится практически во всех морепродуктах (раках, крабах, осьминогах, кальмарах, мидиях, морской капусте), рыбе (анчоусах, сардинах, камбале, корюшке и т.д.), куриных яйцах, крупах (гречневой, рисе, перловой, овсяной, пшённой), бобовых (горохе, фасоли), овощах (томатах, сельдерее, моркови, капусте, свёкле), молочных продуктах и мясных субпродуктах.
Полезные свойства натрия и его влияние на организм
Полезными для организма свойствами натрия являются:
Усвояемость натрия
Натрий содержится практически во всех продуктах, хотя большую его часть (около 80%) организм получает из поваренной соли. Усвоение в основном происходит в желудке и тонком кишечнике. Витамин D улучшает усвоение натрия, однако, чрезмерно соленая пища и пища богатая белками препятствуют нормальному всасыванию.
Взаимодействие с другими
Повышенное потребление натрия вызывает накопление жидкости в организме, отеки, повышает кровяное давление. Большой прием натрия (соли) приведет к истощению запасов калия, кальция и магния.
Применение натрия в жизни
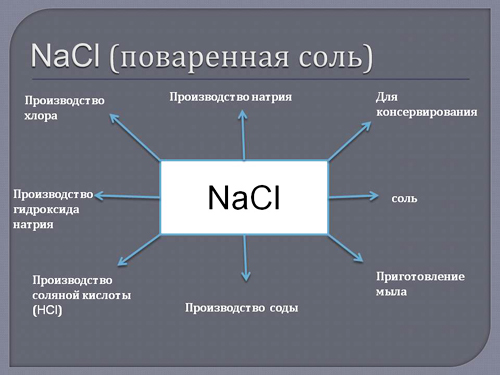
Применение металлического натрия – химическая и металлургическая промышленность, где он выступает в роли сильнейшего восстановителя. Хлоридом натрия (поваренной солью) пользуются все без исключения жители нашей планеты, это самое известное вкусовое средство и древнейший консервант.
Признаки нехватки натрия
Нехватка натрия обычно случается при чрезмерном потоотделении – в жарком климате или при физических нагрузках. Недостаток натрия в организме характеризуется ухудшением памяти и потерей аппетита, головокружением, быстрой утомляемостью, обезвоживанием, мышечной слабостью, а иногда – судорогами, кожными высыпаниями, желудочными спазмами, тошнотой, рвотой.
Признаки избытка натрия
Излишнее количество натрия в организме даёт о себе знать постоянной жаждой, отёками и аллергическими реакциями.
Натрий Na
Натрий в таблице менделеева занимает 11 место, в 3 периоде.
| Символ | Na |
| Номер | 11 |
| Атомный вес | 22.9897693 |
| Латинское название | Natrium |
| Русское название | Натрий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема натрия
Порядок заполнения оболочек атома натрия (Na) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Натрий имеет 11 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
1 электрон на 3s-подуровне
Степень окисления натрия
Ионы натрия
Валентность Na
Атомы натрия в соединениях проявляют валентность I.
Валентность натрия характеризует способность атома Na к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Na
Квантовые числа определяются последним электроном в конфигурации, для атома Na эти числа имеют значение N = 3, L = 0, Ml = 0, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Соединения натрия
| Тип | Формула | Название |
|---|---|---|
| Соль | NaHCO3 | Пищевая сода |
| Основание | NaOH | Гидроксид натрия |
| Минерал | FeCr2O4 | Хромит |
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Натрий как химический элемент таблицы Менделеева
Как был открыт Натрий
Где и как добывают Натрий
Такой химический элемент как натрий в чистом виде, обычно, не встречается из-за его высокой реакционной способности. В коммерческих целях ежегодно добывается около 100 тысяч тонн натрия. Это цифра так мала потому что этот химический элемент используется исключительно в узконаправленных областях. В конце 19 века его в коммерческих целях получали путем углеродотермического восстановления из карбоната натрия. Для осуществления реакции нужна температура около 1100°C. Сегодня чистый натрий получают путем электролиза расплавленного хлорида натрия. Этот процесс был запатентован в 1924 году.
Эта реакция проводится в так называемой ячейке Даунса, в которой NaCl смешивают с хлоридом кальция, чтобы понизить температуру плавления ниже 700 °С. Поскольку кальций менее электроположителен, чем натрий, кальций не будет осаждаться на катоде. Этот метод дешевле, чем предыдущий процесс Кастнера (электролиз гидроксида натрия ).
Распространенность Натрия
По распространенности во Вселенной атомы натрия занимают 14 место. Этот химический элемент является компонентом многих небесных тел. Если взять спектральное исследование света, то желтая линия натрия присутствует во многих звездах. Так же как и в нашем солнечном свете.
Что же касается Земли, то натрий является седьмым по распространенности элементом. Так же в номинации самый распространенный металл, он занимает почетное пятое место после алюминия, железа, кальция и магния. Если рассматривать процентное соотношение, то атомы натрия составляют около 2,5% от всех атомов планеты. Сама цифра кажется небольшой, но если задуматься, то это колоссальная величина. Большим запасом натрия является морская вода. В одном литре морской воды содержится около 11 ионов натрия.
Так же в природе натрий встречается в виде естественных минералов. Самыми распространенными из которых являются альбит и алигоклаз и галит.
Применение Натрия
Применение натрия не очень широкое и узконаправленное. Его применение основано на физических и химических свойствах. В промышленных масштабах натрий используется как катализатор в реакциях при изготовлении каучука. Так же нужно отметить его в двигателях внутреннего сгорания. В ДВС выпускающие клапаны изготовленны из металла с примесью натрия, для увеличения отвода тепла и избежания повреждений. Так же во многих охлаждающих жидкостях для двигателей внутреннего сгорания имеется натриевая примесь. Еще одно применение это натриевые лампы, которые обеспечивают хорошую рассеиваемость света. Основное применение таких ламп — это уличные фонари характерного желтого цвета. Натрий так же используется в химических реакциях в качестве восстановителя для обработки таких металлов как алюминий, титан, уран или цирконий.
Стоит отметить еще химическую промышленность. Там натрий находит применение в составе противооблединительной жидкости, которыми зимой поливают дороги. Так же натриевые примеси исспользуются при изготовлении удобрений и пищевых добавок, которые встречаются в очень многих продуктах питания. Еще можно отметить отрасли производящие бумагу, стекло и мыло, в которых натрий является важнейшим компонентом.
Интересные факты
Интересных фактов связанных с натрием достаточно много. Стоит начать с обычной соли. Ведь повареная соль представляет собой соединение натрия и хлора. Доказано учеными, что содержание натрия в организме человека значительно влияет на артериальное давление. Чрезмерное употребление соли могут приводить к гипертонии. Нормой потребления соли является не более 5 граммов в сутки. Эти люди, которые придерживаются этой нормы на 15% меньше подвержены риску гипертонии.
Еще одним интересным моментом является опасность натрия. Чистый натрий при взаимодействии с водой образует гидроксид натрия и выделяет опасную концентрацию водорода, которая способна взорваться. Натриевые пожары нельзя тушить водой и пеной из-за возможности взрыва. В таких случаях применяются специальные огнетушители класса D. И стоить отметить, что не все огнетушители этого класса пригодны для тушения натриевых пожаров. О таких пожарах вы могли слышать на нефтяных и газовых месторождениях. Еще одним интересным моментом является то, что натрий очень мягкий металл. Если взять натрий в чистом виде, то его можно разрезать кухонным ножом.
Натрий
На́трий — химический элемент с атомным номером 11 в периодической системе, обозначается символом Na (лат. Natrium ), мягкий щелочной металл серебристо-белого цвета.
| Натрий (Na) | |
|---|---|
| Атомный номер | 11 |
| Внешний вид | серебристо-белый мягкий металлМеталлический натрий сохраняемый в ксилоле |
| Свойства атома | |
| Атомная масса (молярная масса) | 22,989768 а. е. м. (г/моль) |
| Радиус атома | 190 пм |
| Энергия ионизации (первый электрон) | 495,6(5,14) кДж/моль (эВ) |
| Электронная конфигурация | [Ne] 3s 1 |
| Химические свойства | |
| Ковалентный радиус | 154 пм |
| Радиус иона | 97 (+1e) пм |
| Электроотрицательность (по Полингу) | 0,93 |
| Электродный потенциал | -2,71 в |
| Степени окисления | 1 |
| Термодинамические свойства | |
| Плотность | 0,971 г/см³ |
| Удельная теплоёмкость | 1,222 Дж/(K·моль) |
| Теплопроводность | 142,0 Вт/(м·K) |
| Температура плавления | 370,96 K |
| Теплота плавления | 2,64 кДж/моль |
| Температура кипения | 1156,1 K |
| Теплота испарения | 97,9 кДж/моль |
| Молярный объём | 23,7 см³/моль |
| Кристаллическая решётка | |
| Структура решётки | кубическая объемноцентрированая |
| Период решётки | 4,230 Å |
| Отношение c/a | n/a |
| Температура Дебая | 150,00 K |
Содержание
История и происхождение названия
Натрий (а, точнее, его соединения) использовался с давних времён. Например, сода (натрон), встречающаяся в природе в водах натронных озёр в Египте. Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей. Плиний Старший пишет, что в дельте Нила соду (в ней была достаточная доля примесей) выделяли из речной воды. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или даже чёрный цвет.
Натрий впервые был получен английским химиком Хемфри Дэви в 1807 году электролизом твердого NaOH.
Название «натрий» (natrium) происходит от араб. натрун (по-гречески — nitron). Первоначально оно относилось к природной соде.
Получение
Первым способом получения натрия стала реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000°C:
Затем появился другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия.
Физические свойства
Металлический натрий сохраняемый в ксилоле
Химические свойства
Щелочной металл, на воздухе легко окисляется. Для защиты от кислорода воздуха хранят металлический натрий под слоем керосина.
Применение
Хлорид натрия (поваренная соль) — древнейшее применяемое вкусовое и консервирующее средство.
Азид натрия применяется в качестве азотирующего средства в металлургии и при получении азида свинца.
Цианид натрия применяется при гидрометаллургическом способе выщелачивания золота из горных пород, а так же при нитроцементации стали и в гальванотехнике (серебрение, золочение).
Хлорат натрия применяется для уничтожения нежелательной растительности на железнодорожном полотне.
Биологическая роль
В организме находится только в виде солей. Отвечает за поддержание осмотического давления всех тканей и клеток организма. Участвует в образовании потенциала действия нервных клеток ( Натриевый насос ).
См. также
Ссылки
af:Natrium ar:صوديوم ast:Sodiu bg:Натрий bn:সোডিয়াম bs:Natrijum ca:Sodi co:Sodiu cs:Sodík cy:Sodiwm da:Natrium de:Natrium el:Νάτριο en:Sodium eo:Natrio es:Sodio et:Naatrium fa:سدیم fi:Natrium fr:Sodium he:נתרן hi:सोडियम hr:Natrij hu:Nátrium hy:Նատրիում id:Natrium io:Natro is:Natrín it:Sodio ja:ナトリウム jbo:sodna ko:나트륨 ku:Sodyûm la:Natrium lb:Natrium ln:Sodu lt:Natris lv:Nātrijs mi:Konutai mk:Натриум ml:സോഡിയം nl:Natrium nn:Natrium no:Natrium nov:Natrium oc:Sòdi pl:Sód pt:Sódio ro:Sodiu sh:Natrij simple:Sodium sk:Sodík sl:Natrij sq:Natriumi sr:Натријум sv:Natrium tg:Натрий th:โซเดียม tr:Sodyum ug:Natriy uk:Натрій uz:Natriy vi:Natri wa:Sodiom zh:钠 zh-yue:鈉
Натрий
Натрий — элемент главной подгруппы первой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 11. Обозначается символом Na (лат. Natrium). Простое вещество натрий (CAS-номер: 7440-23-5) — мягкий щелочной металл серебристо-белого цвета.
В воде натрий ведет себя почти так же, как литий: реакция идёт с бурным выделением водорода, в растворе образуется гидроксид натрия.
История и происхождение названия
Натрий (а точнее, его соединения) использовался с давних времён. Например, сода (натрон), встречающаяся в природе в водах натронных озёр в Египте. Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей. Плиний Старший пишет, что в дельте Нила соду (в ней была достаточная доля примесей) выделяли из речной воды. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или даже чёрный цвет.
Натрий впервые был получен английским химиком Хемфри Дэви в 1807 году электролизом твердого NaOH.
Название «натрий» (natrium) происходит от арабского натрун по-гречески — nitron и первоначально оно относилось к природной соде. Сам элемент ранее именовался содием Sodium.
Получение
Первым способом получения натрия стала реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000°C:
Затем появился другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия.
Физические свойства
Натрий — серебристо-белый металл, в тонких слоях с фиолетовым оттенком, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Величины электропроводности и теплопроводности натрия достаточно высоки, плотность равна 0,96842 г/см³ (при 19,7° С), температура плавления 97,86° С, температура кипения 883,15° С.
Химические свойства
Щелочной металл, на воздухе легко окисляется. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина. Натрий менее активный чем литий, поэтому с азотом реагирует только при нагревании:
При большом избытке кислорода образуется пероксид натрия
Применение
Металлический натрий широко используется в препаративной химии и промышленности как сильный восстановитель, в том числе в металлургии. Натрий используется в производстве весьма энергоёмких натриево-серных аккумуляторов. Его также применяют в выпускных клапанах грузовиков как теплоотвод. Изредка металлический натрий применяется в качестве материала для электрических проводов, предназначенных для очень больших токов.
В сплаве с калием, а также с рубидием и цезием используется в качестве высокоэффективного теплоносителя. В частности, сплав состава натрий 12 %, калий 47 %, цезий 41 % имеет рекордно низкую температуру плавления −78 °C и был предложен в качестве рабочего тела ионных ракетных двигателей и теплоносителя для атомных энергоустановок.
Натрий также используется в газоразрядных лампах высокого и низкого давления (НЛВД и НЛНД). Лампы НЛВД типа ДНаТ (Дуговая Натриевая Трубчатая) очень широко применяются в уличном освещении. Они дают ярко-жёлтый свет. Срок службы ламп ДНаТ составляет 12-24 тысяч часов. Поэтому газоразрядные лампы типа ДНаТ незаменимы для городского, архитектурного и промышленного освещения. Также существуют лампы ДНаС, ДНаМТ (Дуговая Натриевая Матовая), ДНаЗ (Дуговая Натриевая Зеркальная) и ДНаТБР (Дуговая Натриевая Трубчатая Без Ртути).
Металлический натрий применяется в качественном анализе органического вещества. Сплав натрия и исследуемого вещества нейтрализуют этанолом, добавляют несколько миллилитров дистиллированной воды и делят на 3 части, проба Ж. Лассеня (1843), направлена на определение азота, серы и галогенов (проба Бейльштейна)
— Хлорид натрия (поваренная соль) — древнейшее применяемое вкусовое и консервирующее средство.
— Азид натрия (Na3N) применяется в качестве азотирующего средства в металлургии и при получении азида свинца.
— Цианид натрия (NaCN) применяется при гидрометаллургическом способе выщелачивания золота из горных пород, а также при нитроцементации стали и в гальванотехнике (серебрение, золочение).
— Хлорат натрия (NaClO3) применяется для уничтожения нежелательной растительности на железнодорожном полотне.
Биологическая роль
В организме натрий находится большей частью снаружи клеток (примерно в 15 раз больше чем в цитоплазме). Это разницу поддерживает натрий-калиевый насос, который откачивает попавший внутрь клетки натрий.
Совместно с калием натрий выполняет следующие функции:
Создание условий для возникновения мембранного потенциала и мышечных сокращений.
Поддержание осмотической концентрации крови.
Поддержание кислотно-щелочного баланса.
Нормализация водного баланса.
Обеспечение мембранного транспорта.
Активация многих энзимов.
Рекомендуемая доза натрия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1200 до 2300 миллиграмм. В виде поваренной соли это составляет от 3 до 6 грамм в день.
Натрий содержится практически во всех продуктах, хотя большую его часть организм получает из поваренной соли. Усвоение в основном происходит в желудке и тонкой кишке. Витамин Д улучшает усвоение натрия, однако, чрезмерно соленая пища и пища богатая белками препятствуют нормальному всасыванию. Количество поступившего с едой натрия показывает содержание натрия в моче. Для богатой натрием пищи характерна ускоренная экскреция.
Дефицит натрия у питающегося сбалансированой пищей человека не встречается, однако, некоторые проблемы могут возникнуть при вегетарианских диетах. Временный дефицит может быть вызвано использованием мочегонных, поносом, обильным потением или избыточным употреблением воды. Симптомами нехватки натрия являются потеря веса, рвота, образование газов в желудочно-кишечном тракте, и нарушение усвоения аминокислот и моносахаридов. Продолжительный дефицит вызывает мышечные судороги и невралгию.
Переизбыток натрия вызывает отек ног и лица, а так же повышеное выделение калия с мочой. Максимальное количество соли, которое может быть переработано почками составляет примерно 20-30 грамм, большее количество уже опасно для жизни.
Соединения натрия
Натрий, Natrium, Na (11)
Название натрий — sodium, natrium происходит от древнего слова, распространенного в Египте, у древних греков (vixpov) и римлян. Оно встречается у Плиния (Nitron), у других древних авторов и соответствует древнееврейскому нетер (neter). В древнем Египте натроном, или нитроном, называли вообще щелочь, получаемую не только из природных содовых озер, но и из золы растений. Ее употребляли для мытья, изготовления глазурей, при мумификации трупов. В средние века название нитрон (nitron, natron, nataron), а также борах (baurach), относилось и к селитре (Nitrum). Арабские алхимики называли щелочи alkali. С открытием пороха в Европе селитру (Sal Petrae) стали строго отличать от щелочей, и в XVII в. уже различали нелетучие, или фиксированные щелочи, и летучую щелочь (Alkali volatile). Вместе с тем было установлено различие между растительной (Alkali fixum vegetabile — поташ) и минеральной щелочью (Alkali fixum minerale — сода).
В конце XVIII в. Клапрот ввел для минеральной щелочи название натрон (Natron), или натр и для растительной — кали (Kali), Лавуазье не поместил щелочи в «Таблицу простых тел», указав в примечании к ней, что это, вероятно, сложные вещества, которые когда-нибудь будут разложены. Действительно, в 1807 г. Дэви путем электролиза слегка увлажненных твердых щелочей получил свободные металлы — калий и натрий, назвав их потассий (Potassium) и содий (Sodium). В следующем году Гильберт, издатель известных «Анналов физики», предложил именовать новые металлы калием и натронием (Natronium); Берцелиус сократил последнее название до «натрий» (Natrium). В начале XIX в. в России натрий называли содием (Двигубский, 182i; Соловьев, 1824); Страхов предлагал название содь (1825). Соли натрия назывались, например, сернокислая сода, гидрохлоровая сода и одновременно уксусный натр (Двигубский, 1828). Гесс, по примеру Берцелиуса, ввел название натрий.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда