Оксид кальция: способы получения и химические свойства
Оксид кальция CaO — бинарное неорганическое вещество . Белый, гигроскопичный. Тугоплавкий, термически устойчивый, летучий при очень высоких температурах. Проявляет основные свойства.
Относительная молекулярная масса Mr = 56,08; относительная плотность для тв. и ж. состояния d = 3,35; tпл ≈ 2614º C; tкип = 2850º C.
Способ получения
1. Оксид кальция получается при разложении карбоната кальция при температуре 900 — 1200º C. В результате разложения образуется оксид кальция и углекислый газ:
2. В результате взаимодействия гидрида кальция и кислорода при температуре 300 — 400º С образуется оксид кальция и вода:
3. Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
2Ca + O2 = 2CaO
Химические свойства
1. Оксид кальция реагирует с простыми веществами :
Оксид кальция реагирует с углеродом (коксом) при температуре 1900 — 1950º С и образует угарный газ и карбид кальция:
CaO + 3C = CaC2 + CO
2. Оксид кальция взаимодействует со сложными веществами:
2.1. Оксид кальция взаимодействует с кислотами:
2.1.1. О ксид кальция с разбавленной соляной кислотой образует хлорид кальция и воду:
CaO + 2HCl = CaCl2 + H2O
2.1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
CaO + 2HF = CaF2↓ + H2O
2.1.3. Оксид кальция вступает в реакцию с разбавленной фосфорной кислотой, образуя фосфат кальция и воду:
2.2. Оксид кальция реагирует с оксидами:
2.2.1. Оксид кальция при комнатной температуре реагирует с углекислым газом с образованием карбоната кальция:
CaO + CO2 = CaCO3
2.2.2. Взаимодействуя с оксидом кремния при 1100 — 1200º С оксид кальция образует силикат кальция:
CaO + SiO2 = CaSiO3
2.3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция:
Оксид кальция
| Оксид кальция | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид кальция |
| Химическая формула | CaO |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Молярная масса | 56.077 г/моль |
| Плотность | 3.37 г/см³ |
| Термические свойства | |
| Температура плавления | 2570 °C |
| Температура кипения | 2850 °C |
| Молярная теплоёмкость (ст. усл.) | 42.05 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -635,09 кДж/моль |
Окси́д ка́льция (окись кальция, негашёная и́звесть или «кипелка», «кираби́т») — белое кристаллическое вещество, формула CaO.
Негашёная известь и продукт её взаимодействия с водой — Ca(OH)2 (гашёная известь или «пушонка») находят обширное использование в строительном деле.
Содержание
Получение
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ:
или при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Физические свойства
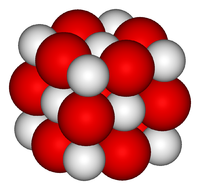
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
Химические свойства
Оксид кальция относится к основным оксидам. Растворяется в воде с выделением энергии, образуя гидроксид кальция:

Как основный оксид реагирует с кислотными оксидами и кислотами, образуя соли:

Применение
Основные объёмы используются в строительстве при производстве Силикатного кирпича. Раньше известь, так же использовали в качестве известкового цемента — при смешивании с водой, оксид кальция переходит в гидроксид, который далее, поглощая из воздуха углекислый газ, сильно твердеет, превращаясь в карбонат кальция. Однако в настоящее время известковый цемент при строительстве жилых домов стараются не применять, так как полученные строения обладают способностью впитывать и накапливать сырость.
Категорически недопустимо использование известкового цемента при кладке печей — из-за термического разложения и выделения в воздух удушливого диоксида углерода.
Некоторое применение также находит в качестве доступного и недорогого огнеупорного материала — плавленный оксид кальция имеет некоторую устойчивость к воздействию воды, что позволяет его использовать в качестве огнеупора там, где применение более дорогих материалов нецелесообразно.
В небольших количествах оксид кальция также используется в лабораторной практике для осушения веществ, которые не реагируют с ним.
В промышленности для удаления диоксида серы из дымовых газов, как правило используют 15% водяной раствор. В результате реакции гашеной извести и диоксида серы получается гипс СaСO3 и СаSO4. В эксперементальных установках добивались показателя в 98% отчиски дымовых газов от диоксида серы.
Так же используется в «самогреющей» посуде. Контейнер с небольшим количеством оксида кальция помещается между двух стенок стакана, а при прокалывании капсулы с водой начинается реакция с выделением тепла.
Кальция оксид
Кальция оксид
| Оксид кальция | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид кальция |
| Химическая формула | CaO |
| Молярная масса | 56.077 г/моль |
| Физические свойства | |
| Плотность вещества | 3.37 г/см³ |
| Состояние (ст. усл.) | твердое |
| Термические свойства | |
| Температура плавления | 2627 °C |
| Температура кипения | 2850 °C |
| Молярная теплоёмкость (ст. усл.) | 42.05 Дж/(моль·К) |
| Энтальпия (ст. усл.) | -635,09 кДж/моль |
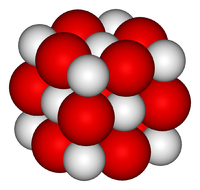
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ:
И при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Химические свойства
Оксид кальция относится к основным оксидам. Растворяется в воде с выделением энергии, образуя гидроксид кальция:
Как основной оксид реагирует с кислотными оксидами и кислотами, образуя соли:
Применение
Полезное
Смотреть что такое «Кальция оксид» в других словарях:
КАЛЬЦИЯ ОКСИД — СаО, бесцветные кристаллы. Технический продукт (известь негашеная) порошкообразный. Энергично реагирует с водой с выделением большого количества тепла (процесс гашения): СаО + Н2О = Са(ОН)2. Применяют в строительстве, в химической промышленности … Большой Энциклопедический словарь
кальция оксид — CaO, бесцветные кристаллы. Технический продукт (известь негашёная) порошкообразный. Энергично реагирует с водой с выделением большого количества тепла (процесс гашения): СаО+Н2О=Ca(ОН)2. Применяют в строительстве, в химической промышленности,… … Энциклопедический словарь
кальция оксид — kalcio oksidas statusas T sritis chemija formulė CaO atitikmenys: angl. burnt lime; calcium oxide; calx; caustic lime; lime; quicklime rus. жженая известь; кальция оксид; негашеная известь; обожженная известь ryšiai: sinonimas – degtos kalkės… … Chemijos terminų aiškinamasis žodynas
КАЛЬЦИЯ ОКСИД — СаО, бесцв. кристаллы с кубич. решеткой ( а =0,4812 нм, z = 4, пространств. группа Fm3m); т. пл. 2627 °С, т. кип. 2850 °С; плотн. 3,37 г/см 3; С° з 42,05 Дж/(моль. К); DH0 обр 635,09 кДж/моль, DH0 пл 52 кДж/моль; S0298 38,10 Дж/(моль … Химическая энциклопедия
КАЛЬЦИЯ ОКСИД — СаО, бесцв. кристаллы. Техн. продукт (известь негашёная) порошкообразный. Энергично реагирует с водой с выделением большого кол ва теплоты (процесс гашения): СаО+ Н2О = Са(ОН)2. Применяют в стр ве, в хим. пром сти, металлургии, с. х ве, при… … Естествознание. Энциклопедический словарь
Оксид кальция — Общие … Википедия
Оксид кальция(II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Оксид кальция (II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Кальция окись — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
КАЛЬЦИЯ ГИДРОКСИД — см. Кальция оксид, Известь … Химическая энциклопедия
Окись кальция
Окись кальция
| Оксид кальция | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид кальция |
| Химическая формула | CaO |
| Молярная масса | 56.077 г/моль |
| Физические свойства | |
| Плотность вещества | 3.37 г/см³ |
| Состояние (ст. усл.) | твердое |
| Термические свойства | |
| Температура плавления | 2627 °C |
| Температура кипения | 2850 °C |
| Молярная теплоёмкость (ст. усл.) | 42.05 Дж/(моль·К) |
| Энтальпия (ст. усл.) | -635,09 кДж/моль |
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ:
И при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Химические свойства
Оксид кальция относится к основным оксидам. Растворяется в воде с выделением энергии, образуя гидроксид кальция:
Как основной оксид реагирует с кислотными оксидами и кислотами, образуя соли:
Применение
Полезное
Смотреть что такое «Окись кальция» в других словарях:
окись кальция — Регулятор кислотности пищевого продукта, получаемый обжигом извести в печах при температурах от 900 °С до 1200 °С, содержащий основного вещества СаО не менее 95,0 % по остатку от сжигания, фторидов не более 50 мг/кг, бария не более 300… … Справочник технического переводчика
Кальция окись — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Кальция оксид — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Окись этилена — Окись этилена … Википедия
Окись азота — Оксид азота(II) Общие Систематическое наименование Оксид азота(II) Химическая формула … Википедия
Кальция окись — негашёная известь, кипелка, CaO, соединение кальция с кислородом; бесцветные кристаллы, плотность 3,4 г/см3, tпл 2585 °С. Технический продукт белое пористое вещество. К. о. жадно реагирует с водой с выделением большого количества тепла и… … Большая советская энциклопедия
Окись дифенилена — (oxyde de biphénylène, Di[Bi]phenylenoxyd) находится (около 0,3%) в смоле (Stupp, Stuppfett,), получающейся при перегонке без доступа воздуха ртутной руды в Идрии (Гольдшмидт и Шмидт); образуется при перегонке трехфенильного эфира ортофосфорной… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ОКСИД КАЛЬЦИЯ — окись кальция, негашеная известь, кипелка СаО бесцветные кристаллы; плотность 3400 кг/м3; tпл=2585° С; обладает основными свойствами. Технический продукт белое пористое вещество. Оксид кальция жадно реагирует с водой с образованием… … Металлургический словарь
ГОСТ 21639.3-93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния — Терминология ГОСТ 21639.3 93: Флюсы для электрошлакового переплава. Методы определения окиси кальция и окиси магния оригинал документа: 8.2 Аппаратура, реактивы и растворы Спектрофотометр атомно абсорбционный любого типа с источником излучения… … Словарь-справочник терминов нормативно-технической документации
Оксид кальция — Общие … Википедия
Оксид кальция (II)
Оксид кальция (II)
| Оксид кальция | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид кальция |
| Химическая формула | CaO |
| Молярная масса | 56.077 г/моль |
| Физические свойства | |
| Плотность вещества | 3.37 г/см³ |
| Состояние (ст. усл.) | твердое |
| Термические свойства | |
| Температура плавления | 2627 °C |
| Температура кипения | 2850 °C |
| Молярная теплоёмкость (ст. усл.) | 42.05 Дж/(моль·К) |
| Энтальпия (ст. усл.) | -635,09 кДж/моль |
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ:
И при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Химические свойства
Оксид кальция относится к основным оксидам. Растворяется в воде с выделением энергии, образуя гидроксид кальция:
Как основной оксид реагирует с кислотными оксидами и кислотами, образуя соли:
Применение
Полезное
Смотреть что такое «Оксид кальция (II)» в других словарях:
Оксид кальция — Общие … Википедия
Оксид кальция(II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
ОКСИД КАЛЬЦИЯ — (негашеная известь, СаО), твердое вещество белого цвета, получаемое путем нагрева карбоната кальция (СаСО3) до высоких температур. Его применяют для обработки кислотных почв, для изготовления фарфора и стекла, отбеливателей, каустической соды,… … Научно-технический энциклопедический словарь
оксид кальция — (CaO) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN calcium oxide … Справочник технического переводчика
ОКСИД КАЛЬЦИЯ — окись кальция, негашеная известь, кипелка СаО бесцветные кристаллы; плотность 3400 кг/м3; tпл=2585° С; обладает основными свойствами. Технический продукт белое пористое вещество. Оксид кальция жадно реагирует с водой с образованием… … Металлургический словарь
Химически активный оксид кальция — (СаО) – фракция оксида кальция, которая при нормальных условиях затвердевания цемента может формировать гидраты силиката кальция или гидраты алюмината кальция. Примечание: Для оценки этой фракции общее содержание оксида кальция (см. EN 196 … Энциклопедия терминов, определений и пояснений строительных материалов
Кальция оксид — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Кальция окись — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
Кальция гидроксид — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Кальция гидроокись — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия



