Пищевая сода
Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) — кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета.
Содержание
Безопасность
Двууглекилый натрий не токсичен, пожаро- и взрывобезопасен.
Представляет собой мелкокристаллический порошок, который при попадании на слизистые оболочки вызывает раздражение. При постоянной работе в атмосфере, загрязненной пылью двууглекислого натрия, может возникнуть раздражение дыхательных путей. [1]
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты.
Молекулярная масса (по международным атомным массам 1971 г.) — 84,00. [1]
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
в кулинарии чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
Термическое разложение
При температуре 60 °C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C):
При дальнейшем нагревании до 1000 °C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия:
Применение
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Кулинария
Основное применение питьевой соды — кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, в смести с карбонатом аммония), например, в бисквитном и песочном тесте.
Медицина
Раствор питьевой соды используется в качестве слабого антисептика для полосканий, а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета») или для устранения ацидоза и т. п.
Пожаротушение
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
Производство
В РФ производят соду по ГОСТ 2156-76 «Натрий двууглекислый. Технические условия».[2]
Хранение
Хранить в закрытых упаковках, не допуская попадания влаги.
Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления.
Срок годности не ограничен.
См. также
Примечания
Ссылки
Полезное
Смотреть что такое «Пищевая сода» в других словарях:
ПИЩЕВАЯ СОДА — ПИЩЕВАЯ СОДА, общеупотребительное название бикарбоната НАТРИЯ, входящего также в состав ПЕКАРСКОГО ПОРОШКА … Научно-технический энциклопедический словарь
пищевая сода — Разрыхлитель, активирующийся при взаимодействии с кислотосодержащим веществом – пахта, йогурт, лимонный сок. * * * (Источник: «Объединенный словарь кулинарных терминов») … Кулинарный словарь
пищевая сода — natrio hidrokarbonatas statusas T sritis chemija formulė NaHCO₃ atitikmenys: angl. backing soda; sodium bicarbonate; sodium hydrocarbonate; sodium hydrogen carbonate rus. натрий углекислый; натрия бикарбонат; натрия гидрокарбонат; пищевая сода… … Chemijos terminų aiškinamasis žodynas
сода — (натрон, бикарбонат натрия, гидрокарбонат натрия). Пищевая сода, применяемая самостоятельно и совместно с другими аналогичными химическими веществами в качестве искусственного подъемного средства в основном в кондитерском деле,… … Кулинарный словарь
СОДА — СОДА: кальцинированная сода (карбонат натрия) Na2CO3 (кристаллы, tпл 858шC) и питьевая, или пищевая, сода (гидрокарбонат натрия) NaHCO3. Кальцинированная сода встречается в природе в виде минералов, содержится в подземных рассолах, рапе соляных… … Современная энциклопедия
Сода — СОДА: кальцинированная сода (карбонат натрия) Na2CO3 (кристаллы, tпл 858°C) и питьевая, или пищевая, сода (гидрокарбонат натрия) NaHCO3. Кальцинированная сода встречается в природе в виде минералов, содержится в подземных рассолах, рапе соляных… … Иллюстрированный энциклопедический словарь
СОДА — (натрон, бикарбонат натрия, гидрокарбонат натрия). Пищевая сода, применяемая самостоятельно и совместно с другими аналогичными химическими веществами в качестве искусственного подъемного средства в основном в кондитерском деле,… … Большая энциклопедия кулинарного искусства
Сода — (Питьевая сода, двууглекислый натрий, бикарбонат натрия NaHCO3 и карбонат натрия Na2CO3). Современная пищевая сода типичный промышленный продукт. Однако она была известна человечеству задолго до нашей эры в естественном состоянии… … Большая энциклопедия кулинарного искусства
Сода — Сода: Кальцинированная сода карбонат натрия Na2CO3. Кристаллическая сода общее название кристаллогидратов кальцинированной соды: Натрит Na2CO3*10H2O. Термонатрит Na2CO3*H2O. Питьевая сода, пищевая сода, двууглекислая… … Википедия
СОДА — общее техническое название натриевых солей угольной кислоты (карбонатов натрия). Месторождения С. редки. В природе она иногда встречается в некоторых озёрах, в виде твёрдых отложений и в минеральных водах. В промышленности С. получают действием… … Большая политехническая энциклопедия
Натрий двууглекислый
Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) — кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета.
Содержание
Безопасность
Двууглекилый натрий не токсичен, пожаро- и взрывобезопасен.
Представляет собой мелкокристаллический порошок, который при попадании на слизистые оболочки вызывает раздражение. При постоянной работе в атмосфере, загрязненной пылью двууглекислого натрия, может возникнуть раздражение дыхательных путей. [1]
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты.
Молекулярная масса (по международным атомным массам 1971 г.) — 84,00. [1]
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
в кулинарии чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
Термическое разложение
При температуре 60 °C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C):
При дальнейшем нагревании до 1000 °C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия:
Применение
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Кулинария
Основное применение питьевой соды — кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, в смести с карбонатом аммония), например, в бисквитном и песочном тесте.
Медицина
Раствор питьевой соды используется в качестве слабого антисептика для полосканий, а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета») или для устранения ацидоза и т. п.
Пожаротушение
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
Производство
В РФ производят соду по ГОСТ 2156-76 «Натрий двууглекислый. Технические условия».[2]
Хранение
Хранить в закрытых упаковках, не допуская попадания влаги.
Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления.
Срок годности не ограничен.
См. также
Примечания
Ссылки
Полезное
Смотреть что такое «Натрий двууглекислый» в других словарях:
НАТРИЙ — НАТРИЙ. Natrium, химич. элемент, симв. Na, серебристобелый, блестящий, при обыкновенной t° восковой плотности одноатомный металл, делающийся хрупким на холоду и при ярко краснокалильном жаре перегоняющийся; открыт Де.ви (1807) электролизом… … Большая медицинская энциклопедия
двууглекислый натрий — бикарбонат натрия (NaHCO3) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность Синонимы бикарбонат натрия EN bicarb … Справочник технического переводчика
Натрий* — (хим.; нем. Natrium, франц. и англ. Sodium). Сведения о соединениях этого металла ведут свое начало от очень старых времен. Еврейское слово neter (греч. νίτρον, лат. nitrum) встречается в Библии как название вещества, которое, по Соломону,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Натрий — (хим.; нем. Natrium, франц. и англ. Sodium). Сведения о соединениях этого металла ведут свое начало от очень старых времен. Еврейское слово neter (греч. νίτρον, лат. nitrum) встречается в Библии как название вещества, которое, по Соломону,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Гидрокарбонат натрия — Гидрокарбонат натрия … Википедия
Бикарбонат натрия — Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета. Химическая формула Содержание… … Википедия
Натрия гидрокарбонат — Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета. Химическая формула Содержание… … Википедия
Питьевая сода — Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета. Химическая формула Содержание… … Википедия
Пищевая сода — Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета. Химическая формула Содержание… … Википедия
2156 — ГОСТ 2156 < 76>Натрий двууглекислый. Технические условия. ОКС: 71.060.50 КГС: Л14 Соли Взамен: ГОСТ 2156 68 Действие: С 01.01.77 Изменен: ИУС 1/79, 7/86, 11/89, 8/92 Примечание: переиздание 1992 Текст документа: ГОСТ 2156 «Натрий двууглекислый.… … Справочник ГОСТов
Гидрокарбонат натрия
| Гидрокарбонат натрия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая |
| Химическая формула | NaHCO3 |
| Эмпирическая формула | C H O 3 Na |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Отн. молек. масса | 84 а. е. м. |
| Молярная масса | 84 г/моль |
| Плотность | 2,159 г/см³ |
| Термические свойства | |
| Температура разложения | 60-200 °C |
| Химические свойства | |
| Растворимость в воде | 9,59 г/100 мл |
| Классификация | |
| Рег. номер CAS | 144-55-8 |
Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода (пищевая добавка E-500), пищевая сода, бикарбонат натрия, натрий двууглекислый) — кислая соль угольной кислоты и натрия. Обыкновенно представляет собой мелкокристаллический порошок белого цвета. Используется в пищевой промышленности, в кулинарии, в медицине как нейтрализатор ожогов кожи человека кислотами и снижения кислотности желудочного сока. Также — в буферных растворах, так как в широком диапазоне концентраций растворов его pH незначительно изменяется.
Содержание
Безопасность
Двууглекислый натрий не токсичен, пожаро- и взрывобезопасен.
Представляет собой мелкокристаллический порошок солоноватого (мыльного) вкуса, который при попадании на слизистые оболочки вызывает раздражение. При постоянной работе в атмосфере, загрязненной пылью двууглекислого натрия, может возникнуть раздражение дыхательных путей. [1]
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты.
Молекулярная масса (по международным атомным массам 1971 г.) — 84,00. [1]
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:

В быту чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
Термическое разложение
При температуре 60 °C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C):
При дальнейшем нагревании до 1000 °C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия:
Применение
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Кулинария
Основное применение пищевой соды — кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, вместе с карбонатом аммония) и в готовых смесях для выпечки (кексы, торты и пр.). При применении в чистом виде важно соблюсти правильную дозировку, так как оставляет в продукте не безвкусный карбонат натрия.
Медицина
Пожаротушение
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
Производство
В Российской Федерации производят соду по ГОСТ 2156-76 «Натрий двууглекислый. Технические условия» на предприятии «Сода» (г. Стерлитамак, Республика Башкортостан).
Хранение
Хранить в закрытых упаковках, не допуская попадания влаги.
Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления.
Срок годности не ограничен.
См. также
Примечания
Полезное
Смотреть что такое «Гидрокарбонат натрия» в других словарях:
ГИДРОКАРБОНАТ НАТРИЯ — (сода, NаНСО3). Белая кристаллическая соль, которая разлагается в кислоте или при нагреве, с выделением углекислого газа, в связи с чем ее используют в составе пекарского порошка для придания пористости выпечным изделиям. Обладает слегка щелочной … Научно-технический энциклопедический словарь
Гидрокарбонат натрия — бикарбонат натрия, питьевая сода, NaHCO3, применяется в порошках, таблетках и растворах при повышенной кислотности желудочного сока, язвенной болезни желудка и двенадцатиперстной кишки, а также при заболеваниях, сопровождающихся ацидозом… … Большая советская энциклопедия
Натрия гидрокарбонат — Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета. Химическая формула Содержание… … Википедия
Натрия карбонат — Карбонат натрия Общие Систематическое наименование карбонат натрия Традиционные названия кальцинированная сода Химическая формула Na2C … Википедия
Натрия фосфаты — Известны следующие фосфаты натрия: Дигидрофосфат натрия NaH2PO4 Гидрофосфат натрия Na2HPO4 Ортофосфат натрия Na3PO4 Применение Употребляются для буферных растворов различного назначения, как эмульгаторы в пищевой промышленности … Википедия
НАТРИЯ ГИДРОКАРБОНАТ — ( Natrii hydrocarbonas ). Синонимы: Натрий двууглекислый, Натрия бикарбонат, Сода двууглекислая, Natrium bicarbonicum, Natrium hydrocarbonicum, Sodium bicarbonate. Белый кристаллический порошок без запаха, солено щелочного вкуса. Растворим в воде … Словарь медицинских препаратов
НАТРИЯ ГИДРОКАРБОНАТ — Natrii hydrocarbonas. Синонимы: натрия бикарбонат, сода двууглекислая. Свойства. Белый кристаллический порошок без запаха, солено щелочного вкуса. Растворим в воде (1:12) с образованием щелочных растворов (рН 5 % раствора 8,1), нерастворим в спи … Отечественные ветеринарные препараты
Натрия гидрокарбоната таблетки 0,5 г — Действующее вещество ›› Натрия гидрокарбонат (Sodium hydrocarbonate) Латинское название Tabulettae Natrii hydrocarbonatis 0,5 g АТХ: ›› B05CB04 Натрия гидрокарбонат Фармакологические группы: Регуляторы водно электролитного баланса и КЩС ››… … Словарь медицинских препаратов
НАТРИЯ ГИДРОКАРБОНАТ — то же, что питьевая или пищевая сода … Большой Энциклопедический словарь
Натрия бикарбонат — натрия гидрокарбонат, двууглекислый натрий, NaHCO3, пищевая (или питьевая) Сода … Большая советская энциклопедия
Гидрокарбонат натрия
| Гидрокарбонат натрия | |
|---|---|
 | |
 | |
| Систематическое наименование | гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая, двууглекислый натрий, бикарбонат натрия, кислый углекислый натрий |
| Хим. формула | CHNaO₃ |
| Рац. формула | NaHCO3 |
| Состояние | твёрдое |
| Молярная масса | 84,0066 г/моль |
| Плотность | 2,159 г/см³ |
| Т. разл. | 60—200 °C |
| Растворимость в воде | 9,59 г/100 мл |
| ГОСТ | ГОСТ 2156-76 ГОСТ 4201-79 ГОСТ 32802-2014 |
| Рег. номер CAS | 144-55-8 |
| PubChem | 516892 |
| Рег. номер EINECS | 205-633-8 |
| SMILES | |
| Рег. номер EC | 205-633-8 |
| Кодекс Алиментариус | E500(ii) |
| RTECS | VZ0950000 |
| ChEBI | 32139 |
| ChemSpider | 8609 |
| ЛД50 | 4220 мг/кг |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
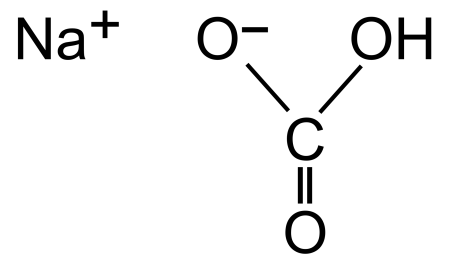
Гидрокарбонат натрия (лат. Natrii hydrocarbonas ), другие названия: бикарбонат натрия, чайная сада, питьевая или пищевая сода, двууглекислый натрий — неорганическое соединение, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
Содержание
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков:
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой:
Термическое разложение
При температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C, при более высоких температурах карбонат натрия начинает распадаться на оксид натрия и углекислый газ):
При этом процессе выделения воды в виде водяного пара и углекислого газa масса исходного продукта уменьшается примерно на 37 %.
Получение
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
Применение
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500.
В химической промышленности
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В пищевой промышленности — в хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков.
В кулинарии
Основное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя в составе кислого и пресного теста. При добавлении питьевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто.
При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения.
При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
В медицине
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях и полости рта и горла, при сильном кашле, ангине, фарингите, а также как общепринятое средство от изжоги и болей в желудке.
Применяется при заболеваниях, сопровождающиеся выраженным ацидозом (при диабете, инфекциях и др), для борьбы с ацидозом при хирургических вмешательствах (назначается 3-5 г. внутрь).
Применяется в качестве антиаритмического средства.
Как антацидное средство (как и все другие щелочи) применяется при язвенной болезни желудка, и двенадцатиперстной кишки, при повышенной кислотности желудочного сока.
Имеются так же данные о применении препарата (в виде капельных и внутривенных вливаний) при гипертонической болезни, симптоматической почечной гипертонии, и хронической почечной недостаточности. Эффект связан с увеличением выделения ионов натрия и хлора и возрастанием осмотического диуреза.
В виде свечей применяется против укачивания при морской и воздушной болезнях
Применяется в качестве отхаркивающего средства, т.к. повышая щелочные резервы крови, сдвигает в щелочную сторону реакцию бронхиальной слизи, делая мокроту менее вязкой.
Применяется внутривенно с целью быстрого устранения метаболического ацидоза во время реанимационных мероприятий, заболеваниях почек.
Нужно иметь ввиду, что в результате применения может возникнуть т.н. кислотный рикошет (при реакции содой с соляной кислотой происходит выделение CO2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина).
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует.
Противопоказания к применению в медицинских целях
Является источником натрия, тем самым увеличивая объём циркулирующей крови, усугубляя отёки и повышая артериальное давление. Применение при сниженной скорости клубочковой фильтрации может привести к метаболическому алкалозу.
Пожаротушение
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения.
В быту
Применяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды.
Производство
В Российской Федерации двууглекислый натрий выпускается в соответствии с требованиями и техническими условиями, выпускается на предприятиях АО «Башкирская содовая компания» в г. Стерлитамак, Республика Башкортостан, а также на Крымском содовом заводе в г. Красноперекопск, Крымский полуостров.
Хранение
Гидрокарбонат натрия хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен.
Безопасность
Вещество нетоксично, пожаро- и взрывобезопасно.











