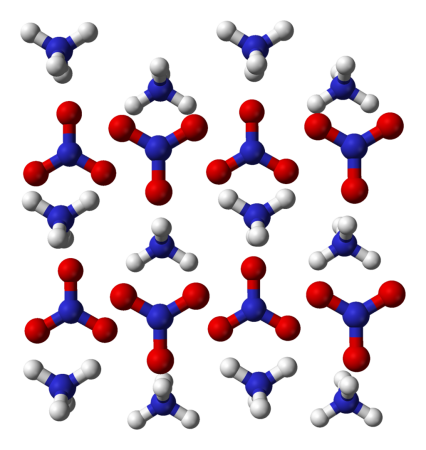
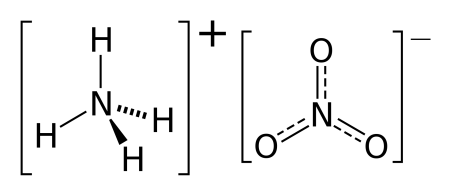Нитрат аммония
| Нитрат аммония | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Нитрат аммония |
| Химическая формула | NH4NO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдый |
| Отн. молек. масса | 80,04 а. е. м. |
| Молярная масса | 80,04 г/моль |
| Плотность | 1,725 (IV модификация) г/см³ |
| Термические свойства | |
| Температура плавления | 169,6 °C |
| Температура кипения | 235 °C |
| Температура разложения | |
| Химические свойства | |
| Растворимость в воде | 20 °C — 190 г/100 мл |
| Классификация | |
| Рег. номер CAS | 6484-52-2 |
Нитра́т аммо́ния (аммонийная (аммиачная) селитра) — химическое соединение NH4NO3, соль азотной кислоты. Впервые получена Глаубером в 1659 году.
Содержание
Физические свойства
Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при повышенном давлении — 235 °C. Молекулярная масса 80,04 а. е. м.. Скорость детонации 2570 м/с.
Растворимость
| Температура, °C | Растворимость, г/100мл |
|---|---|
| 0 | 119 |
| 25 | 212 |
| 50 | 346 |
| 100 | 1024 |
При растворении происходит сильное поглощение тепла (аналогично нитрату калия), что значительно замедляет растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Состав
Содержание элементов в нитрате аммония в массовых процентах:
Методы получения
Основной метод
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
Реакция протекает бурно с выделением большого количества тепла. Проведение такого процесса в кустарных условиях крайне опасно (хотя в условиях большого разбавления водой нитрат аммония может быть легко получен). После образования раствора, обычно с концентрацией 83 %, лишняя вода выпаривается до состояния расплава, в котором содержание нитрата аммония составляет 95—99,5 % в зависимости от сорта готового продукта. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Нитрат аммония для применения в химии обычно обезвоживается, так как он очень гигроскопичен и процентное количество воды в нём (
Метод Габера
По способу Габера из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония:
Нитрофосфатный метод
Этот способ также известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы:
А также амфотерный метод.
Химические свойства
Реакции разложения
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
Кристаллические состояния нитрата аммония
Изменения кристаллического состояния нитрата аммония под воздействием температуры и давления меняют его физические свойства. Обычно различают следующие состояния:
| Система | Диапазон температур (°C) | Состояние | Изменение объёма (%) |
|---|---|---|---|
| — | > 169.6 | жидкость | |
| I | 169.6 — 125.2 | кубическая | +2.1 |
| II | 125.5 — 84.2 | тетрагональная | −1.3 |
| III | 84.2 — 32.3 | α-ромбическая | +3.6 |
| IV | 32.3 — −16.8 | β-ромбическая | −2.9 |
| V | Применение Взрывчатые веществаНаиболее широко в промышленности и горном деле применяются смеси аммиачной селитры с различными видами углеводородных горючих материалов, других взрывчатых веществ, а также многокомпонентные смеси: УдобренияБо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение, либо как полупродукт для получения прочих удобрений. Аварии и взрывыДополнительная информацияМировое производство аммиачной селитры на 1980 год составляло 14 млн т, в пересчёте на азот. Нитрат аммония | ||
| Систематическое наименование | Нитрат аммония | ||
| Хим. формула | NH4NO3 | ||
| Состояние | твёрдый | ||
| Молярная масса | 80,04 г/моль | ||
| Плотность | 1,725 (IV модификация) | ||
| Т. плав. | 169,6 °C | ||
| Т. кип. | 235 °C | ||
| Т. разл. | 210 °C | ||
| Растворимость в воде | 20 °C — 190 г/100 мл | ||
| ГОСТ | ГОСТ 14702-79 | ||
| Рег. номер CAS | 6484-52-2 | ||
| PubChem | 22985 | ||
| Рег. номер EINECS | 229-347-8 | ||
| SMILES | |||
| RTECS | BR9050000 | ||
| ChEBI | 63038 | ||
| ChemSpider | 21511 | ||
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |||
Нитрат аммония (аммонийная (аммиачная) селитра) — химическое соединение NH4NO3, соль азотной кислоты. Впервые получена Глаубером в 1659 году. Используется в качестве компонента взрывчатых веществ и как азотное удобрение.
Содержание
Физические свойства
Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при пониженном давлении — 235 °C. Молекулярная масса 80,04 а. е.м. Скорость детонации 2570 м/с.
Растворимость
Растворимость в воде:
| Температура, °C | Растворимость, г/100мл |
|---|---|
| 0 | 119 |
| 10 | 150 |
| 25 | 212 |
| 50 | 346 |
| 80 | 599 |
| 100 | 1024 |
При растворении происходит сильное поглощение тепла (аналогично нитрату калия), что значительно замедляет растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Также соль растворима в аммиаке, пиридине, метаноле, этаноле.
Состав
Содержание элементов в нитрате аммония в массовых процентах:
Методы получения
Основной метод
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
Реакция протекает бурно с выделением большого количества тепла. Проведение такого процесса в кустарных условиях крайне опасно (хотя в условиях большого разбавления водой нитрат аммония может быть легко получен). После образования раствора, обычно с концентрацией 83 %, лишняя вода выпаривается до состояния расплава, в котором содержание нитрата аммония составляет 95—99,5 % в зависимости от сорта готового продукта. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Нитрат аммония для применения в химии обычно обезвоживается, так как он очень гигроскопичен и процентное количество воды в нём получить практически невозможно.
Метод Габера
По способу Габера из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония:
Нитрофосфатный метод
Этот способ также известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы:
А также амфотерный метод.
Химические свойства
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
Кристаллические состояния нитрата аммония
Изменения кристаллического состояния нитрата аммония под воздействием температуры и давления меняют его физические свойства. Обычно различают следующие состояния:
| Система | Диапазон температур (°C) | Состояние | Изменение объёма (%) | |
|---|---|---|---|---|
| — | > 169.6 | жидкость | ||
| I | 169.6 — 125.2 | кубическая | −2.13 | |
| II | 125.5 — 84.2 | тетрагональная | −1.33 | |
| III | 84.2 — 32.3 | α-ромбическая | +0.8 | |
| IV | 32.3 — −16.8 | β-ромбическая | −3.3 | |
| V | −50 — −16.8 | тетрагональная | +1.65 | |
| VI | существует при высоких давлениях | |||
| VII | 170 | |||
| VIII | существует при высоких давлениях | |||
| IX | существует при высоких давлениях |
Фазовый переход от IV к III при 32,3 °C приносит неприятности производителям удобрений, потому как изменения плотности приводят к разрушению частиц при хранении и применении. Это особенно важно в тропических странах, где нитрат аммония испытывает циклические изменения, приводящие к разрушению гранул, слёживанию, повышенному пылению и риску возникновения взрыва.
Применение
Удобрения
Бо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение, либо как полупродукт для получения прочих удобрений. Для предотвращения создания взрывчатых веществ на основе нитрата аммония в удобрения, доступные в широкой продаже, добавляют компоненты, снижающие взрывоопасность и детонационные свойства чистого нитрата аммония, такие как мел (карбонат кальция).
В Австралии, Китае, Афганистане, Ирландии и некоторых других странах свободная продажа нитрата аммония даже в виде удобрений запрещена или ограничена. После террористического акта в Оклахома-Сити ограничения на продажу и хранение нитрата аммония были введены в некоторых штатах США.
Взрывчатые вещества
Наиболее широко в промышленности и горном деле применяются смеси аммиачной селитры с различными видами углеводородных горючих материалов, других взрывчатых веществ, а также многокомпонентные смеси:
Безопасный состав
Дополнительная информация
Мировое производство аммиачной селитры на 1980 год составляло 14 млн т, в пересчёте на азот.
Нитрат аммония
Характеристики и физические свойства нитрата аммония
Он хорошо растворяется в воде (гидролизуется по катиону). Кристаллогидратов не образует.
Рис. 1. Нитрат аммония. Внешний вид.
Таблица 1. Физические свойства нитрата аммония.
Плотность (20 o С), г/см 3
Температура плавления, o С
Температура кипения, o С
Температура разложения, o С
Растворимость в воде (20 o С), г/100 мл
Получение нитрата аммония
Нитрат аммония имеет большое промышленное значения. Для его получения наиболее часто используют следующие методы:
— реакция взаимодействия безводного аммиака с азотной кислотой
Химические свойства нитрата аммония
Нитрат аммония — это средняя соль, образованная слабым основанием – гидроксидом аммония (NH4OH) и сильной кислотой – азотной (HNO3).Гидролизуется по катиону. Характер среды водного раствора нитрата аммиака кислый. Уравнение гидролиза будет выглядеть следующим образом:
Нитрат аммония разлагается концентрированными щелочами:
В ОВР может проявлять свойства как слабого окислителя, так и слабого восстановителя:
Нитрат аммония разлагается при нагревании:
Применение нитрата аммония
Примеры решения задач
| Задание | Какой объем оксида азота (I) выделится в ходе реакции разложения нитрата аммония, если в неё вступило 15 г соли? |
| Решение | Оксида азота (I) выделяется при разложении нитрата аммония только в случае нагревания соли до температуры, не превышающей 200 o С. Запишем уравнение реакции: |
Рассчитаем количество нитрата аммония, вступившего в реакцию (молярная масса равна 80 г/моль):
Согласно уравнению, n(NH4NO3) : n(N2O) = 1:1, значит,
Тогда, объем выделяющегося оксида азота (I) будет равен:
V (N2O) = 0,2 × 22,4 = 4,48 л.
| Задание | Какой объем азота выделится в ходе реакции разложения нитрата аммония, если в неё вступило 25 г соли? |
| Решение | Азот выделяется при разложении нитрата аммония только в случае нагревания соли до температуры выше 200 o С. Запишем уравнение реакции: |
Рассчитаем количество нитрата аммония, вступившего в реакцию (молярная масса равна 80 г/моль):
Тогда, объем выделяющегося оксида азота (I) будет равен:
118 г / 100 мл (0 ° C)
150 г / 100 мл (20 ° C)
297 г / 100 мл (40 ° C)
410 г / 100 мл (60 ° C)
576 г / 100 мл (80 ° C) )
1024 г / 100 мл (100 ° C)



Многие страны постепенно отказываются от его использования в потребительских приложениях из-за опасений по поводу его возможности неправильного использования. Случайные взрывы нитрата аммония убили тысячи людей с начала 20 века.
СОДЕРЖАНИЕ
Вхождение
Производство, реакции и кристаллические фазы
Промышленное производство нитрата аммония влечет за собой кислотно-щелочную реакцию с аммиаком с азотной кислотой :
Нитрат аммония также может быть получен посредством реакций метатезиса :
Реакции
Твердый нитрат аммония разлагается при нагревании. При температуре ниже 300 ° C при разложении в основном образуется закись азота и вода:
При более высоких температурах преобладает следующая реакция.
Кристаллические фазы
Наблюдается ряд кристаллических фаз нитрата аммония. Следующее происходит при атмосферном давлении.
Переход от β-ромбической формы к α-ромбической (при 32,3 ° C) происходит при температуре окружающей среды во многих частях мира. Эти формы имеют разницу в плотности 3,6%, и, следовательно, переход между ними вызывает изменение объема. Одним из практических последствий этого является то, что в нитрате аммония, образующемся в качестве топлива твердого ракетного двигателя, образуются трещины, ведущие к образованию фазостабилизированного нитрата аммония (PSAN), который включает галогениды металлов в качестве стабилизаторов.
Приложения
Удобрения
Взрывчатые вещества
Нитрат аммония сам по себе не является взрывчатым веществом, но он легко образует взрывчатые смеси с различными свойствами в сочетании со взрывчатыми веществами, такими как тротил, или с топливом, таким как алюминиевый порошок или мазут. Примеры взрывчатых веществ, содержащих нитрат аммония, включают:
Смесь с мазутом
Терроризм
Ниша использует
Безопасность, обращение и хранение
Существуют многочисленные правила техники безопасности при хранении и обращении с нитратом аммония. Данные о здоровье и безопасности показаны в паспортах безопасности, которые можно получить у поставщиков и от различных правительств.
Чистая нитрат аммония не горит, но как сильный окислитель поддерживает и ускоряет горение органических (и некоторых неорганических) материалов. Не хранить рядом с горючими веществами.
Хотя нитрат аммония стабилен при температуре и давлении окружающей среды во многих условиях, он может взорваться от сильного инициирующего заряда. Его нельзя хранить рядом с взрывчатыми веществами или взрывчатыми веществами.
Расплавленный нитрат аммония очень чувствителен к ударам и детонации, особенно если он загрязняется несовместимыми материалами, такими как горючие, легковоспламеняющиеся жидкости, кислоты, хлораты, хлориды, сера, металлы, древесный уголь и опилки.
Нитрат аммония имеет критическую относительную влажность 59,4%, выше которой он будет поглощать влагу из атмосферы. Поэтому важно хранить нитрат аммония в плотно закрытой таре. В противном случае он может слиться в большую твердую массу. Нитрат аммония может поглотить достаточно влаги для разжижения. Смешивание нитрата аммония с некоторыми другими удобрениями может снизить критическую относительную влажность.
Возможность использования материала в качестве взрывчатого вещества потребовала принятия регулирующих мер. Например, в Австралии в августе 2005 года вступили в силу Положения об опасных грузах, предусматривающие лицензирование обращения с такими веществами. Лицензии выдаются только заявителям (отрасли) с соответствующими мерами безопасности для предотвращения любого неправомерного использования. Также могут быть рассмотрены дополнительные виды использования, такие как образовательные и исследовательские цели, но не индивидуальное использование. Сотрудники тех, у кого есть лицензии на работу с веществом, по-прежнему должны находиться под надзором уполномоченного персонала и должны пройти проверку безопасности и национальной полиции перед выдачей лицензии.
Опасности для здоровья
Катастрофы
Нитрат аммония может взорваться по двум причинам:
Нитрат аммония
118 г / 100 мл (0 ° C)
150 г / 100 мл (20 ° C)
297 г / 100 мл (40 ° C)
410 г / 100 мл (60 ° C)
576 г / 100 мл (80 ° C) )
1024 г / 100 мл (100 ° C) [1]
Многие страны постепенно отказываются от его использования в потребительских приложениях из-за опасений по поводу его возможности неправильного использования. [6] С начала 20 века в результате случайных взрывов нитрата аммония погибли тысячи людей.
Содержание
Возникновение [ править ]
Производство, реакции и кристаллические фазы [ править ]
Промышленное производство нитрата аммония влечет за собой кислотно-щелочную реакцию с аммиаком с азотной кислотой : [10]
Ca (NO 3 ) 2 + 2 NH 3 + CO 2 + H 2 O → 2 NH 4 NO 3 + CaCO 3
Нитрат аммония также может быть получен посредством реакций метатезиса :
(NH 4 ) 2 SO 4 + Ba (NO 3 ) 2 → 2 NH 4 NO 3 + BaSO 4 NH 4 Cl + AgNO 3 → NH 4 NO 3 + AgCl
Реакции [ править ]
Твердый нитрат аммония разлагается при нагревании. При температуре ниже 300 ° C в результате разложения в основном образуются закись азота и вода:
При более высоких температурах преобладает следующая реакция. [11]
Кристаллические фазы [ править ]
Наблюдается ряд кристаллических фаз нитрата аммония. Следующее происходит при атмосферном давлении.
Обе формы от β-ромбической до α-ромбической потенциально присутствуют при температуре окружающей среды во многих частях мира, но имеют разницу в плотности на 3,6%. В результате этот фазовый переход и сопутствующее изменение объема с практическим следствием того, что нитрат аммония, образующийся в качестве топлива твердого ракетного двигателя, образует трещины. По этой причине был исследован стабилизированный фазой нитрат аммония (PSAN), который включает галогениды металлов в качестве стабилизаторов. [14]
Приложения [ править ]
Удобрение [ править ]
Взрывчатые вещества [ править ]
Нитрат аммония входит в состав некоторых взрывчатых веществ. Примеры взрывчатых веществ, содержащих нитрат аммония, включают:
Смесь с мазутом [ править ]
Терроризм [ править ]
Ниша использует [ править ]
Безопасность, обращение и хранение [ править ]
Существуют многочисленные инструкции по безопасности при хранении и обращении с нитратом аммония. Данные о здоровье и безопасности показаны в паспортах безопасности, которые можно получить у поставщиков и от различных правительств. [21] [22] [23]
Чистая нитрат аммония не горит, но как сильный окислитель поддерживает и ускоряет горение органических (и некоторых неорганических) материалов. [21] [24] [25] Не хранить рядом с горючими веществами.
Хотя нитрат аммония стабилен при температуре и давлении окружающей среды во многих условиях, он может взорваться от сильного инициирующего заряда. Его нельзя хранить рядом с взрывчатыми веществами или взрывчатыми веществами.
Расплавленный нитрат аммония очень чувствителен к ударам и детонации, особенно если он загрязняется несовместимыми материалами, такими как горючие, легковоспламеняющиеся жидкости, кислоты, хлораты, хлориды, сера, металлы, древесный уголь и опилки. [26] [21]
Нитрат аммония имеет критическую относительную влажность 59,4%, выше которой он будет поглощать влагу из атмосферы. Поэтому важно хранить нитрат аммония в плотно закрытой таре. В противном случае он может слиться в большую твердую массу. Нитрат аммония может поглощать достаточно влаги для разжижения. Смешивание нитрата аммония с некоторыми другими удобрениями может снизить критическую относительную влажность. [29]
Возможность использования материала в качестве взрывчатого вещества побудила принять меры регулирования. Например, в Австралии в августе 2005 года вступили в силу Положения об опасных грузах, призванные обеспечить лицензирование обращения с такими веществами. [30] Лицензии предоставляются только заявителям (отрасли) с соответствующими мерами безопасности для предотвращения любого неправомерного использования. [31] Также могут быть рассмотрены дополнительные виды использования, например, в образовательных и исследовательских целях, но не для индивидуального использования. Сотрудники тех, у кого есть лицензии на работу с этим веществом, по-прежнему должны находиться под надзором уполномоченного персонала и должны пройти проверку безопасности и национальной полиции перед выдачей лицензии.
Опасности для здоровья [ править ]
Катастрофы [ править ]
Нитрат аммония может взорваться по двум причинам:
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется структурная формула нитрата аммония, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову "Как пишется структурная формула нитрата аммония", предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.