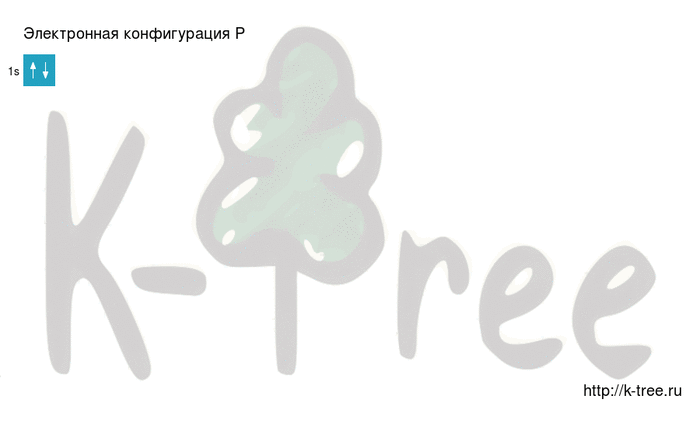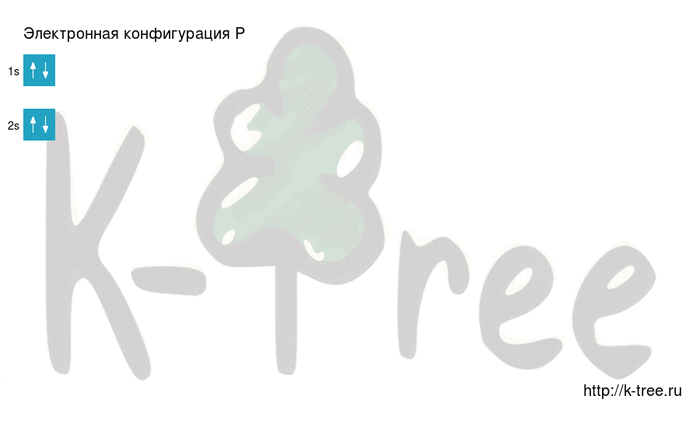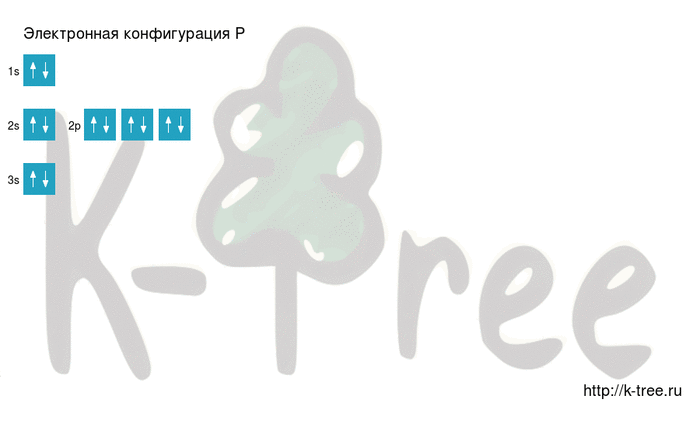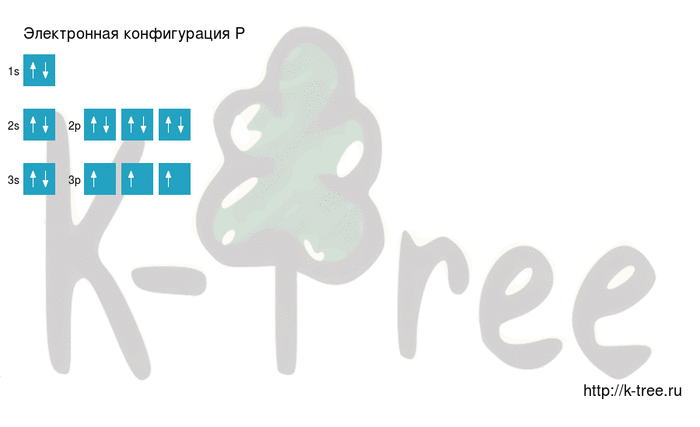Фосфор
Фосфор/ Phosphorus (P), 15
2,19 [1] (шкала Полинга)
(белый фосфор)1,82 г/см³
21,6 [3] (ромбич.) Дж/(K·моль)
Содержание
История
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать философский камень, а получил светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая золотистым цветом, может содержать золото или нечто нужное для добычи. Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не исчезнет неприятный запах, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте. Бранд назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времён античности.
Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году.
Усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
Происхождение названия
В 1669 году Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём». Вторичное название «фосфор» происходит от греческих слов «φῶς» — свет и «φέρω» — несу. В древнегреческой мифологии имя Фосфор (или Эосфор, др.-греч. Φωσφόρος ) носил страж Утренней звезды.
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
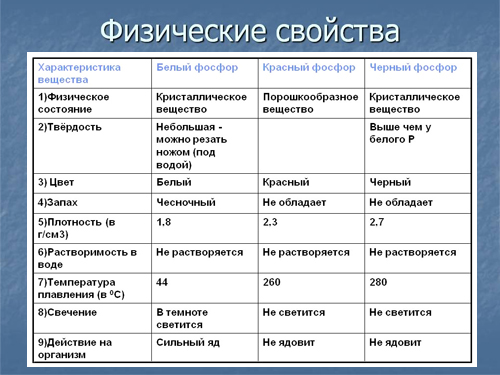
Физические свойства
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества — белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений — также металлическая форма. Все модификации различаются по цвету, плотности и другим физическим характеристикам; заметна тенденция к резкому убыванию химической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств.
Белый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
Белый фосфор имеет молекулярное строение; формула P4. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствие воздуха под слоем очищенной воды или в специальных инертных средах.
Легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией).
Белый фосфор не только активен химически, но и весьма ядовит (вызывает поражение костей, костного мозга, некроз челюстей). Летальная доза белого фосфора для взрослого мужчины составляет 0,05—0,1 г.
Жёлтый фосфор
для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твердое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).
Красный фосфор
Красный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Чёрный фосфор
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2·10 9 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 18·10 5 Па.
Металлический фосфор
При 8,3·10 10 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25·10 11 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:


Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
фосфиды разлагаются водой и кислотами с образованием фосфина

Не взаимодействует с водородом.
Взаимодействие с водой
Взаимодействует с водой, при этом протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
Взаимодействие со щелочами
В растворах щелочей также протекает реакция диспропорционирования:
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:

Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок
Биологическая роль соединений фосфора
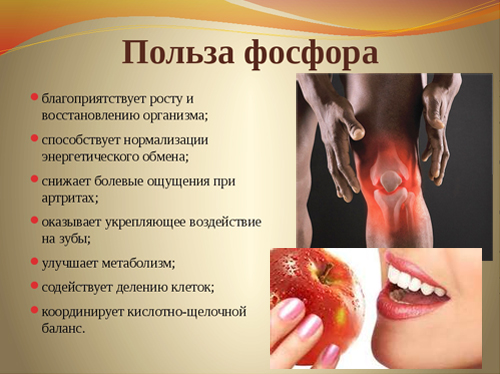
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800—1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
Токсикология элементарного фосфора
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2—3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе производственных помещений — 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе — 0,0005 мг/м³, ПДК в питьевой воде — 0,0001 мг/дм³. [6]
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Боевые отравляющие вещества зарин, зоман, табун, V-газы являются соединениями фосфора.
Фосфор (P, Phosphorus)
История фосфора
Фосфор открыл в 1669 году алхимик из Гамбурга Хенниг Бранд, который проводил опыты с выпариванием человеческой мочи, пытаясь получить философский камень. Вещество, образовавшееся после многочисленных манипуляций, оказалось похожим на воск, необыкновенно ярко, с мерцанием, горело. Новому веществу было дано название phosphorus mirabilis (от латинского чудотворный носитель огня). Несколькими годами позже фосфор получил Иоганн Кункель, а также, независимо от двух первых учёных, Р. Бойлем.
Общая характеристика фосфора
Фосфор является элементом XV группы III периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 15 и атомной массой 30,974. Принятое обозначение – Р.
Нахождение в природе
Фосфор содержится в морской воде и земной коре в основном в виде минералов, которых около 190 (самые важные – апатит и фосфорит). Входит в состав всех частей зелёных растений, белков, ДНК.
Физические и химические свойства
фосфор является неметаллом с высокой химической активностью, в свободном виде практически не встречается. Известны четыре модификации фосфора – красный, белый, чёрный и металлический.
Суточная потребность в фосфоре
Для нормального функционирования организм взрослого человека должен получать 1,0-2,0 г фосфора в сутки. Для детей и подростков норма составляет 1,5-2,5 г, для беременных и кормящих женщин возрастает до 3,0-3,8 г (calorizator). Суточная потребность в фосфоре увеличивается во время регулярных спортивных тренировок и при физических нагрузках.
Продукты питания богатые фосфором
Признаки нехватки фосфора
Недостаточное количество фосфора в организме характеризуется усталостью и слабостью, может сопровождаться потерей аппетита и внимания, частыми простудными заболеваниями, тревогой и чувством страха.
Признаки избытка фосфора
Признаками избытка фосфора в организме служат кровотечения и кровоизлияния, развивается анемия, возникает почечнокаменная болезнь.
Полезные свойства фосфора и его влияние на организм
Фосфор обеспечивает нормальные рост костной и зубной тканей организма, поддерживает их в здоровом состоянии, также участвует в синтезе белка, играет важную роль в обмене жиров, белков и углеводов. Без фосфора не могут функционировать мышцы, и не происходит умственная деятельность.
Усвояемость фосфора
При приёме минеральных комплексов стоит помнить о наилучшем балансе фосфора и кальция (3:2), а также о том, что чрезмерное количество магния и железа замедляет процесс усвоения фосфора.
Применение фосфора в жизни
Фосфор широко применяется в промышленности и сельском хозяйстве, прежде всего из-за его горючести. Его используют в производстве топлива, спичек, взрывчатых веществ, фосфорных удобрений и защиты поверхностей металлов от коррозии.
Фосфор P
Фосфор в таблице менделеева занимает 15 место, в 3 периоде.
| Символ | P |
| Номер | 15 |
| Атомный вес | 30.9737620 |
| Латинское название | Phosphorus |
| Русское название | Фосфор |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема фосфора
Порядок заполнения оболочек атома фосфора (P) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Фосфор имеет 15 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
3 электрона на 3p-подуровне
Степень окисления фосфора
Ионы фосфора
Валентность P
Атомы фосфора в соединениях проявляют валентность V, IV, III, II, I.
Валентность фосфора характеризует способность атома P к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа P
Квантовые числа определяются последним электроном в конфигурации, для атома P эти числа имеют значение N = 3, L = 1, Ml = 1, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Фосфор. Химия фосфора и его соединений
Фосфор
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии :
Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Соединения фосфора
Типичные соединения фосфора:
| Степень окисления | Типичные соединения |
| +5 | оксид фосфора (V) P2O5 ортофосфорная кислота H3PO4 метафосфорная кислота HPO3 Галогенангидриды: PОCl3, PCl5 |
| +3 | Оксид фосфора (III) P2O3 Галогенангидриды: PCl3 |
| +1 | Фосфорноватистая кислота H3PO2 Соли фосфорноватистой кислоты — гипофосфиты: MeH2PO2 |
| -3 | Фосфин PH3 Фосфиды металлов MeP |
Способы получения фосфора
4HPO3 + 10C → P4 + 2H2O + 10 CO
3. Красный и черный фосфор получают из белого фосфора.
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1.1. При взаимодействии с кислородом воздуха образу
ются оксиды – ангидриды соответствующих кислот :
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Еще пример : натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Серная кислота также окисляет фосфор:
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Или с гидроксидом кальция:
Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Химические свойства фосфина
Соли фосфония неустойчивые, легко гидролизуются.
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
2PH3 + 2PCl3 → 4P + 6HCl
Фосфиды
Способы получения фосфидов
Фосфор взаимодействует с натрием:
P + 3Na → Na3P
Химические свойства фосфидов
1. Фосфиды легко разлагаются водой или кислотами с образованием фосфина.
Фосфид магния разлагается соляной кислотой:
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (III)
Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода :
Химические свойства оксида фосфора (III):
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
2. При взаимодействии с окислителями P2O3 проявляет свойства восстановителя.
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
а со щелочами – с образованием солей (фосфитов):
Оксид фосфора (V)
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
Химические свойства.
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
Еще пример : оксид фосфора взаимодействует с оксидом бария (при сплавлении):
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет орто-фосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Химические свойства
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфористая кислота
Фосфористая кислота H3PO3 — это двухосновная кислородсодержащая кислота. При нормальных условиях бесцветное кристаллическое вещество, хорошо растворимое в воде.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Получение фосфористой кислоты.
Фосфористую кислоту можно получить гидролизом галогенидов фосфора (III).
Фосфористую кислоту можно получить также взаимодействием оксида фосфора (III) с водой:
Химические свойства.
1. Фосфористая кислота H3PO3 в водном растворе — двухосновная кислота средней силы. Взаимодействует с основаниями с образованием солей-фосфитов.
Еще пример : фосфористая кислота окисляется соединениями ртути (II):
Соли фосфорной кислоты — фосфаты
Фосфорная кислота образует разные типы солей: средние – фосфаты, кислые – гидрофосфаты, дигидрофосфаты.
1. Качественная реакция на фосфаты — взаимодействие с нитратом серебра. При этом образуется желтый осадок фосфата серебра.
2. Нерастворимые фосфаты растворяются под действием сильных кислот, либо под действием фосфорной кислоты.
Фосфат кальция растворяется под действием серной кислоты:
3. За счет фосфора со степенью окисления +5 фосфаты проявляют слабые окислительные свойства и могут взаимодействовать с восстановителями.
Фосфат кальция также восстанавливается алюминием при сплавлении:
Под действием едкого кали гидрофосфат калия образует более среднюю соль — фосфат калия: