Хлороводород
| Хлороводород | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | хлористый водород |
| Химическая формула | HCl |
| Физические свойства | |
| Состояние (ст. усл.) | газ |
| Отн. молек. масса | 36,4606 а. е. м. |
| Молярная масса | 36,4606 г/моль |
| Плотность | 1.477 г/л, газ (25 °C) г/см³ |
| Термические свойства | |
| Температура плавления | −114,22 °C |
| Температура кипения | −85 °C |
| Температура разложения | 1500 °C |
| Критическая точка | 51,4 °C |
| Энтальпия образования (ст. усл.) | -92,31 кДж/моль |
| Химические свойства | |
| pKa | — 4 |
| Растворимость в воде | 72,47 (20 °C) г/100 мл |
| Классификация | |
| Рег. номер CAS | [7647-01-0] |
Содержание
Свойства
Водный раствор хлористого водорода называется соляной кислотой. При растворении в воде протекают следующие процессы:
Процесс растворения сильно экзотермичен. С водой HCl образует азеотропную смесь, содержащую 20,24 % HCl.
Соляная кислота является сильной одноосновной кислотой, она энергично взаимодействует со всеми металлами, стоящими в ряду напряжений левее водорода, с основными и амфотерными оксидами, основаниями и солями, образуя соли — хлориды:
Mg + 2 HCl → MgCl2 + H2↑ FeO + 2 HCl → FeCl2 + H2O
Хлориды чрезвычайно распространены и имеют широчайшее применение (галит, сильвин). Большинство из них хорошо растворяется в воде и полностью диссоциирует на ионы. Слаборастворимыми являются хлорид свинца (PbCl2), хлорид серебра (AgCl), хлорид ртути(I) (Hg2Cl2, каломель) и хлорид меди(I) (CuCl).
При действии сильных окислителей или при электролизе хлороводород проявляет восстановительные свойства:
При нагревании хлороводород окисляется кислородом (катализатор — хлорид меди(II) CuCl2):
Однако, концентрированная соляная кислота реагирует с медью, при этом образуется комплекс одновалентной меди:
Смесь 3 объемных частей концентрированной соляной и 1 объемной доли концентрированной азотной кислот называется «царской водкой». Царская водка способна растворять даже золото и платину. Высокая окислительная активность царской водки обусловлена присутствием в ней хлористого нитрозила и хлора, находящихся в равновесии с исходными веществами:
Благодаря высокой концентрации хлорид-ионов в растворе металл связывается в хлоридный комплекс, что способствует его растворению:
Для хлороводорода также характерны реакции присоединения к кратным связям (электрофильное присоединение):
Получение
В лабораторных условиях хлороводород получают, воздействуя концентрированной серной кислотой на хлорид натрия (поваренную соль) при слабом нагревании:
В промышленности хлороводород ранее получали в основном сульфатным методом (методом Леблана), основанном на взаимодействии хлорида натрия с концентрированной серной кислотой. В настоящее время для получения хлороводорода обычно используют прямой синтез из простых веществ:
В производственных условиях синтез осуществляется в специальных установках, в которых водород непрерывно сгорает ровным пламенем в токе хлора, смешиваясь с ним непосредственно в факеле горелке. Тем самым достигается спокойное (без взрыва) протекание реакции. Водород подается в избытке (5 — 10 %), что позволяет полностью использовать более ценный хлор и получить незагрязненную хлором соляную кислоту.
Соляную кислоту получают растворением газообразного хлороводорода в воде.
Применение
Водный раствор широко используется для получения хлоридов, для травления металлов, очистки поверхности сосудов, скважин от карбонатов, обработки руд, при производстве каучуков, глутамината натрия, соды, хлора и других продуктов. Также применяется в органическом синтезе.
Безопасность
Примечания
Литература
Ссылки
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | — | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Хлороводород» в других словарях:
хлороводород — хлороводород … Орфографический словарь-справочник
ХЛОРОВОДОРОД — (НСl) бесцветный дымящий на воздухе газ с резким запахом, токсичен; плотность 1,64 кг/м3, tпл = 84,8 °С. Очень хорошо растворяется в воде с образованием хлороводородной (соляной) кислоты. В промышленности его получают прямым синтезом из (см.) и… … Большая политехническая энциклопедия
хлороводород — хем. соединение на хлорот со водородот, безбоен гас, се растворува во вода како солна киселина хлороводородна киселина хем. соединение на хлорот и водородот, на, хлороводород има широка примена во хемиската индустрија … Macedonian dictionary
хлороводород — vandenilio chloridas statusas T sritis chemija formulė HCl atitikmenys: angl. hydrochloric acid; hydrogen chloride rus. водорода хлорид; хлороводород … Chemijos terminų aiškinamasis žodynas
Хлороводород — хлористый водород (см. Хлор) … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
хлороводород — (хлористый водород), HCl, бесцветный, дымящий на воздухе газ; tпл 114,2°C, tкип 85,1°C. Хорошо растворяется в воде с образованием соляной кислоты. В промышленности получают как побочный продукт при хлорировании органических соединений, синтезом … Энциклопедический словарь
ХЛОРОВОДОРОД — (хлористый водород), НС1, бесцв., дымящий на воздухе газ; tnл 114,2 °С, tкип 85,1 оС. Хорошо растворяется в воде с образованием соляной кислоты. В пром сти получают как побочный продукт при хлорировании органич. соед., синтезом из элементов,… … Естествознание. Энциклопедический словарь
хлороводород — хлороводоро/д, а … Слитно. Раздельно. Через дефис.
хлороводород — хлористый водород … Cловарь химических синонимов I
хлористый водород — хлороводород … Cловарь химических синонимов I
Свойства хлороводорода, способы получения
Хлороводород — что это такое, формула
Хлороводород — это бесцветный газ с резким неприятным запахом.
Формула: HCl
Строение его молекулы определяет название соединения. Атомы хлора и водорода соединены ковалентной полярной связью.
Физические и химические свойства
Раствор хлороводорода в воде называют соляной кислотой. Процесс растворения можно описать с помощью следующего уравнения реакции:
При растворении хлороводорода выделяется большое количество теплоты.
Соляную кислоту относят к сильным одноосновным кислотам. Соединение активно вступает в химические реакции со следующими веществами:
В результате такого взаимодействия формируются соли соляной кислоты — хлориды:
M g + 2 H C l → M g C l 2 + H 2 ↑
F e O + 2 H C l → F e C l 2 + H 2 O
В присутствии сильных окислителей или в процессе электролиза хлороводород способен проявлять свойства восстановителя, при этом окисляясь с выделением газообразного хлора:
M n O 2 + 4 H C l → M n C l 2 + C l 2 ↑ + 2 H 2 O
В условиях повышенной температуры происходит окисление хлороводорода кислородом в присутствии катализатора, роль которого играет хлорид меди ( I I ) C u C l 2 :
4 H C l + O 2 → 2 H 2 O + 2 C l 2 ↑
Концентрированная соляная кислота взаимодействует с медью, что сопровождается образованием комплекса одновалентной меди:
2 C u + 4 H C l → 2 H [ C u C l 2 ] + H 2 ↑
Смесь, в состав которой входят три объемные части концентрированной соляной кислоты и одна объемная часть концентрированной азотной кислоты, носит название «царская водка». Данная смесь способна растворять золото и платину.
«Царская водка» характеризуется высокой окислительной способностью, что объясняется наличием в составе смеси хлористого нитрозила N O C l и хлора, находящихся в равновесии с исходными веществами:
За счет большого содержания хлорид-ионов в растворе происходит связывание металла. В результате образуется хлоридный комплекс, что является причиной его растворения:
3 P t + 4 H N O 3 + 18 H C l → 3 H 2 [ P t C l 6 ] + 4 N O + 8 H 2 O
В процессе присоединения хлороводорода к серному ангидриду происходит образование хлорсульфоновой кислоты H S O 3 C l :
S O 3 + H C l → H S O 3 C l
Хлороводород вступает в реакции присоединения по кратным связям в органических соединениях (электрофильное присоединение):
Взаимодействие с основаниями
Соляная кислота взаимодействует практически со всеми основаниями. При этом протекают реакции ионного обмена, в результате которых получают соль и воду:
При смешении соляной кислоты с аммиаком протекает реакция присоединения. В результате взаимодействия образуется соль в виде хлорида аммония. Уравнение реакции будет выглядеть так:
H C l + N H 3 → N H 4 C l
Соляная кислота также вступает в реакцию с амфотерными гидроксидами, которые в данном случае проявляют основные свойства. Взаимодействие с гидроксидом цинка:
2 H C l + Z n ( O H ) 2 → Z n C l 2 + 2 H 2 O
Способы получения, область применения
Лабораторный способ получения хлористого водорода заключается в реакции концентрированной серной кислоты с твердым хлоридом натрия (поваренной солью) в условиях повышенной температуры:
N a C l + H 2 S O 4 → N a H S O 4 + H C l ↑
P C l 5 + H 2 O → P O C l 3 + 2 H C l
R C O C l + H 2 O → R C O O H + H C l
Устаревший промышленный способ получения хлористого водорода заключался в методике Леблана. В процессе реакции твердый хлорид натрия взаимодействует с концентрированной серной кислотой.
В современной промышленности хлороводород производят с помощью прямого синтеза из простых веществ:
В промышленных масштабах хлористый водород производят на специальных установках путем сжигания водорода в хлоре. Причем водород попадает в пламя в небольшом избытке. Тогда весь объем подаваемого хлора реагирует, и на выходе получается продукт более высокого качества.
Газообразный хлороводород практически не используется из-за его физических и химических характеристик. Широкое применение находит соляная кислота:
Техника безопасности
При попадании хлороводорода в дыхательные пути может наступить сильное удушье. А его водный раствор высокой концентрации вызывает химические ожоги. Поэтому работать с хлористым водородом и соляной кислотой следует только в маске (респираторе), защитных перчатках и очках.
При вдыхании газа необходимо немедленно вывести пострадавшего на воздух и при необходимости сделать искусственное дыхание. В случае проглатывания соляной кислоты требуется промывание желудка.
Если кислота попала на кожу, пораженный участок следует промыть водой и обработать слабым раствором соды, который нейтрализуют кислоту. В случае попадания на слизистые оболочки после промывания нужно закапать глаза, нос или горло раствором новокаина и дикаина с адреналином.
Водород хлористый (хлороводород)
HCl, при обычных условиях бесцветный газ с резким запахом; на воздухе при поглощении влаги образует туман, представляющий собой мельчайшие капельки соляной кислоты (См. Соляная кислота). Масса 1 л Х. в. при 0°С и 0,1 Мн/м2(1 кгс/см2) 1,6391 г; плотность по воздуху 1,268; плотность жидкого Х. в при — 60°C 1,12 г/см3; tпл —114,2°С; tkип —85,1°С. Критические константы: температура 51,4°C; давление 8,45 Мн/м2(84,5 кгс/см2); плотность 0,42 г/см3; удельный объём 2380 см3/г. Х.
в. растворяется в воде с выделением тепла; при этом образуется соляная кислота. Под давлением 0,1 Мн/м2(1 кгс /см2) 1 л воды растворяет 500 л HCl при 2°С, 442 л при 20°C, 339 л при 60°C.
Х. в. — стойкое соединение; при 1800°C он диссоциирует на Cl2 и H2 только в незначительной степени. Химически в отсутствие H2O Х. в. малоактивен, в газообразном виде не реагирует с углеродом, фосфором, серой, железом. При нагревании с кислородом до 400—500°C в присутствии катализатора CuCl2 Х. в. окисляется до хлора: 4HCl + O2 = 2Н2О + 2Cl2. Со щелочными металлами, алюминием и магнием реагирует с выделением водорода, особенно легко при нагревании, например: 2Al + 6HCl = 2AlCl3 + 3Н2. С аммиаком взаимодействует с образованием дыма — твёрдых частиц хлорида аммония NH4Cl. В присутствии катализаторов присоединяется к ненасыщенным органическим соединениям, например: C2H4 + HCl → C2H5Cl.
Получают Х. в. прямым синтезом из элементов или действием серной кислоты на хлорид натрия. Большие количества Х. в. получаются как побочный продукт при хлорировании (См. Хлорирование) органических соединений: RH + Cl2 = RCl + HCl (где R — радикал), а также при гидролизе хлорида магния: MgCl2 + H2O = MgO + 2HCl. Мировое производство Х. в. составляет около 10 млн. т (1975).
Х. в. используют для получения соляной кислоты, синтеза органических соединений, например Винилхлорида.
Лит.: Якименко Л. М., Производство хлора, каустической соды и неорганических хлорпродуктов, М., 1974; Якименко Л. М., Пасманик М. И., Справочник по производству хлора, каустической соды и основных хлорпродуктов, 2 изд., М., 1976.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
Свойства
Водный раствор хлористого водорода называется соляной кислотой. При растворении в воде протекают следующие процессы:
Процесс растворения сильно экзотермичен. С водой HCl образует азеотропную смесь, содержащую 20,24 % HCl.
Соляная кислота является сильной одноосновной кислотой, она энергично взаимодействует со всеми металлами, стоящими в ряду напряжений левее водорода, с основными и амфотерными оксидами, основаниями и солями, образуя соли — хлориды:
Хлориды чрезвычайно распространены в природе и имеют широчайшее применение (галит, сильвин). Большинство из них хорошо растворяется в воде и полностью диссоциируют на ионы. Слаборастворимыми являются хлорид свинца(II) (PbCl2), хлорид серебра (AgCl), хлорид ртути(I) (Hg2Cl2, каломель) и хлорид меди(I) (CuCl).
При действии сильных окислителей или при электролизе хлороводород проявляет восстановительные свойства:
При нагревании хлороводород окисляется кислородом (катализатор — хлорид меди(II) CuCl2):
Концентрированная соляная кислота реагирует с медью, при этом образуется комплекс одновалентной меди:
Смесь 3 объемных частей концентрированной соляной и 1 объемной доли концентрированной азотной кислот называется «царской водкой». Царская водка способна растворять даже золото и платину. Высокая окислительная активность царской водки обусловлена присутствием в ней хлористого нитрозила и хлора, находящихся в равновесии с исходными веществами:
Благодаря высокой концентрации хлорид-ионов в растворе металл связывается в хлоридный комплекс, что способствует его растворению:
Присоединяется к серному ангидриду, образуя хлорсульфоновую кислоту HSO3Cl:
Для хлороводорода также характерны реакции присоединения к кратным связям (электрофильное присоединение):
Химия
Пары соляной кислоты токарных рНов бумагу красных, показывающие, что пары являются кислыми
HCl + H 2 O → H 3 O + + Cl- —
HCl + СН 3 ОН → СН 3 О + Н 2 + Cl —
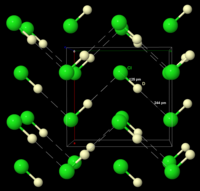
Структура и свойства
| Температура (° С) | 0 | 20 | 30 | 50 |
|---|---|---|---|---|
| вода | +823 | 720 | +673 | 596 |
| метанол | 513 | 470 | 430 | |
| Этиловый спирт | 454 | 410 | 381 | |
| простой эфир | 356 | 249 | 195 |
Инфракрасный (ИК) спектр поглощения
Один дублет в ИК-спектре в результате изотопного состава хлора
3,47 мкм). При комнатной температуре, почти все молекулы находятся в первом колебательном состоянии V = 0. В том числе ангармонизма колебательная энергия может быть записана в виде.
Кристаллические модификации, цвет растворов и паров:
Получение
В лабораторных условиях хлороводород получают, воздействуя концентрированной серной кислотой на хлорид натрия (поваренную соль) при слабом нагревании:
HCl также можно получить гидролизом ковалентных галогенидов, таких, как хлорид фосфора(V), тионилхлорид (SOCl2), и гидролизом хлорангидридов карбоновых кислот:
В промышленности хлороводород ранее получали в основном сульфатным методом (методом Леблана), основанном на взаимодействии хлорида натрия с концентрированной серной кислотой. В настоящее время для получения хлороводорода обычно используют прямой синтез из простых веществ:
В производственных условиях синтез осуществляется в специальных установках, в которых водород непрерывно сгорает ровным пламенем в токе хлора, смешиваясь с ним непосредственно в факеле горелки. Тем самым достигается спокойное (без взрыва) протекание реакции. Водород подается в избытке (5 — 10 %), что позволяет полностью использовать более ценный хлор и получить незагрязненную хлором соляную кислоту.
Соляную кислоту получают растворением газообразного хлороводорода в воде.
Приложения
Наиболее хлористый водород используется в производстве соляной кислоты. Это также является важным реагентом в других промышленных химических превращений, например:
В полупроводниковой промышленности, он используется для обоих травления полупроводниковых кристаллов и очистить кремния с помощью трихлорсилана (SiHCl 3 ).
история
Безопасность
Хлороводород ядовит. Вдыхание хлороводорода может привести к кашлю, удушению, воспалению носа, горла и верхних дыхательных путей, а в тяжёлых случаях — к отёку легких, нарушению работы кровеносной системы и даже смерти. Контактируя с кожей может вызывать покраснение, боль и серьёзные ожоги. Хлористый водород может вызвать серьёзные ожоги глаз и их необратимое повреждение.
Смертельная концентрация (ЛК50):
3 г/м³ (человек, 5 минут)
1,3 г/м³ (человек, 30 минут)
3,1 г/м³ (крыса, 1 час)
1,1 г/м³ (мышь, 1 час)
Смертельная доза (ЛД50) — 238 мг/кг
Использовался как отравляющее средство во время войн.
Температурные константы смесей:
108,584 °C (температура кипения азеотропа, давление 1 атм) вода 79,778% хлороводород 20,222%
-74,7 °C (температура плавления эвтектической смеси) вода 77% хлороводород 23%
Растворимость (в г/100 г или характеристика):
бензол: растворим 1,9 (20°C)
вода: 96 (-18,3°C)
вода: 93,31 (-15°C)
вода: 89,79 (-10°C)
вода: 82,3 (0°C)
вода: 78,7 (10°C)
вода: 72,47 (20°C)
вода: 67,3 (30°C)
вода: 63,3 (40°C)
вода: 59,6 (50°C)
вода: 56,1 (60°C)
диэтиловый эфир: растворим 33,2 (20°C)
метанол: 88,7 (20°C)
серная кислота концентрированная: 0,4015 (25°C)
этанол: растворим
этанол абсолютный: 69,5 (20°C)
Плотность:
0,0016391 (0°C, г/см3)
1,187 (-85,1°C, г/см3)
1,045 (-155°C, г/см3)
1,469 (-166°C, г/см3)
1,48 (-154,79°C, г/см3)
Плотность растворов (г/см3):
1,01 (2.36%, 20°C, растворитель — вода)
1,03 (6.43%, 20°C, растворитель — вода)
1,05 (10.52%, 20°C, растворитель — вода)
1,06 (12.51%, 20°C, растворитель — вода)
1,07 (14.49%, 20°C, растворитель — вода)
1,08 (16.47%, 20°C, растворитель — вода)
1,1 (20.39%, 20°C, растворитель — вода)
1,155 (31.14%, 20°C, растворитель — вода)
1,198 (40%, 20°C, растворитель — вода)
Лечение отравлений:
При поражении глаз после промывания впустить в глаза по 1 капле 2% раствора новокаина или 0,5% раствора дикаина с адреналином (1:1000) с последующей инсталляцией стерильного вазелинового или персикового масла в конъюнктивальный мешок. Очки-консервы. В дальнейшем — 30% раствор альбуцида, гидрокортизоновая мазь. При попадании кислоты в глаза промывать их водой, а не нейтрализующими (щелочными) растворами.
При попадании крепкой кислоты на кожу — немедленное обмывание ее водой, лучше под давлением (например, из гидранта в течение 5-10 мин. В здравпункте наложить на обожженную поверхность кашицу из соды.
Дополнительная информация:
Химия безводного хлороводорода и его водного раствора различны.
Безводный хлороводород сильно дымит во влажном воздухе. Безводный хлороводород химически пассивен: не реагирует с серой, фосфором, углем, многими металлами. С нитридами, карбидами, боридами и сульфидами реагирует выше 650 С, с гидридами кремния, германия и бора — в присутствии хлорида алюминия, с оксидами переходных металлов — при 300 С и выше. Окисляется кислородом и азотной кислотой до хлора, с триоксидом серы дает хлорсульфоновую кислоту.
Водный раствор называется соляная кислота. Это бесцветная жидкость с резким запахом, сильная кислота, химически активна. Растворяет с выделением водорода все металлы имеющие отрицательный нормальный потенциал, со многими оксидами и гидроксидами дает хлориды, вытесняет более слабые кислоты (фосфорную, борную и т.д.) из их солей.
Производство 31%-ной соляной кислоты в СССР составляло 1 520 000 т. (1986).