кислород
Полезное
Смотреть что такое «кислород» в других словарях:
КИСЛОРОД — ( Охуgenum ). Бесцветный газ без запаха и вкуса. Мало растворим в воде (приблизительно 1:43). Ингаляциями кислорода широко пользуются при различных заболеваниях, сопровождающихся гипоксией: при заболеваниях органов дыхания (пневмония, отек легких … Словарь медицинских препаратов
КИСЛОРОД — (Oxygenium), О, химический элемент VI группы периодической системы, атомный номер 8, атомная масса 15,9994; газ, tкип 182,962шC. Кислород наиболее распространенный элемент, в атмосфере 23,10% по массе свободного кислорода, в гидросфере и… … Современная энциклопедия
КИСЛОРОД — (лат. Oxygenium) О, химический элемент VI группы периодической системы, атомный номер 8, атомная масса 15,9994. В свободном виде встречается в виде двух модификаций О2 ( обычный кислород) и О3 (озон). О2 газ без цвета и запаха, плотность 1,42897… … Большой Энциклопедический словарь
КИСЛОРОД — КИСЛОРОД, самый легкий элемент VI группы периодической системы Менделеева, симв. О, порядковый номер 8. К. газ без цвета, запаха и вкуса. Изотопов не имеет. Ат. в. 16,000, мол. в. 32,000. Уд. в. К. по отношению к воздуху 1,10535; при 0° и 760 … Большая медицинская энциклопедия
Кислород — самый распространенный элемент земной коры. Содер. его составляет 49,13 по весу и 91,8% по объему. В литосфере содер. 47% К. по весу, в гидросфере 85,89% и в атмосфере 23,01%. Подавляющая часть атомов К. (около 99,99%) имеет высокую хим.… … Геологическая энциклопедия
КИСЛОРОД — (символ О), обычно газообразный химический элемент, необходимый для ДЫХАНИЯ растений и животных и для горения. Был открыт в 1774 г. Джозефом ПРИСТЛИ и независимо от него Карлом ШЕЕЛЕ (около 1772 г.). Газ без вкуса и запаха, являющийся самым… … Научно-технический энциклопедический словарь
КИСЛОРОД — (Oxygenium), O, хим. элемент VI группы периодич. системы элементов, ат. номер 8, ат. масса 15,9994 а. е. м. Природный К. состоит из трёх стабильных изотопов: 16 О(99,762%),17 О (0,038%) и 18O (0,200%). Ядра атомов 16 О содержат 8 протонов и 8… … Физическая энциклопедия
кислород — халькоген, органоген, озон, оксиген Словарь русских синонимов. кислород сущ., кол во синонимов: 8 • газ (55) • неметалл … Словарь синонимов
КИСЛОРОД — КИСЛОРОД, кислорода, мн. нет, муж. Газ, химический элемент, входящий в состав воздуха и необходимый для дыхания. В тесной комнате чувствуется недостаток кислорода. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
КИСЛОРОД — КИСЛОРОД, а ( у), муж. Химический элемент, бесцветный газ, входящий в состав воздуха, необходимый для дыхания и горения. | прил. кислородный, ая, ое. Кислородное голодание, кислородная недостаточность (пониженное содержание кислорода в организме; … Толковый словарь Ожегова
КИСЛОРОД — самый распространенный в природе элемент, представляющий собой газ без цвета, запаха и вкуса. Встречается в соединении с водородом (вода), с разными металлами и металлоидами, в минералах и горных породах и в свободном состоянии в воздухе. Для… … Технический железнодорожный словарь
Кислород
| Кислород | |
|---|---|
| Газ без цвета, вкуса и запаха; голубоватая жидкость (при низких температурах) | |
 |
жидкость: 1,141 г/см³
Кислород (O, лат. oxygenium ) — химический элемент 16-й группы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VI группы, или к группе VIA), второго периода периодической системы, с атомным номером 8. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Как простое вещество при нормальных условиях представляет собой газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
Содержание
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygene ), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
Нахождение в природе
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
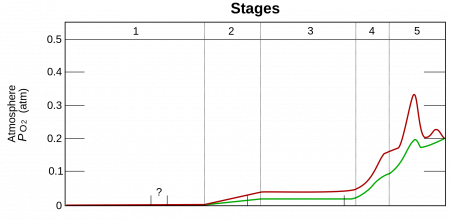
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 10 15 тонн). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад, в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы). Первый миллиард лет практически весь кислород поглощался растворённым в океанах железом и формировал залежи джеспилита. 3—2,7 млрд лет назад он начал выделяться в атмосферу и 1,7 млрд лет назад достиг 10 % от нынешнего уровня.
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
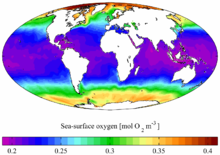
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов.
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
В 2016 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад.
Получение
Перегонка жидкого воздуха
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Разложение кислородсодержащих веществ
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
Используют также реакцию каталитического разложения пероксида водорода H2O2 в присутствии оксида марганца (IV):
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
Разложение оксида ртути (II) (при t = 100 °C) было первым методом синтеза кислорода:
2HgO → 100oC 2Hg + O2↑
Электролиз водных растворов
К лабораторным способам получения кислорода относится метод электролиза разбавленных водных растворов щелочей, кислот и некоторых солей (сульфатов, нитратов щелочных металлов):
Реакция перекисных соединений с углекислым газом
На подводных лодках и орбитальных станциях обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
Для соблюдения баланса объёмов поглощённого углекислого газа и выделившегося кислорода, к нему добавляют надпероксид калия. В космических кораблях для уменьшения веса иногда используется пероксид лития.
Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
CS2 + 3O2→ CO2 + 2SO2
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Кислород
Кислоро́д / Oxygenium (Oxygen)(O), 8
3,4099 кДж/моль кДж/моль
a=5,403 b=3,429 c=5,086 β=135,53 Å
Кислоро́д — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом O (лат. Oxygenium ). Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород (CAS-номер: 7782-44-7) при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон (CAS-номер: 10028-15-6) — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
Содержание
История открытия
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygène ), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
Нахождение в природе
Кислород — самый распространённый на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47,4 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,12 % по массе. Более 1500 соединений земной коры в своём составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
Получение
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
К лабораторным способам получения кислорода относится метод электролиза водных растворов щелочей, а также разложение оксида ртути(II) (при τ = 100 °C):
Физические свойства
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при 50 °C) и спирте (2,78 мл/100 г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость.
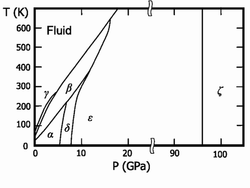
Твёрдый кислород (температура плавления −218,35°C) — синие кристаллы. Известны шесть кристаллических фаз, из которых три существуют при давлении в 1 атм.:
Ещё три фазы образуются при высоких давлениях:
Химические свойства
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:

Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
Окисляет большинство органических соединений:
При определённых условиях можно провести мягкое окисление органического соединения:
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже #фториды кислорода).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
Фториды кислорода
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон).
Применение
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали или переработки штейнов связан с применением кислорода. Во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородно-воздушную смесь.
Сварка и резка металлов
Кислород в баллонах голубого цвета широко используется для газопламенной резки и сварки металлов.
Ракетное топливо
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине
В пищевой промышленности
В химической промышленности
В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах, например, — окисления углеводородов в кислородсодержащие соединения (спирты, альдегиды, кислоты), аммиака в окислы азота в производстве азотной кислоты. Вследствие высоких температур, развивающихся при окислении, последние часто проводят в режиме горение.
В сельском хозяйстве
В тепличном хозяйстве, для изготовления кислородных коктейлей, для прибавки в весе у животных, для обогащения кислородом водной среды в рыбоводстве.
Биологическая роль кислорода
Большинство живых существ (аэробы) дышат кислородом воздуха. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15 O применяется для исследований скорости кровотока, лёгочной вентиляции.
Токсические производные кислорода
Некоторые производные кислорода (т. н. реактивные формы кислорода), такие как синглетный кислород, перекись водорода, супероксид, озон и гидроксильный радикал, являются высокотоксичными продуктами. Они образуются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный радикал), перекись водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Изотопы
Кислород имеет три устойчивых изотопа: 16 О, 17 О и 18 О, среднее содержание которых составляет соответственно 99,759 %, 0,037 % и 0,204 % от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов наиболее лёгкого из них 16 О связано с тем, что ядро атома 16 О состоит из 8 протонов и 8 нейтронов (дважды магическое ядро с заполненными нейтронной и протонной оболочками). А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Также известны радиоактивные изотопы кислорода: от 12 О до 24 О. Все радиоактивные изотопы кислорода имеют малый период полураспада, а 12 O распадается за 5,8·10 −22 секунды.