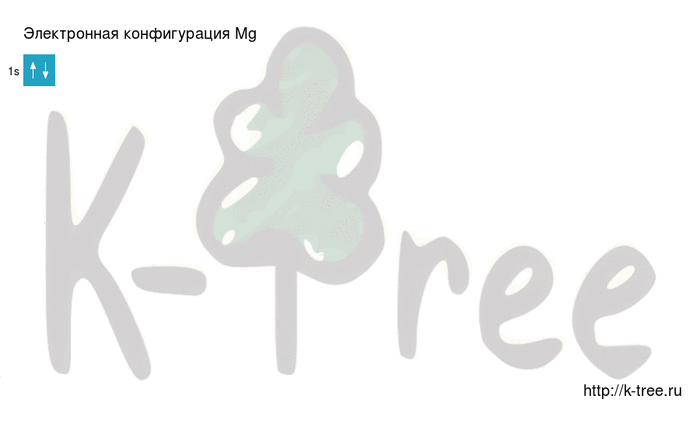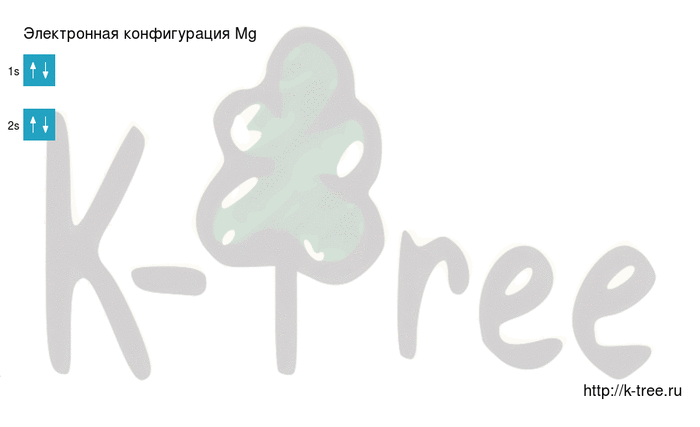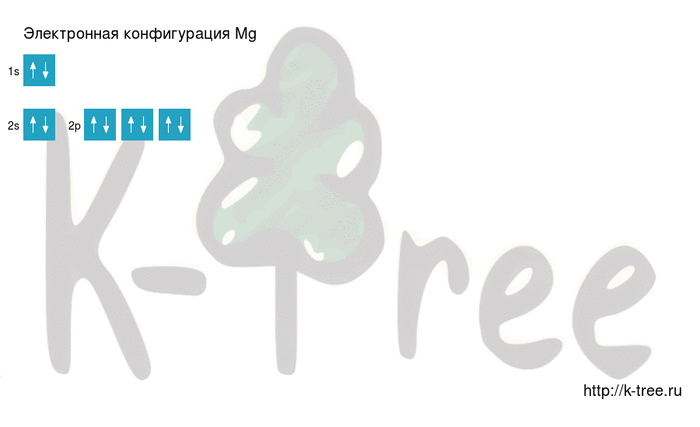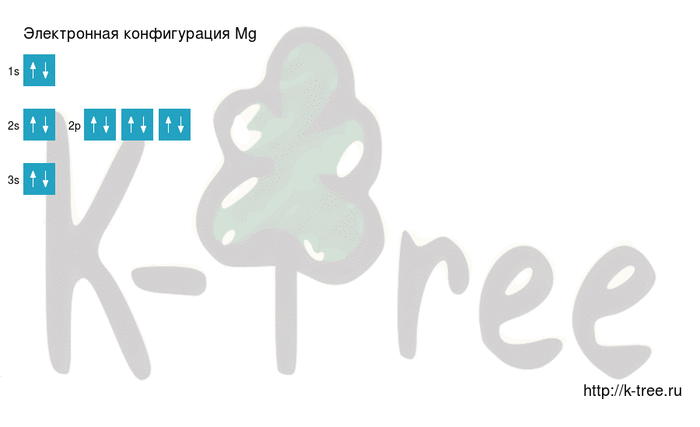Магний (Mg, Magnesium)
История магния
Магний в виде металла был впервые получен Гемфри Дэви в 1808 году. Английский химик проводил процесс электролиза между влажной смесью белой магнезии и оксидом ртути, в результате чего получил сплав ртути с неизвестным металлом (амальгаму). После выгонки ртути Дэви получил новое вещество – порошок металла, который был назван магнием (calorizator). Через два десятилетия, в 1828 году француз А.Бюсси получил чистый металлический магний.
Общая характеристика магния
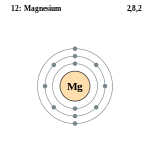
Магний является элементом главной подгруппы II группы III периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 12 и атомную массу 24,305. Принятое обозначение – Mg (от латинского Magnesium).
Нахождение в природе
По количеству содержания в земной коре магний занимает 8-е место среди минеральных веществ, он очень распространён. Природными источниками магния являются морская вода, ископаемые минеральные отложения и рассолы.
Физические и химические свойства
Магний является лёгким и ковким металлом, его цвет – серебристо-белый с явным металлическим блеском. В обычном состоянии покрыт плёнкой оксида магния, которую можно разрушить, нагрев металл до 600-650˚С. Магний сгорает, выделяя ослепительно белое пламя и образуя оксид и нитрид магния.
Суточная потребность в магнии
Суточная потребность в магнии зависит от возраста, пола и физического состояния человека. Для здорового взрослого человека составляет от 400 до 500 мг.
Продукты питания богатые магнием
В продуктах питания содержится различное количество магния, расположим их по мере убывания содержания полезного микроэлемента:
Усвояемость магния
Всасывание органических соединений магния в основном происходит в двенадцатиперстной и толстой кишках, при чрезмерном употреблении кофеина, алкоголя и калия организм теряет значительную часть магния с мочой.
Взаимодействие с другими
Для организма важен баланс между кальцием и магнием, потому что именно эти минералы отвечают за нормальное состояние костной ткани и зубов. В аптечных витаминно-минеральных комплексах количество кальция и магния содержится в оптимальных количествах.
Натрий, магний и фосфор регулируют процессы в нервной системе и отвечают за мышечную активность. Обменные процессы магния в организме происходят с помощью витаминов В6, D, Е и калия.
Признаки нехватки магния
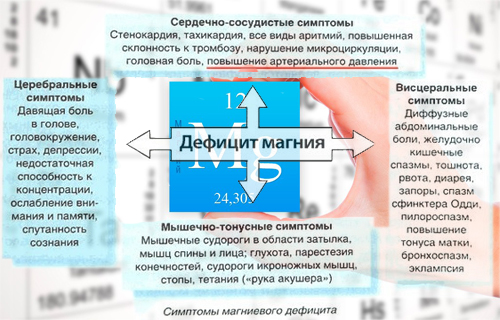
Нехватку магния в организме могут вызвать болезни почек, расстройство желудка, приём мочегонных средств и некоторых контрацептивов, чрезмерное увлечение алкоголем и кофеином. Признаками нехватки магния считают бессонницу, раздражительность, головокружения, нарушения сердцебиения и скачки кровяного давления, частые головные боли, чувство усталости, мерцающие точки перед глазами, судороги, мышечные спазмы, выпадение волос.
Признаки избытка магния
Признаками избытка магния считают:
Полезные свойства магния и его влияние на организм
Магний важен для эффективного функционирования нервов и мышц, важен для превращения сахара крови в энергию. Магний поддерживает здоровое состояние зубов, помогает предупредить отложения кальция, камни в почках и желчном пузыре, приносит облегчение при несварении. Организм человека содержит приблизительно 21 г магния.
Магний нормализует деятельность сердечно-сосудистой и эндокринной систем организма, функции головного мозга, оказывает помощь при выведении токсинов и тяжёлых металлов.
Применение магния в жизни
Соединения магния (сплавы) используются в самолётостроении и автомобильном производстве из-за прочности и лёгкости магниевых сплавов. Магний применяется как химический источник тока, в медицине, военном деле, в фотографии.
Магний
лёгкий, ковкий, серебристо-белый металл
История
Происхождение названия
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари называли её горькой солью, а также английской, или эпсомской солью. Минерал эпсомит имеет состав MgSO4 · 7H2O.
Впервые был выделен в чистом виде сэром Хемфри Дэви в 1808 году.
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния:
Расплавленный металл периодически отбирают из электролизной ванны, а в нее добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много — около 0,1 % примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния, или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс:
или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
2MgO + CaO + Si = Ca2SiO4 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду.
Физические свойства
Магний — очень легкий, довольно хрупкий металл, постепенно окисляется на воздухе, превращаясь в белый оксид магния. Кристаллическая решетка α-формы Ca (устойчивой при обычной температуре) гранецентрированная кубическая, а = 5,56Å. Атомный радиус 1,97Å, ионный радиус Ca2+, 1,04Å. Плотность 1,74 г/см³(20 °C). Выше 464 °C устойчива гексагональная β-форма. tпл = 650 °C, tкип = 1105 °C; температурный коэффициент линейного расширения 22•10-6 (0-300 °C); теплопроводность при 20 °C 125,6 Вт/(м•К) или 0,3 кал/(см•сек•°C); удельная теплоемкость (0-100 °C) 623,9 дж/(кг•К) или 0,149 кал/(г•°C); удельное электросопротивление при 20 °C 4,6•10-8 ом•м или 4,6•10-6ом•см; температурный коэффициент электросопротивления 4,57•10-3 (20 °C). Модуль упругости 26 Гн/м² (2600 кгс/мм²); предел прочности при растяжении 60 Мн/м² (6 кгс/мм²); предел упругости 4 Мн/м² (0,4 кгс/мм²), предел текучести 38 Мн/м² (3,8 кгс/мм²); относительное удлинение 50 %; твердость по Бринеллю 200—300 Мн/м² (20-30 кгс/мм²). Магний достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
Химические свойства
Смесь порошкового магния с перманганатом калия KMnO4 — взрывчатое вещество! Раскаленный магний реагирует с водой:
Mg (раск.) + Н2О = MgO + H2;
Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:
Mg + 2HCl = MgCl2 + H2;
При нагревании на воздухе магний сгорает, с образованием оксида, также с азотом может образовываться небольшое количество нитрида:
2Mg + О2 = 2MgO;
3Mg + N2 = Mg3N2
Определение
Серебристо-белый, средний по твердости металл. Средне распространен в природе. При горении выделяется большое количество света и тепла.
Применение
Сплавы
Сплавы на основе магния являются важным конструкционным материалом в авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Цены на магний в слитках в 2006 году составили в среднем 3 долл/кг.
Химические источники тока
Магний в виде чистого металла, а так же его химические соединения (бромид, перхлорат) применяются для производства очень мощных резервных электрических батарей (например магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др), и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др). ХИТ на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высоким разрядным напряжением. В последние годы в ряде стран обострилась проблема разработки аккумулятора с большим сроком службы, так как теоретические данные позволяют утверждать очень большие перспективы его широкого использования (высокая энергия, экологичность, доступность сырья).
Соединения
Гидрид магния — один из наиболее емких аккумуляторов водорода, применяемых для его хранения.
Огнеупорные материалы
Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
Перхлорат магния, Mg(ClO4)2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с участием магния.
Фторид магния MgF2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния MgBr2 — в качестве электролита для химических резервных источников тока.
Медицина
Оксид и соли магния применяется в медицине (аспаркам, сульфат магния, цитрат магния, минерал бишофит). Бишофитотерапия использует биологические эффекты природного магния в лечении и реабилитации широкого круга заболеваний, в первую очередь — опорно-двигательного аппарата, нервной и сердечно-сосудистой систем.
Фотография
Магниевый порошок с окисляющими добавками (нитрат бария, нитрат аммония, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Биологическая роль и токсикология
Магний — один из важных биогенных элементов, в значительных количествах содержится в тканях животных и растений. Магний является кофактором многих ферментативных реакций. Магний необходим для превращения креатина фосфата в АТФ — нуклеотид, являющийся универсальным поставщиком энергии в живых клетках организма. Поэтому магний является тем элементом, который контролирует энергетику организма. Магний необходим на всех этапах синтеза белка. Установлено также, что 80—90 % современных людей страдают от дефицита магния. Это может проявляться по-разному: бессоница, хроническая усталость, остеопороз, артрит, фибромиалгия, мигрень, мышечные судороги и спазмы, сердечная аритмия, запоры, предменструальный синдром (ПМС) и прочие симптомы и болезни. А при частом употреблении слабительных, алкоголя, больших психических и физических нагрузках потребность в магнии увеличивается.
К пище, богатой магнием, относятся: кунжут, отруби, орехи. Магния совсем мало в хлебе, молочных, мясных и других повседневных продуктах питания современного человека. Для получения суточной нормы магния, порядка 300 мг для женщин и 400 мг для мужчин, необходимо выпивать 2—3 литра молока или съедать 1,5—2 кг мяса.
По результатам последних исследований обнаружено, что цитрат магния является наиболее усваиваемым магниесодержащим продуктом.
Установлено, что чтобы усвоить кальций, организму необходим магний. Одним из наиболее биологически целесообразных источников магния при транскутанном (чрезкожном) всасывании является минерал бишофит, широко использующийся в целях медицинской реабилитации, физиотерапии и санаторно-курортного лечения.
Магний, Magnesium, Mg (12)
Название магнезия встречается уже в Лейденском папирусе-Х (Ш в.). Оно происходит, вероятно, от названия города в гористой местности Фессалии — Магнисия. Магнесийским камнем в древности назывались магнитная окись железа, а магнесом — магнит. Эти названия перешли в латинский и другие языки.
Внешнее сходство магнитной окиси железа с пиролизитом (двуокисью марганца) привело к тому, что магнезийским камнем, магнетисом и магне стали называть минералы и руды темной и темно-коричневой окраски, а в дальнейшем и другие минералы. В алхимической литературе слово магнес (Magnes) обозначало многие вещества, например ртуть, эфиопский камень, гераклийский камень. Минералы, rдержащие магний, тоже были известны с глубокой древности (доломит, тальк, асбест, нефрит и др.) и уже тогда находили широкое применение. Однако их считали не индивидуальными веществами, а видоизменениями других, более известных минералов, чаще всего извести.
Установить тот факт, что в магнийсодержащих минералах и солях присутствует особое металлическое основание, помогли исследования минеральной воды Эпсомского источника в Англии, открытого в 1618 г. Твердую соль из горькой эпсомской воды выделил в 1695 г. Грю, указав при этом, что по своей природе эта соль заметно отличается от всех других солей. В XVIII в. эпсомской солью занимались многие видные химики-аналитики — Бергман, Нейман, Блэк и др. Когда в континентальной Европе были открыты источники воды, подобной эпсомской, эти исследования расширились еще больше. По-видимому, Нейман первым предложил называть эпсомскую соль (карбонат магния) белой магнезией в отличие от черной магнезии (пиролюзита). Земля белой магнезии (Magnesia alba) под названием магнезия фигурирует в списке простых тел Лавуазье, причем синонимом этой земли Лавуазье считает «основание эпсомской соли» (base de sel d’Epsom).
В русской литературе начала XIX в. магнезия именовалась иногда горькоземом. В 1808 г. Дэви, подвергая белую магнезию электролизу, получил немного нечистого металлического магния; в чистом виде этот металл был получен Бусси в 1829 г. Вначале Дэви предложил назвать новый металл магнием (Magnium) в отличие от магнезии, которая в то время обозначала металлическое основание пиролюзита (Magnesium). Однако, когда название черной магнезии было изменено, Дэви предпочел называть металл магнезием. Интересно, что первоначальное название магний уцелело только в русском языке благодаря учебнику Гесса. В начале XIX в. предлагались и другие названия — магнезь (Страхов), магнезий, горькоземий (Щеглов).
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Магний Mg
Магний в таблице менделеева занимает 12 место, в 3 периоде.
| Символ | Mg |
| Номер | 12 |
| Атомный вес | 24.3040000 |
| Латинское название | Magnesium |
| Русское название | Магний |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема магния
Порядок заполнения оболочек атома магния (Mg) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Магний имеет 12 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
Степень окисления магния
Атомы магния в соединениях имеют степени окисления 2.
Ионы магния
Валентность Mg
Атомы магния в соединениях проявляют валентность II.
Валентность магния характеризует способность атома Mg к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Mg
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева