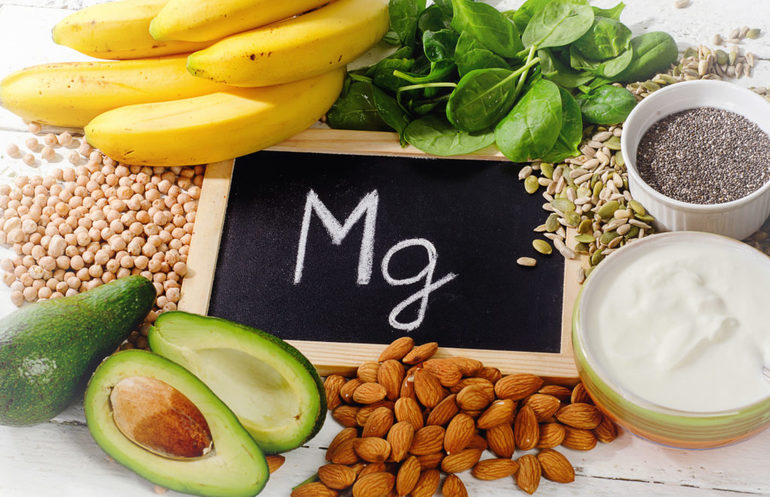магний
Полезное
Смотреть что такое «магний» в других словарях:
МАГНИЙ — (ново лат. magnium, от лат. magnesia). Серебристый металл, составляющий основание магнезии. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. МАГНИЙ блестящий металл серебристо белого цвета, горит очень ярким белым… … Словарь иностранных слов русского языка
МАГНИЙ — (Magnesium), Mg, химический элемент II группы периодической системы, атомный номер 12, атомная масса 24,305; относится к щелочно земельным металлам; tпл 650шC. Входит в состав хлорофилла. Магний компонент сплавов, осветительных и зажигательных… … Современная энциклопедия
МАГНИЙ — (символ Mg), металлический элемент серебристо белого цвета, один из ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ. Восьмой по распространенности элемент земной коры. Впервые был выделен в 1808 г. Хэмфри ДЭВИ. Необходим в питании человека и животных. Магний всегда… … Научно-технический энциклопедический словарь
Магний — (Magnesium), Mg, химический элемент II группы периодической системы, атомный номер 12, атомная масса 24,305; относится к щелочно земельным металлам; tпл 650°C. Входит в состав хлорофилла. Магний компонент сплавов, осветительных и зажигательных… … Иллюстрированный энциклопедический словарь
МАГНИЙ — МАГНИЙ, см. магнезия. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
Магний — Mg (лат. Magnesium * a. magnesium; н. Magnesium; ф. magnesium; и. magnesio), хим. элемент II группы периодич. системы Менделеева, ат. н. 12, ат. м. 24,312. Природный M. состоит из смеси стабильных изотопов 24Mg (78,6%), 25Mg (10,11%) и… … Геологическая энциклопедия
МАГНИЙ — МАГНИЙ, магния, мн. нет, муж. (ново лат. magnium) (хим.). Мягкий серебристо белый металл, горящий белым ослепительным пламенем. Группа снята вечером при вспышке магния. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
МАГНИЙ — МАГНИЙ, я, муж. Химический элемент, мягкий лёгкий серебристо белый металл, горящий ярким белым светом. | прил. магниевый, ая, ое. Магниевая вспышка. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
МАГНИЙ — (лат. Magnesium), Mg, хим. элемент II группы периодич. системы элементов; ат. номер 12, ат. масса 24,305. Природный М. содержит 3 стабильных изотопа: 24Mg (78,99%), 25Mg (10,00%) и 26Mg (11,01%). Электронная конфигурация внеш. оболочки 3s2.… … Физическая энциклопедия
МАГНИЙ — серебристо белого цвета легкий металл (уд. вес 1,74), близкий по свойствам к алюминию. Темп pa плавления 650°; сопротивление на разрыв 12 кг/мм2; горит ярким пламенем. В промышленности находит все более широкое распространение при изготовлении… … Технический железнодорожный словарь
МАГНИЙ
Полезное
Смотреть что такое «МАГНИЙ» в других словарях:
МАГНИЙ — (ново лат. magnium, от лат. magnesia). Серебристый металл, составляющий основание магнезии. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. МАГНИЙ блестящий металл серебристо белого цвета, горит очень ярким белым… … Словарь иностранных слов русского языка
МАГНИЙ — (Magnesium), Mg, химический элемент II группы периодической системы, атомный номер 12, атомная масса 24,305; относится к щелочно земельным металлам; tпл 650шC. Входит в состав хлорофилла. Магний компонент сплавов, осветительных и зажигательных… … Современная энциклопедия
МАГНИЙ — (символ Mg), металлический элемент серебристо белого цвета, один из ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ. Восьмой по распространенности элемент земной коры. Впервые был выделен в 1808 г. Хэмфри ДЭВИ. Необходим в питании человека и животных. Магний всегда… … Научно-технический энциклопедический словарь
Магний — (Magnesium), Mg, химический элемент II группы периодической системы, атомный номер 12, атомная масса 24,305; относится к щелочно земельным металлам; tпл 650°C. Входит в состав хлорофилла. Магний компонент сплавов, осветительных и зажигательных… … Иллюстрированный энциклопедический словарь
МАГНИЙ — МАГНИЙ, см. магнезия. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
Магний — Mg (лат. Magnesium * a. magnesium; н. Magnesium; ф. magnesium; и. magnesio), хим. элемент II группы периодич. системы Менделеева, ат. н. 12, ат. м. 24,312. Природный M. состоит из смеси стабильных изотопов 24Mg (78,6%), 25Mg (10,11%) и… … Геологическая энциклопедия
МАГНИЙ — МАГНИЙ, магния, мн. нет, муж. (ново лат. magnium) (хим.). Мягкий серебристо белый металл, горящий белым ослепительным пламенем. Группа снята вечером при вспышке магния. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
МАГНИЙ — МАГНИЙ, я, муж. Химический элемент, мягкий лёгкий серебристо белый металл, горящий ярким белым светом. | прил. магниевый, ая, ое. Магниевая вспышка. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
МАГНИЙ — (лат. Magnesium), Mg, хим. элемент II группы периодич. системы элементов; ат. номер 12, ат. масса 24,305. Природный М. содержит 3 стабильных изотопа: 24Mg (78,99%), 25Mg (10,00%) и 26Mg (11,01%). Электронная конфигурация внеш. оболочки 3s2.… … Физическая энциклопедия
МАГНИЙ — серебристо белого цвета легкий металл (уд. вес 1,74), близкий по свойствам к алюминию. Темп pa плавления 650°; сопротивление на разрыв 12 кг/мм2; горит ярким пламенем. В промышленности находит все более широкое распространение при изготовлении… … Технический железнодорожный словарь
Магний (Mg, Magnesium)
История магния
Магний в виде металла был впервые получен Гемфри Дэви в 1808 году. Английский химик проводил процесс электролиза между влажной смесью белой магнезии и оксидом ртути, в результате чего получил сплав ртути с неизвестным металлом (амальгаму). После выгонки ртути Дэви получил новое вещество – порошок металла, который был назван магнием (calorizator). Через два десятилетия, в 1828 году француз А.Бюсси получил чистый металлический магний.
Общая характеристика магния
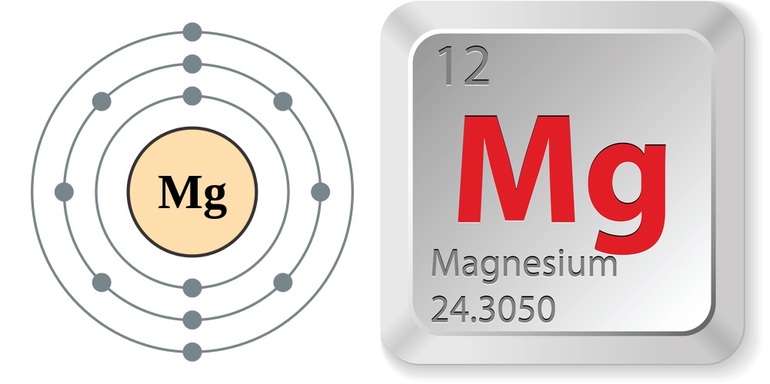
Магний является элементом главной подгруппы II группы III периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 12 и атомную массу 24,305. Принятое обозначение – Mg (от латинского Magnesium).
Нахождение в природе
По количеству содержания в земной коре магний занимает 8-е место среди минеральных веществ, он очень распространён. Природными источниками магния являются морская вода, ископаемые минеральные отложения и рассолы.
Физические и химические свойства
Магний является лёгким и ковким металлом, его цвет – серебристо-белый с явным металлическим блеском. В обычном состоянии покрыт плёнкой оксида магния, которую можно разрушить, нагрев металл до 600-650˚С. Магний сгорает, выделяя ослепительно белое пламя и образуя оксид и нитрид магния.
Суточная потребность в магнии
Суточная потребность в магнии зависит от возраста, пола и физического состояния человека. Для здорового взрослого человека составляет от 400 до 500 мг.
Продукты питания богатые магнием
В продуктах питания содержится различное количество магния, расположим их по мере убывания содержания полезного микроэлемента:
Усвояемость магния
Всасывание органических соединений магния в основном происходит в двенадцатиперстной и толстой кишках, при чрезмерном употреблении кофеина, алкоголя и калия организм теряет значительную часть магния с мочой.
Взаимодействие с другими
Для организма важен баланс между кальцием и магнием, потому что именно эти минералы отвечают за нормальное состояние костной ткани и зубов. В аптечных витаминно-минеральных комплексах количество кальция и магния содержится в оптимальных количествах.
Натрий, магний и фосфор регулируют процессы в нервной системе и отвечают за мышечную активность. Обменные процессы магния в организме происходят с помощью витаминов В6, D, Е и калия.
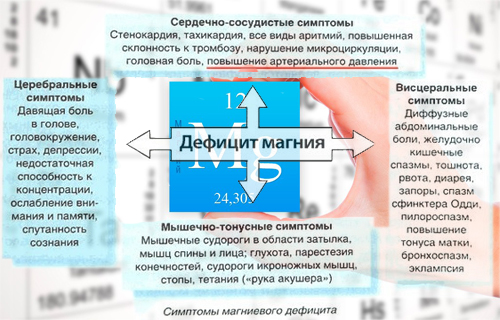
Признаки нехватки магния
Нехватку магния в организме могут вызвать болезни почек, расстройство желудка, приём мочегонных средств и некоторых контрацептивов, чрезмерное увлечение алкоголем и кофеином. Признаками нехватки магния считают бессонницу, раздражительность, головокружения, нарушения сердцебиения и скачки кровяного давления, частые головные боли, чувство усталости, мерцающие точки перед глазами, судороги, мышечные спазмы, выпадение волос.
Признаки избытка магния
Признаками избытка магния считают:
Полезные свойства магния и его влияние на организм
Магний важен для эффективного функционирования нервов и мышц, важен для превращения сахара крови в энергию. Магний поддерживает здоровое состояние зубов, помогает предупредить отложения кальция, камни в почках и желчном пузыре, приносит облегчение при несварении. Организм человека содержит приблизительно 21 г магния.
Магний нормализует деятельность сердечно-сосудистой и эндокринной систем организма, функции головного мозга, оказывает помощь при выведении токсинов и тяжёлых металлов.
Применение магния в жизни
Соединения магния (сплавы) используются в самолётостроении и автомобильном производстве из-за прочности и лёгкости магниевых сплавов. Магний применяется как химический источник тока, в медицине, военном деле, в фотографии.
Магний
Магний / Magnesium (Mg), 12
Ма́гний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg (лат. Magnesium ). Простое вещество магний (CAS-номер: 7439-95-4) — лёгкий, ковкий металл серебристо-белого цвета.
Содержание
История
Происхождение названия
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари называли её горькой солью, а также английской, или эпсомской солью. Минерал эпсомит имеет состав MgSO4 · 7H2O. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
Впервые был выделен в чистом виде сэром Гемфри Дэви в 1808 году дистилляцией ртути из магниевой амальгамы, которую он получил электролизом полужидкой смеси оксида магния и ртути.
Нахождение в природе
Кларк магния 19 кг/т. Это один из самых распространённых элементов земной коры. Большие количества магния находятся в морской воде. Главными видами нахождения магнезиального сырья являются:
Магнезиальные соли встречаются в больших количествах в солевых отложениях самосадочных озёр. Месторождения ископаемых солей карналлита осадочного происхождения известны во многих странах.
Магнезит образуется преимущественно в гидротермальных условиях и относится к среднетемпературным гидротермальным месторождениям. Доломит также является важным магниевым сырьём. Месторождения доломита широко распространены, запасы их огромны. Они ассоциируют с карбонатными толщами и большинство из них имеет докембрийский или пермский возраст. Доломитовые залежи образуются осадочным путём, но могут возникать также при воздействии на известняки гидротермальных растворов, подземных или поверхностных вод.
Типы месторождений
Природные источники магния:
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В расплаве электрохимическому восстановлению подвергается хлорид магния:
Расплавленный металл периодически отбирают из электролизной ванны, а в неё добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много (около 0,1 %) примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс:
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду.
Физические свойства
Магний — металл серебристо-белого цвета с гексагональной решёткой, обладает металлическим блеском; пространственная группа P 63/mmc, параметры решётки a = 0,32029 нм, c = 0,52000 нм, Z = 2. При обычных условиях поверхность магния покрыта прочной защитной плёнкой оксида магния MgO, которая разрушается при нагреве на воздухе до примерно 600 °C, после чего металл сгорает с ослепительно белым пламенем с образованием оксида и нитрида магния Mg3N2. Плотность магния при 20 °C — 1,737 г/см³, температура плавления металла tпл = 651 °C, температура кипения tкип = 1103 °C, теплопроводность при 20 °C — 156 Вт/(м·К).
Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддаётся обработке резанием.
Химические свойства
Смесь порошкового магния с перманганатом калия KMnO4 — взрывчатое вещество
Раскаленный магний реагирует с водой:
Mg + Н2О = MgO + H2↑
Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:
Mg + 2HCl = MgCl2 + H2
При нагревании на воздухе магний сгорает с образованием оксида и небольшого количества нитрида. При этом выделяется большое количество теплоты и световой энергии:
2Mg + О2 = 2MgO
3Mg + N2 = Mg3N2
Магний может гореть даже в углекислом газе:
2Mg + CO2 = 2MgO + C
Горящий магний нельзя тушить водой.
Применение
Применяется для восстановления металлического титана из тетрахлорида титана. Используется для получения лёгких и сверхлёгких сплавов (самолётостроение, производство автомобилей), а также для изготовления осветительных и зажигательных ракет.
Сплавы
Сплавы на основе магния являются важным конструкционным материалом в авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Цены на магний в слитках в 2006 году составили в среднем 3 долл/кг. В 2012 году цены на магний составляют порядка 2,8-2,9 долл./кг.
Химические источники тока
Магний в виде чистого металла, а также его химические соединения (бромид, перхлорат) применяются для производства очень мощных резервных электрических батарей (например, магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др.) и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др.). Химические источники тока на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высоким разрядным напряжением.
Соединения
Гидрид магния — один из наиболее ёмких аккумуляторов водорода, применяемых для его хранения.
Огнеупорные материалы
Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
Перхлорат магния, Mg(ClO4)2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с участием магния.
Фторид магния MgF2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния MgBr2 — в качестве электролита для химических резервных источников тока.
Военное дело
Медицина
Магний является жизненно-важным элементом, который находится во всех тканях организма и необходим для нормального функционирования клеток. Участвует в большинстве реакций обмена веществ, в регуляции передачи нервных импульсов и в сокращении мышц, оказывает спазмолитическое и антиагрегантное действие. Оксид и соли магния традиционно применяется в медицине в кардиологии, неврологии и гастроэнтерологии (аспаркам, сульфат магния, цитрат магния. Наиболее интересным природным ресурсом магния является минерал бишофит). Оказалось, что магниевые эффекты бишофита в первую очередь проявляются при транскутанном (через кожном) применении в лечении патологии опорно-двигательного аппарата. Бишофитотерапия использует биологические эффекты природного магния в лечении и реабилитации широкого круга заболеваний, в первую очередь — позвоночника и суставов, последствий травм, нервной и сердечно-сосудистой систем.
Фотография
Магниевый порошок с окисляющими добавками (нитрат бария, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Аккумуляторы
Магниево-серные батареи — являются одними из самых перспективных, превосходя в теории ёмкость ионо-литиевых, однако, пока эта технологи находится на стадии лабораторных исследований в силу непреодолённости некоторых технических препятствий. [4]
Биологическая роль и токсикология
Магний — один из важных биогенных элементов, в значительных количествах содержится в тканях животных и растений (хлорофиллы). Его биологическая роль сформировалась исторически, в период зарождения и развития протожизни на нашей планете в связи с тем, что морская среда первобытной земли была преимущественно хлоридно-магниевая, в отличие от нынешней — хлоридно-натриевой.
Дефицит магния может проявляться по-разному: бессонница, хроническая усталость, остеопороз, артрит, фибромиалгия, мигрень, мышечные судороги и спазмы, сердечная аритмия, запоры, предменструальный синдром (ПМС). При потливости, частом употреблении слабительных и мочегонных, алкоголя, больших психических и физических нагрузках (в первую очередь при стрессах и у спортсменов) потребность в магнии увеличивается.
Одним из наиболее биологически целесообразных источников магния при транскутанном (чрезкожном) всасывании является минерал бишофит, широко использующийся в целях медицинской реабилитации, физиотерапии и санаторно-курортного лечения. Преимуществом транскутанного применения является высокая биодоступность ионов магния, насыщающего локальные проблемные зоны минуя выделительную систему.
История открытия
Новая эра развития химии началась в XVII веке. В этот период химик из Англии по фамилии Гро совершил открытие, приблизившее учёных к выделению магния. В 1695 г. во время выпаривания эпсомской минеральной воды он получил горькую соль, обладавшую свойством слабительного.
Через несколько лет исследования показали, что взаимодействие вещества с содой и карбонатом калия даёт белый рыхлый порошок. Этот же результат был получен во время прокаливания минерала, который был найден рядом с городом Магнезия в Греции. Из-за этого сходства соль стали назвать белой магнезией.
Непосредственно магний впервые был получен Хэмфри Дэви в 1808 г. Учёный проводил электролиз белой магнезии, в которую он добавил небольшое количество воды и ртутной окиси. Эта реакция привела к образованию амальгамы металлического вещества. Полученный металл после выведения получил название «магний».
Следует отметить, что реактив имел различные примеси. Чистый элемент в 1829 г. вывел французский химик Антуан Александр Брутус Бюсси.
Определение и физическая характеристика
Вещество является представителем II группы периодической системы химических элементов.
Ему можно дать следующую характеристику:
Реагент в компактном состоянии представляет собой блестящий металл серебристо-белого цвета. Под воздействием воздуха он тускнеет, так как на поверхности образуется плёнка окиси.
Горит металлический реагент ослепительным пламенем белого цвета. Скорость, с которой вспыхивает вещество, во много раз превосходит скорость одёргивания руки. Из-за этого физического свойства магния человеку, поджигающему элемент, необходимо соблюдать все положенные правила техники безопасности. В противном случае, он получит серьёзный ожог кожи. Для наблюдения за процессом горения следует использовать тёмные очки или стекло. Без этих мер предосторожности повышает риск получения ожога сетчатки, который приводит к временной слепоте.
Химические свойства
Все стабильные соединения элемента имеют валентность равную двум, а электронная формула магния или схематичное строение его атома имеет вид: 1s2 2s2 2p6 3s2.
Даже при нагревании до 350 °C компактный магний подвергается незначительному окислению, поскольку он покрыт оксидной плёнкой. Горит реагент при температуре от 600 до 650 °C, при этом образуются оксид и нитрит элемента. Нитрит также можно получить, нагрев вещество до 500 °C в азотной среде.
Элемент относится к активным веществам. Кроме того, выделяют следующие химические свойства магния:
Реагент представляет собой сильный восстановитель. Нагретый магний вытесняет некоторые металлы и неметаллы из оксидов и галогенидов. Существует множество металлоорганических соединений вещества, которые делают его одним из важнейших элементов органического синтеза.
Реагент легко создаёт сплавы со многими металлами, а потому на нём основывается производство множества очень важных лёгких материалов.
Нахождение в природе
Земля очень богата магнием. Всего шесть химических реагентов встречаются в природе чаще, чем это вещество. Большая часть элемента находится в мантии планеты, в земной коре его меньше. Чаше всего его обнаруживают в основных породах и граните. И также элемент содержится в различных минералах, образованных магмой.
В основном чистый магний добывают из трёх минералов:
В России самые большие залежи магнезита находятся на Среднем Урале и в Оренбургской области. Карналлит добывается около города Соликамска, следует отметить, что это месторождение самое крупное в мире. Наиболее распространённый минерал доломит встречается в Московской и Ленинградской областях, а также других регионах страны.
В биологической среде планеты соединения магния постоянно перемещаются и изменяются. Лишь малая часть элемента задерживается в круговороте веществ, происходящем на материках, большое количество реагента уносится реками в океан. Несмотря на то что по содержанию в морской воде магний уступает только натрию, непосредственно сама жидкость не имеет насыщения элементом, а его соли в открытом океане не выпадают в осадок.
Вещество в составе различных соединений накапливается в солях, остающихся после того, как из лагун испаряется вода.
Получение в промышленности
В промышленных условиях для получения магния чаще всего применяют электролиз безводного хлорида или обезвоженного карналлита. Процесс проходит следующим образом:
Кроме этого метода, на производстве применяются металлотермический и углетермический способы получения магния. В первом случае брикеты из раскалённого и разложившегося доломита смешивают с восстановителем и нагревают в вакууме при температуре 1300 °C. Полученные в результате магниевые пары образуют конденсат, когда температура опускается до 400−500 °С. Чтобы очистить металл, применяют переплавку под флюсом или в вакууме. Чистый элемент разливают в изложницы.
При использовании второго метода брикеты, состоящие из угля и магниевой окиси, разогревают в электрических печах до 2100 °C. Превратившийся в пар металл отгоняют и конденсируют.
Также вещество добывают из морской воды. Для этого сырьё в очень больших баках смешивают с суспензией гидроксида кальция, который получают, перемалывая морские раковины. В результате происходящей химической реакции образуется особая суспензия, которая после высыхания становится хлоридом магния. После этого продукт подвергают электролитическим процессам.
Кроме морской воды, для выгонки магния может использоваться вода некоторых соленых озер. В Российской Федерации такие озёра находятся в Крыму, Поволжье и других регионах.
Применение вещества
Наибольшее количество металла потребляет металлургия. На его основе создаётся множество сплавов. Часто вещество используют в металлотермических процессах, чтобы получить редкие металлы, а также те, которые трудно восстановить. Применяется реагент для раскисления и десульфурации металлических веществ. Различные порошковые смеси на основе магния используются в качестве осветительных и зажигательных.
Соединения, содержащие реагент, нашли широкое применение в различных сферах жизнедеятельности. К примеру, в медицине, лекарства с магнием позволяют избавить пациентов от спазмов и судорог, успокоить нервы и так далее.
Магний в организмах
Магний содержится во всех растениях и животных. Вещество концентрируется в некоторых морских организмах. Максимальное количество металлического элемента содержится в известковых губках — до 4%.
Входит этот реагент и в состав хлорофилла зелёных растений. В общей сложности на их долю приходится 100 миллиардов тонн вещества. Учёные обнаружили магний во всех компонентах, необходимых клеткам живых организмов для существования. Этот элемент запускает многие ферменты и позволяет хромосомам и коллоидным системам растений сохранять стабильность. Кроме того, реагент поддерживает в клетках тургорное давление. Благодаря магнию растения лучше поглощают и усваивают находящийся в земле фосфор.
Люди и животные получают металлический элемент с пищей. Суточная норма потребления для человека составляет от 0,3 до 0,5 г. У детей и беременных женщин потребность в веществе несколько выше. У здорового человека в крови должно содержаться около 4,3 мг/% магния. В организме основным потребителем реагента является печень, но большая часть поглощённого ею металла постепенно переходит в кости и мышцы.
Переизбыток и недостаток
Магний практически безвреден для организма, хотя некоторым его соединениям и присвоен II класс опасности. В основном же металл в разных видах приносит лишь пользу. А страдают люди, животные и растения чаще всего от недостатка или переизбытка вещества.
Когда металла в организме слишком мало, увеличивается риск развития сахарного диабета, болезней почек и кишечника. У людей, страдающих от недостатка микроэлемента, часто болит голова, начинается бессонница, появляются спазмы мышц, быстро наступает утомление. При отсутствии лечения это может привести к различным более серьёзным заболеваниям, повышается возможность заболеть раком.
Прежде чем приступать к восстановлению уровня вещества в организме, необходимо проконсультироваться с врачом и установить степень потребности в веществе. После сдачи анализов доктор назначит переменный или постоянный на протяжении какого-то времени приём соответствующих лекарственных препаратов, принимать которые следует строго по инструкции.
При переизбытке микроэлемента у людей появляются следующие болезни:
Когда в почве содержится недостаточное количество вещества, у растений начинается мраморность листвы и хлороз. Отсутствие магния в рационе вызывает у крупного рогатого скота травяную тетанию.
Магний относится к жизненно необходимым микроэлементам. Сложно переоценить роль этого вещества в животных и растительных организмах. Его отсутствие в достаточном количестве способно возбудить множество заболеваний.