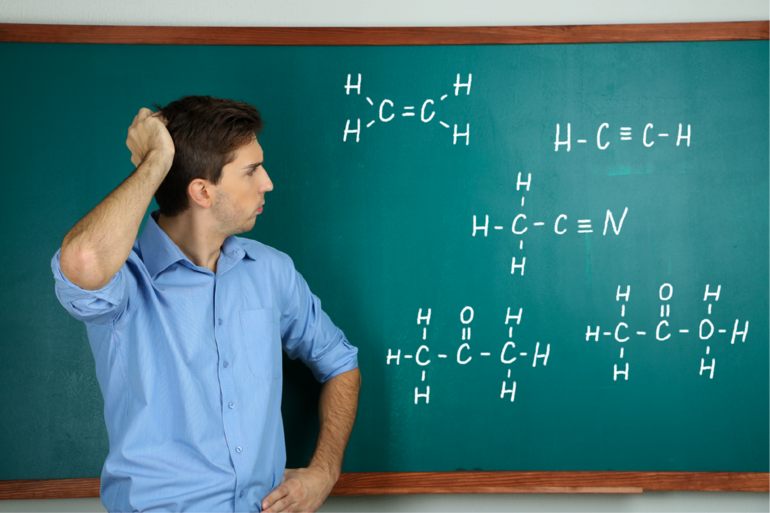
Молярная масса как пишется в физике
Моль, молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12 С:
Таким образом, 1 моль вещества содержит 6,02 • 10 23 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню). Например, в образце вещества содержится 12,04 • 10 23 молекул. Следовательно, количество вещества в этом образце составляет:
где N – число частиц данного вещества;
NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана CH4 определяется следующим образом:
M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02 • 10 23 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе:
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример 
Решение
Молярная масса метана M(CH4) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда:
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
Вычисление ν используется практически в каждой расчетной задаче.
Образцы решения задач
Задача №1. Вычислите массу (г) магния, взятого количеством вещества 0, 5 моль?
M (Mg ) = Ar ( Mg ) = 24 г/моль (из периодической системы)
m ( Mg ) = 24 г/моль · 0,5 моль = 12 г
Задача №2. Вычислите массу (г) 12,04 · 10 23 молекул оксида цинка Zn О ?
n (Zn O )= 12,04 * 10 23 молекул
следовательно, формула для расчёта
M(ZnO) = Ar(Zn) + Ar(O) = 65 + 16 = 81 г / моль
m = 81 г/моль · (12,04 * 10 23 /6.02 · 10 23 1/моль) = 162 г
Задания для закрепления
Заполните таблицу (округляя числа до целых )
Молярная масса
Моля́рная ма́сса вещества — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности. [1]
Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов.
Например, молярная масса воды (H2O) есть MH2O = 2 MH +MO = 2·1+16 = 18 (г/моль).
Стоит отметить, что, например, молярная масса кислорода как элемента = 16 (г/моль), а в газообразном состоянии (O2) = 32 (г/моль).
Молярная масса некоторых веществ
| Вещество | г/моль |
|---|---|
| Азот | 28 |
| Аргон | 40 |
| Водород | 2 |
| Водяные пары | 18 |
| Гелий | 4 |
| Воздух | 29 |
| Кислород | 32 |
| Литий | 6 |
| Неон | 20 |
| Серебро | 108 |
| Молибден | 96 |
| Углекислый газ | 44 |
Примечания
Полезное
Смотреть что такое «Молярная масса» в других словарях:
молярная масса — molio masė statusas T sritis fizika atitikmenys: angl. molar mass vok. molare Masse, f; Molmasse, f rus. мольная масса, f; молярная масса, f pranc. masse molaire, f … Fizikos terminų žodynas
молярная масса — molio masė statusas T sritis Standartizacija ir metrologija apibrėžtis Medžiagos dalelių, kurių skaičius lygus Avogadro konstantai, masė, t. y. masė m, padalyta iš medžiagos kiekio n: M = m/n. atitikmenys: angl. molar mass vok. molare Masse, f;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
молярная масса — molinė masė statusas T sritis chemija apibrėžtis Vieno medžiagos molio masė. atitikmenys: angl. molar mass rus. молярная масса … Chemijos terminų aiškinamasis žodynas
молярная масса — molio masė statusas T sritis Energetika apibrėžtis Medžiagos dalelių, kurių skaičius lygus Avogadro konstantai, masė, t. y. medžiagos masė, padalyta iš medžiagos kiekio. atitikmenys: angl. molar mass vok. molare Masse, f; Molmasse, f rus.… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
МОЛЯРНАЯ МАССА — физ. величина, равная отношению массы к кол ву в ва. Единица М. м. (в СИ) кг/моль. М = m/n, где М М. м. в кг/моль, m масса в ва в кг, п кол во в ва в молях. Числовое значение М. м., выраж. в кг/моль, равно относит. молекулярной массе, делённой на … Большой энциклопедический политехнический словарь
Молярная масса эквивалента — Величина Мэквх, численно равная произведению молярной массы вещества х на фактор эквивалентности и рассчитываемая по формуле Мэквх = Мх × fэквх, где Мх молярная масса вещества х, г; fэквх фактор эквивалентности. Примечание. Величина Мэквх… … Словарь-справочник терминов нормативно-технической документации
Молярная концентрация эквивалента — Величина Сэквх, численно равная частному от деления массовой концентрации вещества х на молярную массу его эквивалента и рассчитываемая по формуле где Стх массовая концентрация вещества х, г; Мэквх молярная масса эквивалента вещества х, г.… … Словарь-справочник терминов нормативно-технической документации
МОЛЯРНАЯ MАCCA — физ. величина, равная отношению массы газа (или др. тела) к количеству вещества, которое в нём содержится; обозначается буквой Μ; М = m/n. где т масса вещества, n количество вещества. Числовое значение М в тысячу раз меньше относительной… … Большая политехническая энциклопедия
Молярная концентрация — Концентрация величина, характеризующая количественный состав раствора. Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л) … Википедия
Молекулярная масса
п.1. Относительная атомная и молекулярная масса
Массы атомов и молекул, из которых состоят вещества, очень малы. Поэтому их чаще измеряют не в килограммах, а используют внесистемную единицу – атомную единицу массы.
Относительную атомную массу проще всего найти, пользуясь таблицей Менделеева.
Например:
\(A_r(\mathrm
\(A_r(\mathrm
\(A_r(\mathrm
\(A_r(\mathrm
На практике при решении учебных задач относительные атомные массы округляют и единицу измерения а.е.м. не пишут.
п.2. Количество вещества. Постоянная Авогадро
Например:
В 5 молях углерода будет содержаться \(N=5\cdot N_A\approx 6,022\cdot 10^<23>\approx 3,01\cdot 10^<24>\) атомов углерода. Причём, всё равно, будут ли эти атомы углерода образовывать уголь, графит или алмаз.
Аналогично, в 5 молях воды будет \(N=5\cdot N_A\approx 3,01\cdot 10^<24>\) молекул воды. Причём, независимо от того, в каком агрегатном состоянии находится вода: в виде пара, жидкости или льда.
Т.е., «количество вещества» всегда говорит нам о «количестве частиц», независимо от других параметров.
п.3. Молярная масса
Например:
Найдем молярную массу этилового спирта \begin
п.4. Молярный объем
Это свойство газов часто используется при изучении различных веществ и явлений в физике и химии.
п.5. Задачи
Задача 1. Масса кристалла серы равна 16 г. Сколько молекул серы \(\mathrm
Задача 2*. В кислородном генераторе на космическом корабле было получено 1,6 кг кислорода \(\mathrm
Молярная, молекулярная и атомная массы
Молярная масса (для обозначения в формулах используется буква М) — характеристика вещества, отражающая количество граммов, которое содержится в одном его моле. Измеряется эта величина в г/моль. Интересно, что в Международной системе единиц указано, что параметр должен выражаться в кг/моль. Но г/моль является более удобной единицей измерения, поэтому именно она обычно используется на практике.
За единицу отсчёта атом элемента был взят за нейтральность и широкую распространённость в природе его изотопа. Но учёные не сразу ориентировались на углерод. Сначала были попытки создания водородной шкалы исходя из того, что водород наиболее лёгкий элемент, потом — кислородной. Но когда оказалось, что в природе это вещество является смесью изотопов с массой от 16 до 18, единица стала неприемлемой, поэтому её заменили углеродной.
С массой атомной молярная тоже может быть одинаковой, если простое вещество состоит из одного атома. Для каждого элемента её легко определить по таблице Менделеева — вместе с порядковым номером она указана в ячейке.
Определение атомной массы для каждого химического элемента было непростой задачей. Для этого учёные взвешивали все существующие в земной коре изотопы и вычисляли их среднее значение с учётом процентной распространённости в природе. Что касается синтетических элементов, то их определяли по наиболее стабильному изотопу.
Определение в сложных веществах
Для простых веществ, состоящих из одного атома, параметр считается так же, как для элемента. Молярная масса углерода всегда равна 12. Этот показатель справедлив и для натрия. Как простое вещество, этот мягкий серебристо-белый металл содержит в себе 23 г/моль, а купрум (так на латинском обозначается медь) — 63,5 г/моль. Газ также может состоять из одного элемента, например, гелий, искомый параметр которого 4 г/моль.
Но существуют и газы, которые образованы двумя молекулами (водород, азот, кислород, хлор, фтор и другие) или тремя (озон). Для них нужно не забывать умножать атомную массу на число молекул. Для сложных веществ параметр можно рассчитать аналогичным образом:
Исходя из этого, формулу молярной массы можно вывести следующим образом: М (XxYy) = М (Хx) + М (Yy) = x * М (Х) + y * М (Y). Таким образом, вычислить этот параметр для любого органического или неорганического вещества совсем несложно.
Главное, иметь под рукой таблицу Менделеева, тогда никакие онлайн-калькуляторы не потребуются.
Расчёты в смеси
Задачу можно усложнить, попробовав посчитать этот показатель в смеси, где в разных пропорциях входят различные соединения. Идеальным примером для этого является воздух. В нем можно выделить следующие составляющие:
Искомый параметр будет вычисляться следующим образом: 0,23*32+0,76*28+0,01*40. Результат равен 29,04 г/моль (можно округлить до 29).
Конечно, в воздухе содержатся и другие вещества (углекислый и инертные газы, водород и т. д. ), но их масса составляет менее десятой процента, поэтому для простоты их допускается не учитывать.
Применение в химических задачах
С этим параметром связано множество других формул. Зная его, можно вычислить количество вещества (n). Для этого нужно разделить его фактическую массу на молярную (n = m / M). Чтобы узнать число частиц в нём (N), полученное значение n нужно умножить на константу Авогадро (N A). Получается 6,02*10 23 (N = n * N A) Именно столько структурных единиц содержится в одном моле любого соединения или простого вещества. С другой стороны, зная показатель n, можно найти m по формуле n * M. В итоге получается ещё одна формула: M = m / n.
В учебнике может ждать такая задача: «Найдите массу 0,75 моль азота N2». Начать нужно с нахождения массы одного атома азота. По таблице Менделеева она равняется 14 г. Молекула состоит из двух атомов, следовательно, масса одного моля азота как простого вещества будет иметь значение 28, а масса 0,75 моль — 21 грамм.
Не менее распространена в мире химии физическая величина под названием молярный объём (V m). Её получают как отношение молярной массы к плотности вещества (M /ρ). Размерность этой величины — м 3 /моль или л/моль (кубический метр или литр на моль). В стандартных условиях для идеального газа её значение принимается за 22,41. Конечно, в реальных условиях наблюдаются отклонения от этого значения, но для решения задач ими можно пренебречь, поскольку они минимальны.
Величину для газа можно найти по формуле M = V m * ρ. Но более правильным будет вычислять её с учётом всех условий по уравнению Менделеева — Клайперона. Оно выглядит следующим образом: p * V = m * R * T / M, где p — давление, V — объём, m — масса, R — константа, равная 8,314, T — температура, M — молярная масса.
Иногда требуется найти параметр для эквивалента (MЭ). Он будет напрямую зависеть от класса соединения и его формулы. Для кислот эквивалентное число (z) соответствует количеству атомов водорода в составе (один для HCl, два для H2SO4, три для H3PO4), для щелочей — групп OH (одна для KOH, две для Ca (OH)2). Для веществ, эквивалент которых равен единице, результат не меняется, для всех остальных МЭ находится как М/ z. Исходя из этого:
Химия может быть понятной и доступной только для тех, кто последовательно подходит к её изучению и уделяет внимание каждой теме, читая учебники или просматривая видеоуроки. Но старания стоят того, ведь эта наука невероятно важная и интересная, она может дать объяснение составу и строению любого объекта окружающей среды, а на основе этих данных можно узнать практически всё о его свойствах и научиться волшебству превращения одних веществ в другие.
Молярная масса

Всего получено оценок: 740.
Всего получено оценок: 740.
Атомы и молекулы – мельчайшие частицы вещества, поэтому в качестве единицы измерения можно выбрать массу одного из атомов и выражать массы других атомов в соотношении с выбранной. Так что же такое молярная масса, и какова ее размерность?
Что такое молярная масса?
Основоположником теории атомных масс был ученый Дальтон, который составил таблицу атомных масс и принял массу атома водорода за единицу.
Молярная масса – это масса одного моля вещества. Моль, в свою очередь, – количество вещества, в котором содержится определенное количество мельчайших частиц, которые участвуют в химических процессах. Количество молекул, содержащихся в одном моле, называют числом Авогадро. Эта величина является постоянной и не изменяется.
Таким образом, молярная масса вещества – это масса одного моля, в котором находится 6,02*10^23 элементарных частиц.
Число Авогадро получило свое название в честь итальянского ученого Амедео Авагадро, который доказал, что число молекул в одинаковых объемах газов всегда одинаково
Молярная масса в Международной системе СИ измеряется в кг/моль, хотя обычно эту величину выражают в грамм/моль. Эта величина обозначается английской буквой M, а формула молярной массы выглядит следующим образом:
где m – масса вещества, а v – количество вещества.

Как найти молярную массу вещества?
Вычислить молярную массу того или иного вещества поможет таблица Д. И. Менделеева. Возьмем любое вещество, например, серную кислоту.Ее формула выглядит следующим образом: H2 SO4. Теперь обратимся к таблице и посмотрим, какова атомная масса каждого из входящих в состав кислоты элементов. Серная кислота состоит из трех элементов – водород, сера, кислород. Атомная масса этих элементов соответственно – 1, 32, 16.
Молярная масса вещества численно равна относительной молекулярной массе, если структурными единицами вещества являются молекулы. Молярная масса вещества также может быть равна относительной атомной массе, если структурными единицами вещества являются атомы.
Вплоть до 1961 года за атомную единицу массы принимали атом кислорода, но не целый атом а его 1/16 часть. При этом химическая и физическая единицы массы не были одинаковыми. Химическая была на 0,03% больше, чем физическая.
В настоящее время в физике и химии принята единая система измерения. В качестве стандартной е.а.м. выбрана 1/12 часть массы атома углерода.

Молярная масса любого газа или пара измеряется очень легко. Достаточно использовать контроль. Один и тот же объем газообразного вещества равен по количеству вещества другому при одинаковой температуре. Известным способом измерения объема пара является определение количество вытесненного воздуха. Такой процесс осуществляется с использованием бокового отвода, ведущего к измерительному устройству.
Понятие молярной массы является очень важным для химии. Ее расчет необходим для создания полимерных комплексов и множества других реакций. В фармацевтике с помощью молярной массы определяют концентрацию данного вещества в субстанции. Также молярная масса важна при провидении биохимических исследований (обменный процесс в элементе).
В наше время благодаря развитию науки известны молекулярные массы практически всех составляющих крови, в том числе и гемоглобина.
Что мы узнали?
В 8 классе по химии важной темой является «молярная масса вещества». Молярная масса – важное физическое и химическое понятие. Молярная масса — характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. измеряется она в кг/моль или грамм/моль.