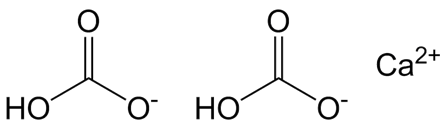
Гидрокарбонат кальция
| Гидрокарбонат кальция | |
 | |
| Общие | |
|---|---|
| Традиционные названия | Гидрокарбонат кальция |
| Химическая формула | Ca(HCO3)2 |
| Физические свойства | |
| Молярная масса | 162.1124 г/моль |
| Термические свойства | |
Гидрокарбонат кальция — соль угольной кислоты. Химическая формула — 
Содержание
Свойства
Как известно, все гидрокарбонаты в воде растворимы. Гидрокарбонат кальция обусловливает временную жёсткость воды. В организме гидрокарбонаты выполняют важную физиологическую роль — регулируют постоянство реакций в крови. При нагревании раствора гидрокарбоната кальция он разлагается:
Таким образом, реакция разложения гидрокарбоната кальция является обратной реакцией его образования. Именно это уравнение является основным, по которому образуется накипь в чайниках и водонагревательных системах, так как в исходной воде почти всегда содержится гидрокарбонат кальция, который более растворим, чем карбонат.
Применение
Получение
Гидрокарбонат кальция получают взаимодействием карбоната кальция с углекислым газом и водой:
См. также
Полезное
Смотреть что такое «Гидрокарбонат кальция» в других словарях:
ГИДРОКАРБОНАТ КАЛЬЦИЯ — (Са(НСО3)2), соль, присутствие которой обуславливает ЖЕСТКОСТЬ ВОДЫ. Это устраняется, если воду нагреть, нерастворимый гидрокарбонат кальция осаждается и образует налет внутри водопроводных труб или на стенках посуды. Тот же процесс происходит,… … Научно-технический энциклопедический словарь
Кальция гидроксид — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Кальция гидроокись — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Гидрокарбонат калия — Общие Систематическое наименование Гидрокарбонат калия Традиционные названия Углекислый калий, кислый; бикарбонат калия Химическая формула KHCO3 Физические свойства … Википедия
Гидрокарбонат натрия — Гидрокарбонат натрия … Википедия
кальция гидрокарбонат — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
кальция бикарбонат — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
Гидроксид кальция — Общие … Википедия
Карбонат кальция — Карбонат кальция … Википедия
Хлорид кальция — Общие … Википедия
ГИДРОКАРБОНАТ КАЛЬЦИЯ
Смотреть что такое «ГИДРОКАРБОНАТ КАЛЬЦИЯ» в других словарях:
Гидрокарбонат кальция — Общие … Википедия
Кальция гидроксид — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Кальция гидроокись — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Гидрокарбонат калия — Общие Систематическое наименование Гидрокарбонат калия Традиционные названия Углекислый калий, кислый; бикарбонат калия Химическая формула KHCO3 Физические свойства … Википедия
Гидрокарбонат натрия — Гидрокарбонат натрия … Википедия
кальция гидрокарбонат — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
кальция бикарбонат — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
Гидроксид кальция — Общие … Википедия
Карбонат кальция — Карбонат кальция … Википедия
Хлорид кальция — Общие … Википедия
Формула гидрокарбоната кальция
Определение и формула гидрокарбоната кальция
При нагревании до температуры 60 o C и выше разлагается и переходит в нерастворимый в воде карбонат кальция.
Химическая формула гидрокарбоната кальция
Химическая формула гидрокарбоната кальция имеет вид Ca(HCO3)2. Она показывает, что в состав данной молекулы входят два атома углерода (Ar = 12 а.е.м.), два атома водорода (Ar = 1 а.е.м.), один атома кальция (Ar = 40 а.е.м.) и шесть атомов кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу гидрокарбоната кальция:
Mr(Ca(HCO3)2) = 40 + 2×1 +2×12 + 6×16 = 40 + 2 + 24 + 96 = 162.
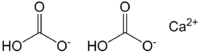
Графическая (структурная) формула гидрокарбоната кальция
Структурная (графическая) формула является более наглядной, она отражает то, как атомы связаны между собой внутри молекулы гидрокарбоната кальция (рис. 1).
Рис. 1. Графическая формула гидрокарбоната кальция.
Ионная формула
Гидрокарбонат кальция – сильный электролит. В водном растворе под действием электрического тока он диссоциирует на ионы согласно следующему уравнению:
Примеры решения задач
| Задание | Элементарный состав вещества следующий: массовая доля элемента железа 0,7241 (или 72,41%), массовая доля кислорода 0,2759 (или 27,59%). Выведите химическую формулу. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим число атомов железа в молекуле через «х», число атомов кислорода через «у».
Найдем соответствующие относительные атомные массы элементов железа и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
x:y = 72,41/56 : 27,59/16;
Наименьшее число примем за единицу (т.е. все числа разделим на наименьшее число 1,29):
Следовательно, простейшая формула соединения железа с кислородом имеет вид Fe2O3.
| Задание | Найдите химическую формулу вещества, в состав которого входит 9 массовых частей алюминия и 8 массовых частей кислорода. |
| Решение | Для того, чтобы узнать, в каких отношениях находятся химические элементы в составе молекулы необходимо найти их количество вещества. Известно, что для нахождения количества вещества следует использовать формулу: |
Найдем молярные массы алюминия и кислорода (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Известно, что M = Mr, значит M(Al)= 27 г/моль, а М(O) = 16 г/моль.
Тогда, количество вещества этих элементов равно:
n (Al) = 9 / 27 = 0,33 моль.
n (O) = 8 / 16 = 0,5 моль.
Найдем мольное отношение:
n(Al) :n(O) = 0,33 : 0,5= 1 : 1,5 = 2 : 3,
т.е. формула соединения алюминия с кислородом имеет вид Al2O3.
Универсальный индекс насыщения воды карбонатом кальция
В статье представлена методика расчёта значения рН воды, соответствующего состоянию насыщения воды по карбонату кальция. Методика основана на использовании значения произведения растворимости карбоната кальция и константы диссоциации угольной кислоты по второй ступени.
Диоксид углерода содержится в воде в следующих состояниях: адсорбированного диоксида углерода, углекислоты, бикарбоната и карбоната. Все формы диоксида углерода при неизменном состоянии окружающей среды находятся в так называемом «углекислотном равновесии». Изменение углекислотного равновесия воды приводит к тому, что вода становится склонной либо к выпадению карбонатов, либо к углекислотной коррозии.
Если деионизированную воду, содержащую твёрдый карбонат кальция, начать насыщать диоксидом углерода, то будет происходить химическая реакция:
То есть диоксид углерода сначала будет адсорбироваться водой. Затем диоксид углерода диссоциируется в воде с образованием катиона водорода и аниона бикарбоната. Вода приобретает кислую реакцию. В результате начинается растворение твёрдого карбоната кальция с образованием растворённого бикарбоната кальция. Если из воды начать отгон диоксида углерода, то ион водорода при бикарбонате свяжется в воду, и начнёт образовываться обратно твёрдый карбонат кальция. Если вода находится в состоянии углекислотного равновесия, тогда говорят о том, что при определённой концентрации адсорбированного диоксида углерода в воде существует определённая концентрация бикарбоната кальция. При этом состоянии вода не склонна к выделению твёрдой фазы карбоната кальция, и все катионы водорода, образованные в результате диссоциации углекислого газа, участвуют в уравнении реакции (1).
То есть, если возникают условия для протекания коррозии с водородным деполяризатором, это сразу приводит к нарушению углекислотного равновесия. В результате начинает выделяться твёрдая фаза карбоната кальция, что значительно ингибирует скорость протекания коррозии.
справа налево, то должен образовываться твёрдый карбонат кальция. Тем не менее, в воде наблюдаются довольно малые концентрации растворённого карбоната кальция. Концентрации кальция и карбоната в данном случае определяются при помощи произведения растворимости карбоната кальция ПРCaCO3.
Внимание : корректное написание уравнений и формул приводится только в печатной версии журнала СОК и его PDF-версии. Подписаться или скачать журнал можно здесь.
С учётом того, что образуется один катион кальция и один анион карбоната, можно записать:
ПРCaCO3 = CCa fCaCCO3 fCO3,
где ССа и СCO3 — мольные концентрации кальция и карбоната, моль/л; fСа и fCO3 — коэффициенты активности кальция и карбоната.
Так как кальций и карбонат — двухвалентные ионы, с определённым допущением можно записать, что fСа = fCO3.
ПРCaCO3 = CCaCCO3 f 2 CO3. (2)
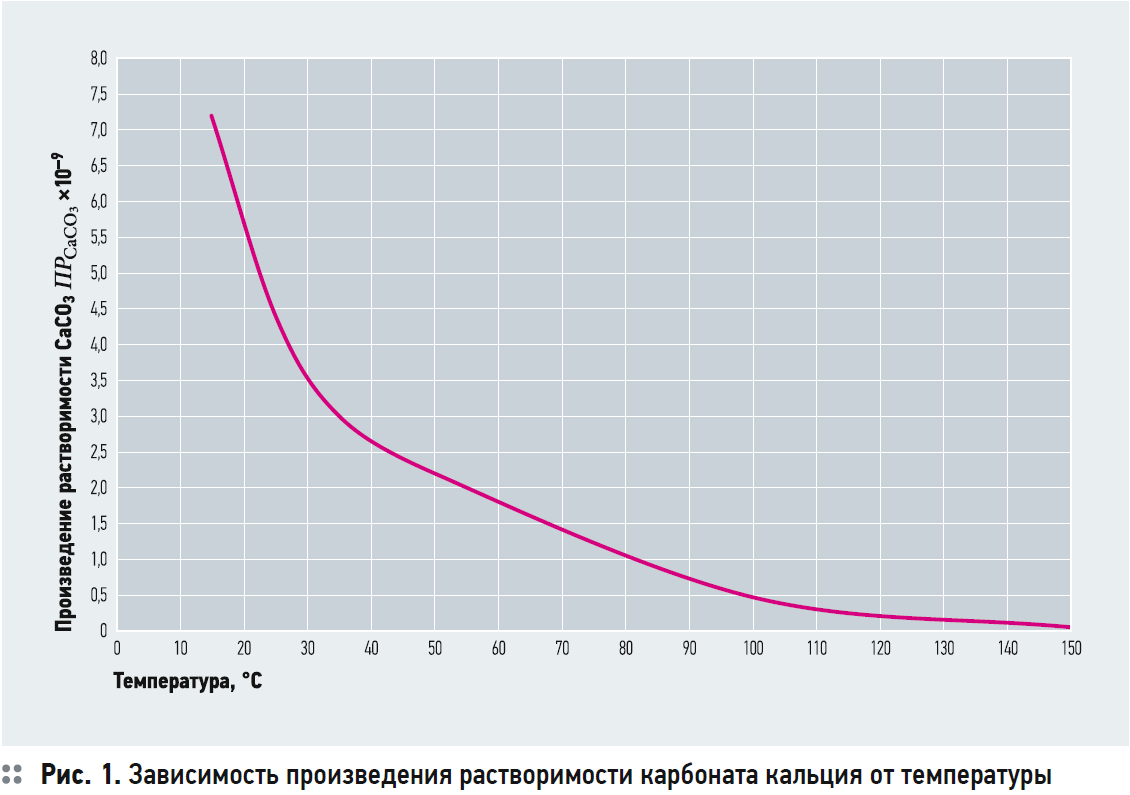
Значения произведения растворимости представлены в литературе для температур воды 25, 50, 100 и 150°C.
На рис. 1 представлена зависимость значения ПР от температуры. Для температур 25, 50, 100 и 150°C данные взяты из [1]. Остальные значения получены автором самостоятельно с использованием индекса Ланжелье.
Об этом будет сказано ниже.
Таким образом, для того, чтобы определить склонность воды к выделению осадка или к коррозии, достаточно знать значения концентраций кальция и карбоната. Но, так как определить карбонатион в воде при рН менее 8,37 невозможно, в соответствии с существующей методикой (ГОСТ 31957–2012. «Вода. Методы определения щёлочности и массовой концентрации карбонатов и гидрокарбонатов») для определения склонности воды к отложению карбоната кальция используют индекс насыщения Ланжелье.
Индекс насыщения Ланжелье — это разность между текущим значением рН воды и значением рНS, соответствующим состоянию насыщения этой воды по карбонату кальция (начало выделения твёрдой фазы карбоната кальция). В этом случае, определив по номограмме значение рНS и измерив текущее значение рН воды, можно определить склонность воды к отложению карбоната кальция или к углекислотной коррозии.
Соответственно, возникает вопрос: «Как определить рНS без использования эмпирического подхода»?
Для расчёта значения рНS воды, соответствующего состоянию насыщения по карбонату кальция, рассмотрим процесс диссоциации углекислоты в воде по второй стадии (диссоциация бикарбоната).
Константу равновесия (диссоциации) данной химической реакции можно записать в виде:
Данное уравнение можно записать следующим образом, вынося ион водорода в левую часть:
Затем записать в виде десятичного логарифма, взятого с обеих сторон:
Очевидно, что При этом Константа диссоциации или константа равновесия реакции растворения углекислоты в воде по второй стадии К2 = 4,69?10–11.
Уравнение (4) есть уравнение Хендерсона-Хассельбальха для диссоциации углекислоты по второй стадии.
Более подробная информация о существовании и взаимодействии различных форм диоксида углерода в воде представлена в статье [2].
При помощи уравнения (4) можно рассчитать значение рНS воды в состоянии насыщения по карбонату кальция. Для этого необходимо определить значение карбонат-иона (СО3), при котором в воде достигается значение произведения растворимости карбоната кальция ПРCaCO3 с учётом существующего ионного состава воды.
Значение карбонат-иона можно определить исходя из произведения растворимости карбоната кальция. То есть мы определим концентрацию карбонат-иона, при котором вода данного химического состава находится в состоянии насыщения. Исходя из (2) получаем:
Таким образом, зная значения концентраций кальция и бикарбоната данной воды из химических анализов и рассчитав по (5) значение концентрации карбоната, мы можем определить при помощи (4) значение рНS.
Для учёта влияния концентрации всех ионов, растворённых в воде, необходимо в уравнении (4) вместо концентраций использовать активности карбоната и бикарбоната. Таким образом, уравнение (4) запишется следующим образом:
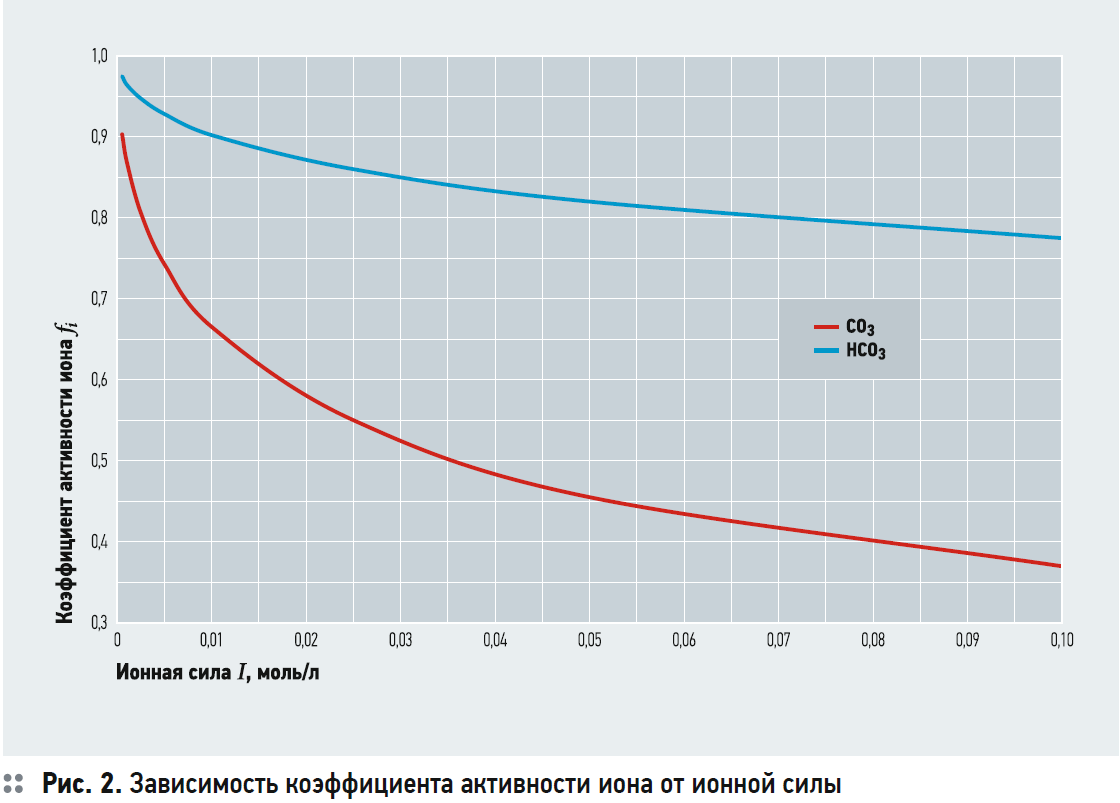
Коэффициенты активности зависят от ионной силы раствора и определяются по уравнению:
где fi — коэффициент активности иона; zi — заряд иона; I — ионная сила раствора, моль/л.
Ионная сила раствора учитывает влияние интенсивности электромагнитного поля, образованного ионами, на физико-химическое взаимодействие ионов, и равна полусумме значений произведения концентрации ионов на квадрат их зарядов:
На рис. 2 представлен график зависимости коэффициента активности иона от ионной силы раствора, построенный с использованием уравнения (7).
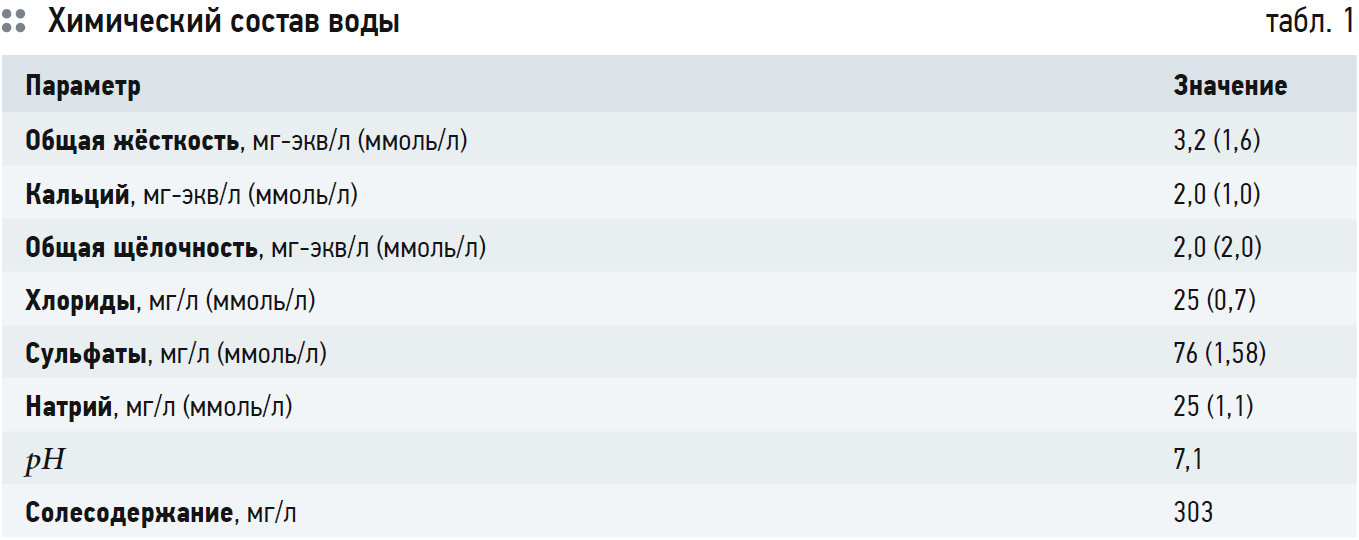
Для примера рассчитаем рНS с использованием ПРCaCO3 для водопроводной воды города Саратова для температуры 25°C. Источником водоснабжения является подготовленная вода из реки Волга.
Состав воды представлен в табл. 1. Ионная сила воды равна: I = 0,5?(Ca · 22 + Mg · 22 + Na · 1 + Cl · 1 + + SO4 · 22) = 1?4 + 0,6?4 + 1,1?1 + + 0,7?1 + 1,58?4 = 0,00726 моль/л. В соответствии с рис. 2: fCa = fCO3 = 0,7; fHCO3 = 0,915; ПРCaCO3 = 4,4?10–9 при t = 25°C. Тогда или СО3 = 0,00898 ммоль/л. В соответствии с уравнением (6) получаем выражение:
Значение рНS получилось на 0,76 больше, чем реально измеренный рН воды. Это значит, что вода склонна к протеканию коррозии с водородным деполяризатором (углекислотная коррозия в данном случае). Что и постоянно наблюдается.
Значение рНS, рассчитанное в процессе определения индекса Ланжелье по программе ROSA 9.0 для данных табл. 1, равно 7,86, то есть полностью совпадает со значением рНS, рассчитанным по предлагаемой методике.
Значение рНS, рассчитанное по номограмме, представленной в [3], равно 7,8.
Можно сказать, что в данном случае значение рНS, рассчитанное по предлагаемой методике, полностью соответствует значению рНS, полученному в результате расчёта индекса Ланжелье.
Для проверки автором был произведён расчёт рНS по данной методике и по расчёту индекса Ланжелье с использованием программы ROSA 9.0, а также с использованием номограммы, представленной в [3].
Результаты расчётов представлены в табл. 2, содержащей следующие данные.
Для каждой методики произведён расчёт значения рНS для трёх температур воды: 15, 25 и 35°C.
Результаты расчёта, представленные в табл. 1, охватывают довольно большой диапазон концентраций бикарбоната кальция и общего солесодержания.
В расчёте значения рНS по уравнению (6) использовались допущения:
1. Коэффициенты активности для кальция и карбоната принимаются одинаковыми. Также не учитывается влияние температуры на коэффициент активность ионов в связи с её незначительным влиянием.
2. Данные для ПРCaCO3 взяты из [1] для температур 25, 50, 150 и 200°C. Значения ПР для 15°C и 35°C получены автором из расчёта того, что для широкого диапазона температур значения рНS, рассчитанные по предлагаемой методике и по ROSA 9.0, имели хорошую сходимость. В этом случае были определены следующие значения: ПРCaCO3 = 7,2?10–9 при t = 15°C; ПРCaCO3 = 4,4?10–9 при t = 25°C; ПРCaCO3 = 3,0?10–9 при t = 35°C.
3. Расчёт значения рНS при использовании номограммы [3] (третий столбец) ограничен солесодержанием воды в 15 г/л и НСО3 — не более 10 ммоль/л.
При использовании значений произведений растворимости по рис. 1 значения рНS практически совпадают для всех трёх рассматриваемых методик во всём рассматриваемом диапазоне температур и солесодержания. Расхождение составляет менее 0,1 ед. рН.
Также необходимо отметить, что при ионной силе I > 0,04 (солесодержание около 2,2 г/л) значения рНS, посчитанные по предлагаемой методике и в ROSA для индекса Ланжелье и индекса Стиффа и Девиса, имеют небольшое различие (строка 8).
При ионной силе более 0,1 (солесодержание около 7 г/л) значения рНS по индексу Ланжелье, посчитанные в ROSA, начинают давать очевидно неверные значения, но при этом значения рНS по индексу Стиффа и Девиса, посчитанные также в ROSA, практически полностью соответствуют значениям рНS, подсчитанным по предлагаемой методике (строка 9).
Можно сказать, что индекс Ланжелье можно использовать в расчётах при солесодержании воды до 4,0–5,0 г/л. Данное значение солесодержания — это своего рода граница перехода от индекса Ланжелье к индексу Стиффа и Девиса.
Для воды с солесодержанием около 30 г/л (I > 0,5) (строки 3, 6 и 10) значения рНS по предлагаемой методике соотносятся со значением рНS для индекса Стиффа и Девиса с расхождением менее 0,04 ед. рН. Так же, как с индексом Ланжелье при малом солесодержании.
Подводя итог, следует отметить, что использование предлагаемой методики для расчёта значения рНS, которое соответствует состоянию насыщения воды по карбонату кальция, имеет относительно простой и понятный смысл. Расчёт довольно прост и понятен. Для расчёта только необходимо определить значение ПРCaCO3 в зависимости от температуры воды по рис. 1, а также значения коэффициентов активности ионов кальция, карбоната и бикарбоната в зависимости от ионной силы раствора по рис. 1.
Данную методику расчёта значения рН воды, насыщенной по карбонату кальция, можно назвать универсальной, так как полученные результаты представляются достаточно достоверными во всём диапазоне солесодержания (пресных, солоноватых и солёных вод). При этом другие индексы работают только в определённом диапазоне солесодержания воды.
Структура бикарбоната кальция, свойства, риски и использование
бикарбонат кальция неорганическая соль с химической формулой Ca (HCO)3)2. Это происходит в природе из карбоната кальция, присутствующего в известняковых породах и минералах, таких как кальцит.
Бикарбонат кальция более растворим в воде, чем карбонат кальция. Эта характеристика позволила сформировать карстовые системы в известняковых породах и в структурировании пещер..
Подземные воды, которые проходят через трещины, становятся насыщенными в результате вытеснения углекислого газа (СО2). Эти воды разрушают известняковые породы, выделяя карбонат кальция (СаСО3) который будет образовывать бикарбонат кальция в соответствии со следующей реакцией:
Впоследствии, когда насыщение диоксида углерода в воде уменьшается, происходит обратная реакция, то есть превращение бикарбоната кальция в карбонат кальция:
Карбонат кальция плохо растворим в воде, поэтому его осаждение происходит в виде твердого вещества. Вышеуказанная реакция очень важна при образовании сталактитов, сталагмитов и других образований в пещерах..
Эти скальные структуры сформированы из капель воды, которые падают с потолка пещер (верхнее изображение). CaCO3 присутствующие в каплях воды кристаллизуются с образованием упомянутых структур.
Тот факт, что бикарбонат кальция не обнаружен в твердом состоянии, затруднил его использование, и найдено несколько примеров. Кроме того, трудно найти информацию о его токсических эффектах. Имеется сообщение о совокупности побочных эффектов его применения в качестве средства профилактики остеопороза..
структура
Водные растворы
Ca (HCO)3)2 Он не может образовывать кристаллические твердые вещества, и он действительно состоит из водных растворов этой соли. В них ионы не одни, как на изображении, а окружены молекулами H.2О.
Как они взаимодействуют? Каждый ион окружен сферой гидратации, которая будет зависеть от металла, полярности и структуры растворенных частиц.
Гипотетическое твердое тело
Пока что размеры и заряды ионов в Са (HCO)3)2, ни присутствие воды, объясните, почему не существует твердого соединения; то есть чистые кристаллы, которые можно охарактеризовать с помощью рентгеновской кристаллографии. Ca (HCO)3)2 это не что иное, как присутствующие в воде ионы, из которых продолжают расти кавернозные образования.
Затем их можно сгруппировать в белое кристаллическое твердое вещество со стехиометрическими пропорциями 2: 1 (2HCO3/ 1Ca). Там нет никаких исследований о его структуре, но это можно сравнить с NaHCO3 (для бикарбоната магния, Mg (HCO)3)2, не существует как твердое вещество), или с CaCO3.
Стабильность: NaHCO3 против Ca (HCO)3)2
На самом деле, Ca (HCO)3)2(aq) нуждается в воде, чтобы испариться так, чтобы ее ионы могли быть сгруппированы в кристалле; но кристаллическая решетка этого не достаточно сильна, чтобы сделать это при комнатной температуре. Когда вода нагревается, происходит реакция разложения (уравнение выше).
Причина, почему Ca (HCO)3)2 он не кристаллизуется (теоретически), это происходит из-за разницы ионных радиусов или размеров его ионов, которые не могут образовывать стабильный кристалл до его разложения.
Ca (HCO)3)2 против CaCO3
Если с другой стороны, H был добавлен + к кристаллическим структурам CaCO3, они бы резко изменили свои физические свойства. Возможно, его точки плавления заметно падают, и даже морфология кристаллов в конечном итоге изменяется.
Стоит ли пытаться синтезировать Са (HCO)3)2 Твердая? Трудности могут превзойти ожидания, и соль с низкой структурной стабильностью может не дать существенных дополнительных преимуществ в любом применении, где другие соли уже используются..
Физико-химические свойства
Химическая формула
Молекулярный вес
Физическое состояние
Он не появляется в твердом состоянии. Он находится в водном растворе и пытается превратить его в твердое вещество путем испарения воды, но не работает, поскольку он превращается в карбонат кальция..
Растворимость в воде
16,1 г / 100 мл при 0 ° С; 16,6 г / 100 мл при 20 ° С и 18,4 г / 100 мл при 100 ° С. Эти значения свидетельствуют о высоком сродстве молекул воды к ионам Са (HCO)3)2, как объяснено в предыдущем разделе. Между тем, только 15 мг CaCO3 они растворяются в литре воды, что отражает их сильное электростатическое взаимодействие.
Потому что Ca (HCO)3)2 он не может образовывать твердое вещество, его растворимость не может быть определена экспериментально. Однако, учитывая условия, созданные СО2 при растворении в воде, окружающей известняк, можно рассчитать массу кальция, растворенного при температуре Т; масса, которая была бы равна концентрации Ca (HCO)3)2.
При разных температурах растворенная масса увеличивается, как показано значениями при 0, 20 и 100 ° С. Итак, согласно этим экспериментам, сколько Ca (HCO) определяется3)2 растворяется в непосредственной близости от CaCO3 в водной среде, газифицированной СО2. Как только СО сбежит2 газообразный, СаСО3 будет выпадать в осадок, но не Ca (HCO3)2.
Точка плавления и кипения
Кристаллическая сеть Ca (HCO)3)2 намного слабее, чем CaCO3. Если его можно получить в твердом состоянии и измерить температуру, при которой он плавится внутри фузиометра, он наверняка получит значение значительно ниже 899ºC. Аналогичным образом, то же самое можно ожидать при определении точки кипения..
Точка сгорания
риски
Если соединение образовало твердое вещество, хотя оно может физически отличаться от СаСО3, его токсические эффекты не могут выходить за рамки простого дискомфорта и резекции после физического контакта или вдыхания.
приложений
-Растворы бикарбоната кальция долгое время использовались для мытья старых бумаг, особенно произведений искусства или исторически важных документов..
-Использование растворов бикарбоната полезно не только потому, что они нейтрализуют кислоты в бумаге, но и обеспечивают щелочной запас карбоната кальция. Это последнее соединение обеспечивает защиту от будущих повреждений на бумаге.
-Как и другие бикарбонаты, он используется в химических дрожжах и в составах шипучих таблеток или порошков. Кроме того, бикарбонат кальция используется в качестве пищевой добавки (водные растворы этой соли).
-Растворы бикарбоната используются для профилактики остеопороза. Однако вторичные эффекты, такие как гиперкальциемия, метаболический алкалоз и почечная недостаточность, наблюдались в одном случае..
-Бикарбонат кальция вводят, иногда, внутривенно, чтобы исправить депрессивное влияние гипокалиемии на функцию сердца.
-И, наконец, он обеспечивает организм кальцием, который является медиатором сокращения мышц, в то же время он корректирует ацидоз, который может возникнуть в условиях гипокалиемии..