неметалл
Смотреть что такое «неметалл» в других словарях:
НЕМЕТАЛЛ — НЕМЕТАЛЛ, а, муж. (спец.). Химически простое вещество, не принадлежащее к металлам. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
неметалл — сущ., кол во синонимов: 17 • азот (8) • астат (3) • бор (21) • бром … Словарь синонимов
неметалл — nemetalas statusas T sritis chemija apibrėžtis Cheminis elementas, kuriam būdingas didelis elektrinis neigiamumas, blogas elektrinis ir šiluminis laidumas. atitikmenys: angl. non metal; nonmetal rus. неметалл … Chemijos terminų aiškinamasis žodynas
Неметалл — м. Химический элемент, проявляющий преимущественную способность к присоединению электронов, а в свободном состоянии не имеющий физических признаков, характерных для металла; металлоид. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
неметалл — неметалл, неметаллы, неметалла, неметаллов, неметаллу, неметаллам, неметалл, неметаллы, неметаллом, неметаллами, неметалле, неметаллах (Источник: «Полная акцентуированная парадигма по А. А. Зализняку») … Формы слов
Неметалл — Элементы с типично неметаллическими свойствами занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее Группа III IV V VI VII 2 й период B C N O F 3 й период Si P S Cl … Википедия
неметалл — немет алл, а … Русский орфографический словарь
неметалл — (2 м); мн. немета/ллы, Р. немета/ллов (химический элемент) … Орфографический словарь русского языка
неметалл — немета/лл, а (вещество, не принадлежащее металлам) … Слитно. Раздельно. Через дефис.
неметалл — а; м. Хим. Элемент, не относящийся к металлам (кислород, фосфор, сера и др.). ◁ Неметаллический, ая, ое. Н ие полезные ископаемые. Н ие материалы … Энциклопедический словарь
Неметаллы
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
| Группа | III | IV | V | VI | VII | VIII |
| 2-й период | B | C | N | O | F | Ne |
| 3-й период | Si | P | S | Cl | Ar | |
| 4-й период | As | Se | Br | Kr | ||
| 5-й период | Te | I | Xe | |||
| 6-й период | At | Rn |
Кроме того, к неметаллам относят также водород [источник?] и гелий.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графан, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
См. также
Полезное
Смотреть что такое «Неметаллы» в других словарях:
НЕМЕТАЛЛЫ — НЕМЕТАЛЛЫ, химические элементы, которые не обладают свойствами, характерными для металлов. Неметаллы как правило плохие проводники тепла и электричества (они обычно являются изоляторами тепла и электричества). К неметаллам относятся углерод,… … Научно-технический энциклопедический словарь
НЕМЕТАЛЛЫ — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; твердые тела бор,… … Большой Энциклопедический словарь
НЕМЕТАЛЛЫ — хим. элементы, которые образуют в свободном состоянии простые вещества, не обладающие физ. и хим. свойствами (см.); устаревшее название металлоиды. К Н. принято относить 22 элемента Периодической системы элементов Д. И. Менделеева (см.): водород … Большая политехническая энциклопедия
неметаллы — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; твёрдые тела бор,… … Энциклопедический словарь
Неметаллы — [nonmetals, metalloids] химические элементы, которые образуют простые тела, не обладающие характерными для металлов свойствами. К неметаллам относятся 22 элемента. Из них при комнатной температуре находятся в газообразном состоянии Н, N, О, F, Cl … Энциклопедический словарь по металлургии
Неметаллы — химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов (См. Металлы). Название Металлоиды, которое иногда применяют для Н., выходит из употребления. К Н. относятся 22 элемента. Из них при… … Большая советская энциклопедия
НЕМЕТАЛЛЫ — простые в ва, не обладающие св вами металлов. Хотя резкой границы между металлами и Н. провести нельзя, к Н. принято относить благородные газы, водород, галогены, кислород, халькогены, азот, фосфор, мышьяк, углерод, кремний и бор … Большой энциклопедический политехнический словарь
НЕМЕТАЛЛЫ — хим. элементы, к рые образуют простые тела, не обладающие свойствами, характерными для металлов. К Н. обычно относят 22 элемента: газы водород, азот, кислород, фтор, хлор и благородные газы; жидкость бром; тв. тела бор, углерод, кремний, фосфор,… … Естествознание. Энциклопедический словарь
НЕМЕТАЛЛЫ — простые вещества, не обладающие свойствами металлов: они не имеют металлического блеска, нековки, плохо проводят теплоту и электричество. Резкой границы между неметаллами и металлами нет. К неметаллам относятся 22 элемента. Из них при нормальной… … Металлургический словарь
Неорганическая химия — Неорганическая химия раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Это область охватывает все химические соединения, за исключением органических… … Википедия
Неметаллы
Общая характеристика неметаллов
Неметаллы в периодической системе расположены справа от диагонали «бор – астат». Это элементы главных подгрупп III, IV, V, VI, VII, VIII групп. К неметаллам относятся: бор, углерод, кремний, азот, фосфор, мышьяк, кислород, сера, селен, теллур, водород, фтор, хлор, бром, йод, астат, а также благородные газы: гелий, неон, криптон, ксенон, радон.
Среди неметаллов два элемента – водород и гелий – относятся к s-семейству, все остальные принадлежат к р-семейству.
На внешнем электронном слое у атомов неметаллов находится различное число электронов: у атома водорода – один электрон (1s 1 ), у атомов гелия – два электрона (1s 2 ), у атома бора – три электрона (2s 2 2p 1 ). Однако атомы большинства неметаллов, в отличие от атомов металлов, на внешнем электронном слое имеют большое число электронов – от 4 до 8; их электронные конфигурации изменяются от ns 2 np 2 у атомов элементов главной подгруппы IV группы до ns 2 np 6 у атомов инертных газов.
Физические свойства
Элементы – неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях:
Газы: гелий, неон, криптон, ксенон, радон, водород, кислород, азот, фтор, хлор.
Жидкость: бром
Твердые вещества: йод, углерод, кремний, фосфор, и др.
7 элементов-неметаллов образуют простые вещества, существующие в виде двухатомных молекул Э2 (H2, O2, N2, F2, Cl2, Br2, I2).

Кристаллические решетки металлов и твердых веществ-неметаллов отличаются между собой. Атомы металлов образуют плотно упакованную кристаллическую структуру, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электрический ток, не обладают пластичностью.
Химические свойства
Неметаллы как окислители
В этой реакции сера – окислитель, а фосфор – восстановитель, так как ЭО фосфора меньше ЭО серы.
На разной окислительной активности основана способность одних неметаллов вытеснять другие из растворов их солей. Например, бром, как более сильный окислитель, вытесняет йод в свободном виде из раствора йодида калия:
Неметаллы как восстановители
Стоит отметить, что неметаллы (кроме фтора) могут проявлять и восстановительные свойства. При этом электроны атомов неметаллов смещаются к атомам элементов- окислителей. В образующихся соединениях атомы неметаллов имеют положительные степени окисления. Высшая положительная степень окисления неметалла обычно равна номеру группы.
— взаимодействие с кислотами-окислителями:
— взаимодействие с солями-окислителями:
Наиболее сильные восстановительные свойства имеют неметаллы углерод и водород:
Таким образом, практически все неметаллы могут выступать как в роли окислителей, так и в роли восстановителей. Это зависит от того, с каким веществом взаимодействует неметалл.
Реакции самоокисления – самовосстановления
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления – самовосстановления (диспропорционирования). Например:
Скачать:
Скачать бесплатно реферат на тему: «Неметаллы» Неметаллы.docx (420 Загрузок)
Скачать рефераты по другим темам можно здесь
Неметаллы. Физические и химические свойства
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.
Физические свойства неметаллов. Аллотропия
Если смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.
С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
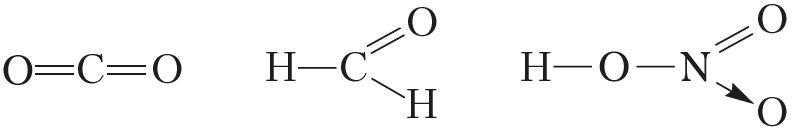
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
В настоящее время открыто 22 неметаллических элемента.
§ 28. Общая характеристика неметаллов
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 28. Общая характеристика неметаллов |
| Напечатано:: | Гость |
| Дата: | Вторник, 28 Декабрь 2021, 02:26 |
Оглавление
Положение в периодической системе
Элементы, расположенные в одной группе, сходны по строению атома, а значит, во многом и по свойствам. Поэтому для некоторых групп неметаллов применяют общие названия. Так, неметаллы VIIIA-группы называют благородными газами. Для элементов VIIA-группы используют название галогены — рождающие соли. Неметаллы VIA-группы имеют общее название халькогены — рождающие руды.
По электрофизическим свойствам, в отличие от химических, простые вещества, состоящие из атомов тех или иных элементов, подразделяют на три группы: металлы, полупроводники и диэлектрики. Различить эти вещества можно не только по величине электропроводности, но и по характеру её зависимости от температуры. С ростом температуры электропроводность металлов падает, а полупроводников и диэлектриков растёт. Типичные полупроводники — кремний и германий.
Строение электронных оболочек атомов неметаллов
В целом значения степеней окисления неметаллов лежат в интервале от –4 до +8, а валентности — от I до VIII. Следует вспомнить, что валентность атомов элементов второго периода не бывает больше четырёх:
В исторически сложившейся классификации элементов принадлежность к неметаллам определяли по физическим свойствам простых веществ: твёрдое, газообразное или жидкое состояние при нормальных условиях. В твёрдом состоянии у неметаллов, как правило, отсутствует металлический блеск. Их электро- и теплопроводность обычно невелики, вещества являются хрупкими.
Неметаллы образуют два типа кристаллов — молекулярные и атомные ( рис. 62 ).
Для неметаллов характерно явление аллотропии. Примерами могут служить красный и белый фосфор, алмаз и графит, кислород и озон.
Неметаллы могут вступать в реакции с веществами всех классов (металлами, другими неметаллами, оксидами, щелочами, кислотами, солями) и проявлять как окислительные, так и восстановительные свойства ( табл. 20 ).
Таблица 20. Общие свойства неметаллов как простых веществ
| Неметаллы как окислители вступают в реакции | Неметаллы как восстановители вступают в реакции |
| С металлами: | С некоторыми оксидами: |
| С другими неметаллами: | С другими неметаллами: |
| С кислотами: | С органическими веществами: |
| С солями: |
Окислительные способности атомов неметаллов можно сравнивать по положению в периодической системе: с ростом атомного номера они увеличиваются в периодах и уменьшаются, как правило, в группах. Эти же свойства можно также оценивать, сопоставляя электроотрицательность неметаллов, которая возрастает в ряду:
| Si | B | As | As | H | C | I | S | Br | Cl | N | O | F |
| 1,9 | 2,0 | 2,1 | 2,2 | 2,2 | 2,5 | 2,5 | 2,6 | 2,8 | 3,0 | 3,0 | 3,5 | 4,0 |
Окислительная способность неметаллов с увеличением электроотрицательности усиливается.
Распространённость неметаллов в природе
В природе неметаллы существуют не только в виде соединений (органические вещества, оксиды Н2О, SiO2, СО2, соли бескислородных кислот NaCl, As2S3, соли кислородсодержащих кислот СаСО3, Са3(РО4)2), но и в свободном виде, например азот, кислород, благородные газы, углерод (в форме графита и алмаза), сера. Существование неметаллов в виде простых веществ в природе связано с низкой активностью перечисленных неметаллов при нормальных условиях: атомы благородных газов имеют завершённый внешний электронный уровень, кислород и азот — достаточно прочные ковалентные связи в двухатомных молекулах, углерод образует прочные атомные кристаллы. На Земле самыми распространёнными неметаллами являются кислород и кремний (по массе около 49 % и 26 % соответственно), во Вселенной — водород.
Области применения простых веществ неметаллов обширны. Примерами могут служить: производство полупроводниковых материалов (кремний, селен), металлургические процессы получения металлов (углерод, водород) и сплавов (бор, кремний), интенсификация процессов горения (кислород), создание инертной атмосферы (азот, благородные газы), органический синтез (хлор, бром), воздухоплавание (гелий, водород), светотехника (благородные газы).
Степени окисления неметаллов изменяются от –4 до +8.
В химических реакциях неметаллы проявляют как окислительные, так и восстановительные свойства.
Вопросы, задания, задачи
1. Опишите положение неметаллов в периодической системе. Укажите для элементов-неметаллов третьего периода возможные значения степени окисления и валентности.
2. Запишите символы элементов и общую формулу электронной конфигурации:
3. Определите степени окисления атомов в соединениях:
4. Укажите утверждения, характеризующие кислород как химический элемент:
5. Составьте уравнения реакций с участием неметаллов, учитывая, что атомы неметаллов в заданных реакциях проявляют низшую степень окисления:
8. Докажите, что фосфор выполняет функцию восстановителя в первой реакции и окислителя — во второй:
9. Расставьте коэффициенты методом электронного баланса и укажите, окислителем или восстановителем являются простые вещества:
1. Конфигурацию внешнего электронного уровня ns 2 np 5 имеют:
2. Кремний как химический элемент характеризуют утверждения:
3. Положительную степень окисления проявляют элементы VA-группы в соединениях:
4. Сера является окислителем, реагируя с:
5. Сумма коэффициентов в реакции синтеза фосфида кальция из простых веществ равна: