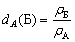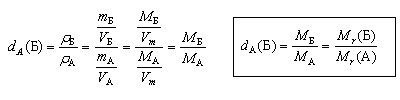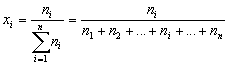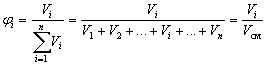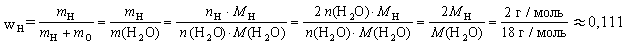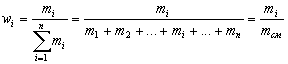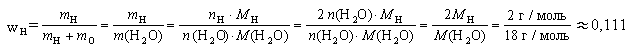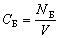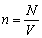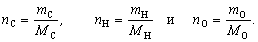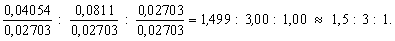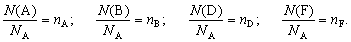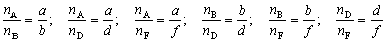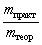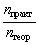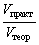ОПРЕДЕЛЕНИЕ ПЛОТНОСТИ (1 2 3)
Плотностью вещества называют отношение массы тела к его объему:

Следовательно, плотность вещества выражают * в г/см3. Удельным весом у называют отношение веса (силы тяжести) вещества к объему:

Плотность и удельный вес вещества находятся в такой же зависимости между собой, как масса и вес, т. е.

где g — местное значение ускорения силы тяжести при свободном падении. Таким образом, размерность удельного веса ‘(г/см2 • сек2) и плотности (г/см3), а также их числовые значения, выраженные в одной системе единиц, отличаются друг от друга *.
Плотность тела не зависит от его местонахождения на Земле, в то время как удельный вес изменяется в зависимости от того, в каком месте Земли его измерить.
В ряде случаев предпочитают пользоваться так называемой относительной плотностью, представляющей собой отношение плотности данного вещества к плотности другого вещества при определенных условиях. Относительная плотность выражается отвлеченным числом.
Относительную плотность d жидких и твердых веществ принято определять по отношению к плотности дистиллированной воды:
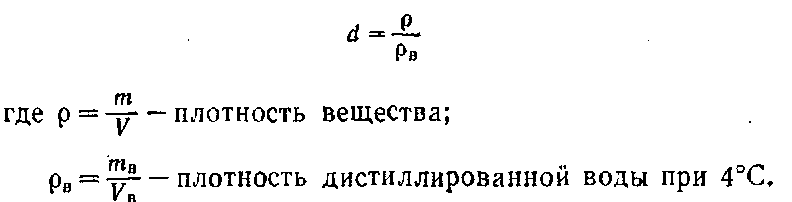
Само собой разумеется, что р и рв должны выражаться одинаковыми единицами.
Относительную плотность d можно также выражать отношением массы взятого вещества к массе дистиллированной воды, взятой в том же объеме, что и вещество, при определенных, постоянных условиях.
Поскольку числовые значения как относительной плотности, так и относительного удельного веса при указанных постоянных условиях являются одинаковыми, пользоваться таблицами относительных удельных весов в справочниках можно так же, как если бы это были таблицы плотности.
Относительная плотность является постоянной величиной для каждого химически однородного вещества и для растворов при данной температуре. Поэтому по
* В технической системе единиц (MKXCC). в которой за основную единицу принята не единица массы, а единица силы — килограмм-сила (кГ или кгс), удельный вес выражается в кГ/м3 или Г/см3. Следует отметить, что числовые значения удельного веси, измеренного в Г/см3, и плотности, измеренной в г/см3, совпадают, что нередко вызывает путаницу в понятиях «плотность» и «удельный вес».
* В ряде случаев плотность выражают в г/мл. Различие между числовыми значениями плотности, выраженными в г/см3 и г/мл, очень незначительно. Его следует принимать во внимание лишь при работах особой точности.
Поэтому по величине относительной плотности во многих случаях можно судить о концентрации вещества в растворе.
* В технической системе единиц (MKXCC). в которой за основную единицу принята не единица массы, а единица силы — килограмм-сила (кГ или кгс), удельный вес выражается в кГ/м3 или Г/см3. Следует отметить, что числовые значения удельного веси, измеренного в Г/см3, и плотности, измеренной в г/см3, совпадают, что нередко вызывает путаницу в понятиях «плотность» и «удельный вес».
Обычно плотность раствора увеличивается с увеличением концентрации растворенного вещества (если оно само имеет плотность больше, чем растворитель). Но имеются вещества, для которых увеличение плотности с увеличением концентрации идет только до известного предела, после которого при увеличении концентрации происходит уменьшение плотности.
Например, серная кислота имеет наивысшую плотность, равную 1,8415 при концентрации 97,35%. Дальнейшее увеличение концентрации сопровождается уменьшением плотности до 1,8315, что соответствует 99,31%.
Уксусная кислота имеет максимальную плотность при концентрации 77- 79%, а 100%-ная уксусная кислота имеет ту же плотность, что и 41%-ная.
Относительная плотность зависит от температуры, при которой ее определяют. Поэтому всегда указывают температуру, при которой делали определение, и температуру воды (объем взят за единицу). В справочниках это показывают при помощи соответствующих индексов, например eft; приведенное обозначение указывает, что относительная плотность определена при температуре 2O0C и за единицу для сравнения взята плотность воды при температуре 4е С. Встречаются также и другие индексы, обозначающие условия, при которых производилось определение относительной плотности, например Я4 Ul и т. д.
Изменение относительной плотности 90%-ной серной кислоты в зависимости от температуры окружающей среды приводится ниже:

Относительная плотность с повышением температуры уменьшается, с понижением ее —увеличивается.
При определении относительной плотности необходимо отмечать температуру, при которой оно проведено, и полученные величины сравнивать с табличными данны-, ми, определенными при той_же температуре.
Если измерение проведено не при той температуре, которая указана в справочнике, то. вводят поправку, вычисляемую как среднее изменение относительной плотпости на один градус. Например, если в интервале между 15 и 20 0C относительная плотность 90%-ной серной кислоты уменьшается на 1,8198—1,8144 = 0,0054, то в среднем можно принять, что при изменении температуры на 1 0С (выше 15 0C) относительная плотность уменьшается на 0,0054 : 5 = 0,0011.
Таким образом, если определение вести при 18 0C, то относительная плотность указанного раствора должна быть равна:

Однако для введения температурной поправки к относительной плотности удобнее пользоваться приведенной ниже номограммой (рис. 488). Эта номограмма, кроме того, дает возможность но известной относительной плотности, вычисленной при стандартной температуре 20° С, приближенно определять относительную плотность при других температурах, в чем иногда может возникнуть потребность.Относительную плотность жидкостей можно определять при помощи ареометров, пикнометров, специальных весов и т. п.
Определение относительной плотности ареометрами.
Для быстрого определения относительной плотности жидкости применяют так называемые ареометры (рис. 489). Это—стеклянная трубка (рис. 489, а), расширяющаяся внизу и имеющая на конце стеклянный резервуар, заполненный дробью нли специальной массой, (реже — ртутью). В верхней узкой части ареометра имеется шкала с делениями. Чем меньше относительная плотность жидкости, тем глубже погружается в нее ареометр. Поэтому на его шкале вверху нанесено наименьшее значение относительной плотности, которое можно определить данным ареометром, внизу — наибольшее. Например, у ареометров для жидкостей с относительной плотностью меньше единицы внизу стоит 1,000, выше 0,990, еще выше 0,980 и т. д.
Промежутки между цифрами разделены на более мелкие деления, позволяющие определять относительную плотность с точностью до третьего десятичного знака. У наиболее точных ареометров шкала охватывает значения относительной плотности в пределах 0,2—0,4 единицы (например, Для определения плотности от 1,000 до 1,200, от 1,200 до 1,400 и т. д.). Такие ареометры обычно продают в виде наборов, которые дают возможность определять относительную плотность в широком интервале.

Номограмма для введения температурной поправки
Иногда ареометры снабжены термометрами (рис. 489,6), что позволяет одновременно измерять температуру, при которой проводится определение. Для определения относительной плотности при помощи ареометра жидкость наливают в стеклянный цилиндр (рис. 490) емкостью не менее 0,5 л, сходный по форме с мерным, но без носика и делений. Размер цилиндра должен соответствовать размеру ареометра. Наливать жидкость в цилиндр до краев не следует, так как при погружении ареометра жидкость может перелиться через край. Это бывает даже опасно при измерении плотности концентрированных кислот или концентрированных щелочей и пр. Поэтому уровень жидкости в цилиндре должен быть на несколько сантиметров ниже края цилиндра.
Иногда цилиндр для определения плотности имеет вверху желоб, расположенный концентрически, так что если жидкость при погружении ареометра перельется через край, то она не выльется на стол.
Для определения относительной плотности имеются специальные приборы, поддерживающие постоянный уровень жидкости в цилиндре. Схема одного из таких приборов приведена на рис. 491. Это — цилиндр 2, имеющий на определенной высоте отводную трубку 3 для стекания жидкости, вытесняемой ареометром при погружении его в жидкость. Вытесняемая жидкость поступает в трубку 4, имеющую кран 5, через который жидкость может быть слита. Цилиндр можно наполнять исследуемой жидкостью через уравнительную трубку /, имеющую в верхней части цилиндрическое расширение.
Как вычислять относительную плотность вещества
Для того чтобы справиться с задачей, необходимо использовать формулы на определение относительной плотности:
D (воздух) = Mr (газа)/ Mr (воздуха), где:
Все три параметра единиц измерения не имеют.
Mr (воздуха) = 29 (величина постоянная), следовательно формула будет иметь вид:
D (воздух) = Mr (газа)/ 29.
По аналогии выглядит формула на определение относительной плотности по водороду, с тем исключением, что вместо воздуха стоит водород. А значит, и в расчет берется относительная молекулярная масса водорода.
Mr (водорода) = 2, следовательно и формула будет иметь вид:
D (воздух) = Mr (газа)/ 2.
Пример № 1. Вычислите относительную плотность аммиака по воздуху. Аммиак имеет формулу NH3.
Сначала найдите относительную молекулярную массу аммиака, которую можно рассчитать по таблице Д.И. Менделеева.
Ar (N) = 14, Ar (H) = 3 х 1 = 3, отсюда
Mr (NH3) = 14 + 3 = 17
Подставьте полученные данные в формулу на определение относительной плотности по воздуху:
D (воздух) = Mr (аммиака)/ Mr (воздуха);
D (воздух) = Mr (аммиака)/ 29;
D (воздух) = 17/ 29 = 0, 59.
Пример № 2. Вычислите относительную плотность аммиака по водороду.
Подставьте данные в формулу на определение относительной плотности по водороду:
D (водород) = Mr (аммиака)/ Mr (водорода);
D (водород) = Mr (аммиака)/ 2;
D (водород) = 17/ 2 = 8, 5.
Как в химии пишется относительная плотность
5.7. Относительная плотность
| Относительная плотность вещества Б – отношение плотности вещества Б к плотности вещества А, взятого за эталон. |
Относительная плотность dA(Б) показывает, во сколько раз плотность данного вещества (Б) больше плотности эталонного вещества (А)
Как и все относительные величины, относительная плотность – величина безразмерная.
Для твердых и жидких веществ в качестве эталона обычно берется чистая вода (плотность воды – 1 г/мл), и тогда относительная плотность, оставаясь безразмерной, оказывается численно равной обычной плотности.
Для газов за эталон чаще всего берется сухой воздух (при н. у, плотность воздуха – 1,293 кг/м 3 или 0,001293 г/см 3 ), но может быть взят и любой другой газ. Для идеальных газов относительная плотность равна
и, таким образом, не зависит от давления и температуры. Эти соотношения с достаточно высокой точностью справедливы и для реальных газов при обычных давлениях.
Все доли – величины относительные, а потому безразмерные, и их значения не зависят от размера порции вещества, для которого они определены.
| Мольная доля элемента в соединении – отношение количества вещества данного элемента к сумме количеств вещества всех элементов, входящих в соединение. |
Например, мольная доля водорода в воде
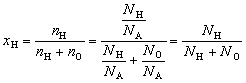
| Мольная доля вещества Б в смеси или растворе – отношение количества вещества Б к сумме количеств вещества всех компонентов смеси или раствора. |
Если для приготовления раствора взяли 47 молей воды и 3 моля какой-нибудь соли, то мольная доля соли в полученном растворе
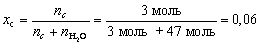
Объемная доля вещества Б в смеси или растворе – отношение объема вещества Б к объему смеси или раствора.
Если смешать 2 л водорода, 4 литра азота и 6 литров углекислого газа, то объемная доля азота в этой смеси
Объемная доля компонента смеси имеет смысл только в тех случаях, когда объем смеси равен сумме объемов отдельных компонентов этой смеси, что ограничивает применение этой величины (используется, как правило, только для смесей газов).
Массовая доля элемента в соединении – отношение массы данного элемента к массе всей порции вещества.
| Массовая доля вещества Б в смеси или растворе – отношение массы вещества Б к массе смеси или раствора. |
Например, массовая доля водорода в воде
Если при приготовлении раствора взяли 25 г воды и 5 г какой-либо соли, то массовая доля соли в полученном растворе
Объемная доля элемента в соединении не имеет смысла.
При расчете этих величин для смеси твердых или жидких веществ можно использовать только мольные доли.
| Водород – H2 – бесцветный газ с очень низкой температурой кипения (20 К, или –253 o С). Водород – самый легкий газ, его относительная плотность по воздуху равна примерно 0,07, поэтому водородом часто заполняют аэростаты и воздушные шары. Жидкий водород используют как компонент ракетного топлива (горючее). Смесь водорода с кислородом в объемном отношении 2:1 (гремучий газ) взрывается от электрической искры или поджигания, образуя воду. Водород вступает в реакции как с металлами, так и со многими неметаллами, образуя гидриды. Он используется в органических синтезах и других современных технологиях. |
Азот – N2. Из всех известных газов, не считая благородных, азот является самым инертным, его двухатомная молекула – одна из самых прочных. Объемная доля азота в воздухе – 78,09 %. Из жидкого воздуха его и получают в промышленности, используя разницу в температурах кипения кислорода и азота (90 К и 77 К соответственно). Газообразный азот используется для заполнения колб электрических ламп накаливания, в качестве инертной среды для проведения некоторых химических реакций, для синтеза аммиака, а жидкий азот – в технике низких температур (криогенной технике).

2.Определите объемную долю кислорода в смеси его с углекислым газом, если смешали 2 л кислорода и 4 л углекислого газа (газы при смешивании находились при одинаковых условиях).
3.В смеси азота и водорода объемная доля водорода составляет 75 %. Определите объем азота, необходимого для приготовления 200 л такой смеси.
4.Определите массовые доли элементов, входящих в состав а) аммиака NH3, б) серной кислоты H2SO4, в) фосфата кальция Ca3(PO4)2.
5.В смеси алюминия с йодом массовая доля алюминия равна 20 %. Определите мольные доли алюминия и йода в этой смеси. В каком массовом отношении взяты алюминий и йод? В каком мольном отношении (отношении количеств вещества) взяты эти вещества?
6.Докажите, что для одной и той же системы (например, смеси веществ) 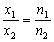
7.Определите среднюю молекулярную массу смеси монооксида и диоксида азота, если объемная доля монооксида в ней равна 0,6.
8.Состав сухого воздуха в массовых долях: азот – 0,7553; кислород – 0,2314; аргон – 0,0128; углекислый газ – 0,0005. Рассчитайте мольные доли компонентов воздуха.
9.Определите среднюю молярную и среднюю молекулярную массу воздуха. Определите плотность по воздуху а) водорода, б) сероводорода, в) хлора. При решении воспользуйтесь ответами предыдущей задачи.
Кроме долей компонентов в смеси или растворе для количественной характеристики состава системы используется величина, которая называется концентрация компонента, или просто концентрация.
Концентрация компонента Б – отношение количества вещества компонента Б к объему системы.
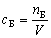
В физике часто используется родственная физическая величина – концентрация молекул компонента Б в смеси веществ (в общем случае – концентрация частиц компонента Б в смеси).
| Концентрация молекул (частиц) компонента Б – отношение числа молекул (частиц) компонента Б к объему системы |
Концентрация молекул компонента Б показывает, сколько молекул вещества Б содержится в одном кубометре или одном литре смеси или раствора.
Концентрация компонента и концентрация молекул этого компонента связаны между собой простым соотношением:
По существу, это одна и та же величина – только, если молекул много, то их подсчитывают в молях, а если мало, то – в штуках.
| Концентрация молекул (частиц) – отношение числа молекул (частиц) вещества к объему, который они равномерно заполняют. |
Так как » плотность молекул вещества Б» и » концентрация компонента Б в смеси» величины однородные, единицы измерений у них одинаковые:
то есть эта величина также показывает, сколько частиц содержится в единичном объеме.


2.Сколько нужно отвесить сульфата алюминия Al2(SO4)3 для приготовления 10 кг водного раствора этой соли с массовой долей растворенного вещества, равной 0,05?Ъ
3.Сколько можно получить нитрата калия KNO3, если выпарить 30 м 3 водного раствора с массовой долей нитрата калия 10 %, учитывая, что плотность такого раствора равна 1,06 г/мл?
4.В соответствии с данными таблицы составьте условия задач и решите составленные вами задачи.
?
5.В состав вещества входят водород, углерод, кислород и азот в соотношении 1 : 3 : 4 : 7 по массе. Определите массовые доли элементов в этом веществе.
6.В соединении, содержащем углерод, кислород и водород, массовая доля углерода равна 54,5 %, а массовая доля кислорода – 36,34 %. Определите, в каком отношении по массе (массовом отношении) указанные элементы входят в состав вещества.
7.При изготовлении бронзы сплавили медь с оловом в массовом отношении 5:1. Определите массовую долю олова в этом сплаве.
8.В сплаве Вуда (tпл = 45 o С) массовые доли свинца, висмута, олова и ртути равны, соответственно, 50; 25; 12,5 и 12,5 %, Определите, в каком отношении по массе нужно взять компоненты для приготовления этого сплава? Сколько ртути содержится в 18 г этого сплава?
9.Массовая доля хлорида калия в водном растворе равна 0,04. Определите концентрацию растворенного вещества, если плотность раствора равна 1,01. г/мл.
10.Какова концентрация сульфата алюминия в растворе, полученном по данным задачи 2? Плотность раствора – 1,05 г/мл.
11.Какова концентрация нитрата калия в растворе, фигурирующем в задаче 3? Плотность раствора – 1,06 г/мл.
12.Для растворов 1, 3, 4 и 5 (задача 4) определите концентрацию растворенного вещества.
13.Определите массу хлорида калия, содержащегося в а) 150 мл 0,1М раствора КCl в воде; 6) 50 мл 0,02М водного раствора KCl; в) 2,5 л 0,015М водного раствора КС1.
14.Определите массу серной кислоты, необходимой для приготовления 2 л ее 0,012М раствора в воде.
15.Рассчитайте массу воды и массу аммиака, необходимых для приготовления 20 л 30 %-ного раствора аммиака NH3 (плотность раствора – 0,92 г/мл).
16.Определите массовые доли компонентов в водных растворах, представленных в таблице.
3
17.Определите концентрации компонентов в следующих водных растворах: 26 %-ный раствор MgCl2 с плотностью 1,24 г/мл; б) 1 %-ный раствор AgNO3 с плотностью 1,01 г/мл; в) 8 %-ный раствор BaCl2 с плотностью 1,07 г/мл; г) 40 %-ный раствор BaCl2 с плотностью 1,46 г/мл.
Для установления формулы неизвестного вещества химики проводят его анализ. Для этого порцию вещества известной массы подвергают определенным химическим превращениям, по результатам которых узнают, какие элементы входят в состав этого вещества. Проводя различные измерения (чаще всего – взвешивания и измерения объемов), определяют массовые доли элементов в веществе. Эти данные анализа позволяют установить простейшую формулу вещества.
Задача
В соединении, содержащем углерод, водород и кислород, массовая доля углерода равна 0,4865, а а массовая доля водорода – 0,0811. Определите простейшую формулу этого соединения.
Решение
Сначала найдем недостающее значение массовой доли кислорода:
Количества вещества элементов соответственно равны
Молярные массы элементов нам известны, а массы элементов можно выразить через их массовые доли:
x : y : z = nC : nH : nO =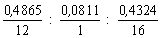
Чтобы получить отношение целых чисел, разделим все три числа на наименьшее из них:
Умножив на 2, окончательно получим x : y : x = 3 : 6 : 2.
Ответ: простейшая формула соединения – C3H6O2.
Для установления молекулярной формулы вещества необходимо знать, во сколько раз его молекулярная масса больше формульной массы, вычисленной по простейшей формуле.
Например, молекулярную формулу бутана C4H10 мы можем записать как (C2H5)2, где С2H5 – его простейшая формула. Отсюда видно, что молекулярная масса бутана в 2 раза больше формульной массы, рассчитанной для него по простейшей формуле.
Для газообразных веществ источником информации при определении молекулярной формулы служит плотность или относительная плотность вещества, так как:
Задача
Определите молекулярную формулу вещества с простейшей формулой SiH3, если относительная плотность его паров по воздуху равна 2,14.
Решение
Запишем формулу вещества в виде (SiH3)z. Тогда
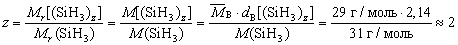
Ответ: молекулярная формула вещества Si2H6.
Аналогично определяется молекулярная формула вещества с использованием значения плотности пара этого вещества.
Зная химическую формулу вещества, вы всегда можете определить
а) молекулярную (формульную) массу вещества;
б) молярную массу вещества;
в) массовую долю элемента в веществе;
г) мольную долю элемента в веществе.

2.Установите простейшие формулы соединений, содержащих марганец и кислород, если массовые доли марганца в них составляют а) 0,775; б) 0,696; в) 0,632 и г) 0,495.
3.Установите молекулярные формулы газообразных соединений углерода с водородом (углеводородов), в которых массовые доли углерода составляют а) 0,800, б) 0,857. и в) 0,923. Плотности по водороду этих газов равны а) 15, б) 14 и в) 13.
4.При сгорании чистого графита в кислороде образовалась смесь монооксида и диоксида углерода с плотностью по воздуху 1,24. Определите состав газовой смеси в объемных долях.
5.При нормальных условиях (н. у.) плотность газообразного вещества, в состав которого входят азот и водород равна 0,759 г/л. Мольная доля водорода в этом соединении равна 0,75. Найдите молекулярную формулу вещества.
Запишем уравнение химической реакции в общем виде:
Здесь A, В, D и F – формулы веществ; а, b, d, и f – коэффициенты в уравнении реакции.
Вы помните, что 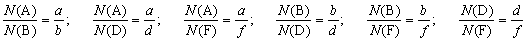
Но
Следовательно
Таким образом, мы можем рассчитать количество вещества любого реагента или продукта реакции, если нам известно количество вещества любого другого реагента или продукта.
Задача
Определите количество вещества хлора, необходимого для получения 203,1 г трихлорида железа FeCl3 из железа.
Решение
2Fe + 3Cl2 = 2FeCl3
M(FeCl3) = 162,5 г/моль
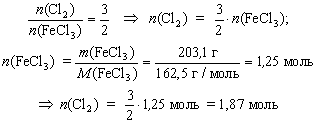
При проведении какого-либо химического процесса по уравнению химической реакции мы можем рассчитать количество вещества, а значит и массу любого продукта реакции, но практически столько продукта мы никогда не получим. В реальном процессе всегда будут какие-нибудь потери. Для определения количества вещества или массы практически получаемого продукта реакции нужно учитывать величину, называемую выходом продукта реакции.
| Выход продукта реакции – отношение массы реально полученного продукта реакции (mпракт) к массе этого продукта, рассчитанной по уравнению реакции (mтеор). |
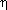
Выход продукта реакции – величина безразмерная. Выражение для выхода продукта реакции можно записать и так 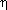
а для газообразных продуктов реакции еще и 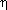
Докажите самостоятельно, что выход, посчитанный любым из этих трех способов, одинаков.
Вы, наверное, уже обратили внимание, что понятие » выход продукта реакции» во многом сходно с понятием » коэффициент полезного действия» (и не только тем, что обозначается той же буквой). Ведь вы знаете, что коэффициент полезного действия системы определяется как отношение энергии, использованной на совершение полезной работы, к энергии, полученной системой, то есть
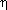
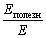
Коэффициент полезного действия системы, как и выход продукта реакции, всегда меньше единицы.
Во многих реакциях выход хоть и меньше единицы, но отличается от нее незначительно. В этих случаях отличием выхода от единицы мы будем пренебрегать, даже не оговаривая это специально.
| Медь – Cu. Мягкий, ковкий металл красного цвета, не реагирует с водой, очень хорошо проводит тепло и электрический ток. Во влажном воздухе покрывается светло-зеленым налетом гидроксид-карбоната меди Cu2CO3(OH)2. В сухом воздухе на поверхности меди образуется пленка черного монооксида. В электротехнике используют медь в чистом виде: в производстве кабелей, электрогенераторов, телефонного и телеграфного оборудования, радио- и электронной аппаратуры. На улицах городов можно увидеть, как красиво лучи солнца отражаются от крыш отреставрированных зданий. Это долговечное покрытие крыш – тоже сплав меди, со временем оно приобретает благородный черный цвет. На основе меди производят различные сплавы. Важнейшие из них – латунь и бронза, они широко используются в машиностроении и автомобилестроении. Беря в руки столовые приборы из мельхиора и нейзильбера, многие считают, что это сплавы серебра, а на самом деле это сплавы меди с никелем и цинком. В ювелирном деле используются не чистые золото и серебро, а их сплавы с медью. Из медных сплавов чеканят монеты. Гептаоксид димарганца – Mn2O7. Это один из немногих оксидов, жидких при комнатной температуре. Темная маслянистая жидкость (в отраженном свете зеленая, а в проходящем – красная). Весьма гигроскопичен, термически очень неустойчив, разлагается в обычных условиях со взрывом. Крайне реакционноспособен. Будучи кислотным оксидом, реагирует с водой и щелочами. Монооксид углерода – CO. Газ без цвета и запаха. Свое бытовое название (угарный газ) это вещество получило благодаря тому, что именно из-за него можно угореть в доме с печным отоплением, если слишком рано закрыть заслонку дымохода. Дело в том, что монооксид углерода, также как и кислород, реагирует с гемоглобином крови, но, в отличие от кислорода, образует с ним устойчивое соединение – карбоксигемоглобин, при этом гемоглобина для связывания с кислородом, необходимым для дыхания, уже не остается. В воде угарный газ растворяется плохо. В обычных условиях он довольно инертен, но при повышении температуры становится активным и может реагировать со многими газами, например с NH3, Cl2,, O2, металлами и некоторыми другими веществами. Несмотря на свою ядовитость, монооксид углерода находит применение в промышленности – химическом синтезе и металлургии. В смеси с водородом дает так называемый «синтез-газ», из которого в различных условиях можно получить множество необходимых человеку веществ. Серная кислота – H2SO4. Бесцветная вязкая жидкость, охотно поглощающая влагу (гигроскопична). в химии, а иногда и в быту, её даже используют как водоотнимающее средство. При разбавлении кислоты водой выделяется большое количество теплоты, и раствор сильно нагревается, поэтому при приливании кислоты к воде (а делать это нужно только в такой последовательности!) раствор необходимо перемешивать. При нагревании она частично или полностью (в зависимости от условий нагрева) разлагается на воду и триоксид серы. Серная кислота применяется при производстве удобрений, пластмасс, красителей, лекарств, бумаги, взрывчатых веществ, в металлургии – для очистки металлов. Кроме того, ее используют для составления нитрующих смесей с азотной кислотой, для реакций сульфирования (в органическом синтезе), для очистки нефтепродуктов и минеральных масел, а также для наполнения свинцовых аккумуляторов. Серная кислота и ее концентрированные растворы разрушающе действуют на органические вещества – обугливает их. Если при работе с серной кислотой ощущается пощипывание или жжение – значит, кислота попала на кожу и необходимо ее смыть большим количеством проточной воды, смочить место ожога раствором соды и снова промыть водой. Аммиак – NH3. Бесцветный газ, с характерным резким запахом, легче воздуха. При избыточном давлении или охлаждении он легко сжижается, образуя бесцветную жидкость, при более низкой температуре он переходит в твердое состояние – вещество белого цвета. Аммиак очень хорошо растворяется в воде (до 700 объемов газа в одном объеме воды при нормальных условиях), при этом он частично реагирует с ней. Раствор аммиака в воде называют нашатырным спиртом, если его концентрация колеблется в пределах от 3 до 10 %, более концентрированные растворы (18 – 25 %) называют аммиачной водой. Аммиак весьма реакционноспособен, он реагирует с самыми разнообразными веществами. В промышленности аммиак получают прямым синтезом из азота и водорода. В лабораторных условиях его можно получить, нагревая хлорид аммония с гашеной известью. Используется аммиак в качестве хладагента (рабочего вещества различных холодильных машин), в производстве азотной кислоты, органических продуктов и жидких удобрений, а также соды. |


2.Определите количество вещества углекислого газа, образующегося при сгорании 6 г графита.
3.В промышленности негашеную известь (оксид кальция СаО) получают, прокаливая известняк (карбонат кальция CaCO3), при этом кроме оксида кальция образуется углекислый газ. Определите объем этого газа (н. у.), выделившегося при прокаливании 1,5 т известняка.
4.В промышленности HCl получают, сжигая хлор в водороде. Определите массу водорода, необходимого для реакции со 125 м 3 хлора (н. у.). Каково количество вещества образовавшегося HCl?
5.При взаимодействии цинка с соляной кислотой (раствором HCl в воде) протекает реакция.
Сколько железа можно получить из 100 т железной руды с массовой долей не содержащих железо примесей, равной 20 %? (Примечание. Вопрос » сколько железа. » задан неточно. На него можно ответить по-разному: определив количество вещества, массу или даже объем железа, если известна его плотность. Обычно в таких случаях в ответе дается значение той физической величины, которая приведена для другого вещества в условии задачи.)
15.Условие задачи 14. Вместо руды использован чистый Fe2O3, но выход железа – 90 %.
16.Условие задачи 14. Вместо руды использован оксид железа FeO, содержащий 15 % (по массе) диоксида кремния.
17.Условие задачи 14, но выход железа – 90 %.
18.Сколько медной руды, представляющей собой сульфид меди CuS и содержащей 25 % примесей, необходимо переработать, чтобы получившейся меди хватило для выплавки 100 кг бронзы, в состав которой кроме меди входит 10 % олова, если выход меди по реакции получения ее из сульфида составляет 90 %?


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору