Цинк. Соединения цинка. Амфотерность оксида и гидроксида цинка.
Нахождение в природе
При получении цинка его руды подвергают обжигу:
Далее оксид цинка восстанавливают углем:
Для получения более чистого металла оксид цинка растворяют в серной кислоте и выделяют электролизом.
При комнатной температуре довольно хрупкий, но при 100-150 0 Сон хорошо гнется и прокатывается в листы, обладает хорошей электро- и теплопроводнocтью.
1. Легко окисляется кислородом:
2. При нагревании легко взаимодействует с неметаллами (серой, хлором):
3. Вода почти не действует на цинк, хотя он и стоит в ряду напряжения металлов значительно раньше водорода. Это объясняется образующейся на поверхности цинка защитной пленки.
4. Растворяется в разбавленных и концентрированных кислотах HCl, H2SО4, НNО3 и в водных растворах; щелочей, например:
Соединения цинка
В соединениях цинк проявляет степень окисления +2.
Оксид цинка является амфотерным соединением, он peагирует с кислотами и щелочами:
Гидроксид цинка Zn(OH)2 выпадает в виде белого студенистого осадка при действии щелочей на растворы солей цинка:
Гидроксид цинка растворяется также в водном растворе аммиака. При этом образуются комплексные ионы [Zn(NН3)4] 2+ :
Из киновари металлическую ртуть получают обжигом руды. При этом ртуть выделяется в виде паров и конденсируется в охлаждаемом приемнике:
Ртуть обладает способностью растворять в себе многие металлы, образуя с ними частью жидкие, частью твердые сплавы, называемые амальгамами. Особенно легко образуется амальгама золота, вследствие чего золотые изделия не должны соприкасаться с ртутью. Железо не образует амальгамы, поэтому ртуть можно перевозить в стальных сосудах.
Пары ртути очень ядовиты и могут вызвать тяжелое отравление.Для этого достаточно даже того ничтожного количества паров, которое образуется при комнатной температуре. Поэтому при всех работах с ртутью необходимо быть очень осторожным. Не следует держать открытыми сосуды с ртутью, все работы с ней надо проводить на эмалированных или железных подносах. Очень опасна ртуть, пролитая на пол. При падении она разбивается на множество мелких капель, которые попадают в щели и могут в течение длительного времени отравлять атмосферу. Поэтому, если ртуть пролилась на пол, необходимо немедленно и тщательно собрать ее. Для удаления ртути можно пользоваться также специальными реактивами (демеркуризаторами). В качестве последних применяют порошок серы, 20%-ный раствор FеСlз, эмульсию из минерального масла и воды, содержащую порошкообразные серу и йод, 10%-ый раствор КМnO4, подкисленный соляной кислотой.
Из металлов подгруппы цинка ртуть наименее активна вследствие высокой энергии ионизации ее атомов.
1. На воздухе ртуть при комнатной температуре не окисляется.
При температуре выше 300°С окисляется кислородом, образуя красный оксид ртути (II) HgO, который при более сильном нагревании снова распадается на ртуть и кислород. В этом соединении степень окисления ртути равна +2:
Известен и другой оксид ртути черного цвета, в котором степень окисления ртути равна + 1, оксид ртути(I) Hg2O.
2. Очень легко взаимодействует с серой:
3. При нагревании взаимодействует с галогенами:
4. В электрохимическом ряду напряжений металлов ртуть находится после водорода. Соляная и разбавленная серная кислота, а также щелочи не действуют на ртуть.
Растворяется в разб. и конц. азотной кислоте и конц. серной кислоте:
5. Взаимодействие с солями
Ртуть взаимодействует с солями ртути (II) с образованием солей ртути (I):
Другие металлы, из-за малой активности, вытеснять из растворов не может.
Соединения ртути
Во всех соединениях ртути (I) атомы ртути связаны между собой, образуя двухвалентные группы – Hg2 – (– Hg – Hg –).
Следовательно, ртуть двухвалентна и в этих соединениях, но одна единица валентности каждого атома ртути затрачивается здесь на связь с другим атомом ртути. Эта связь сохраняется и в растворах солей ртути (I), которые содержат ионы ртути. Таким образом, состав солей ртути (I),
содержащих одновалентный кислотный остаток R, следует изображать не эмпирической формулой HgR, а формулой Hg2R2 (например, Hg2CI2).
Одна из особенностей ртути заключается в том, что для нее неизвестны гидроксиды. В тех случаях, когда можно было бы ожидать их образования, получаются безводные оксиды.
Так, при действии щелочей на растворы солей ртути (I) получается буровато-черный осадок оксида ртути (I):
Точно так же из растворов солей ртути (II) щелочи осаждают оксид ртути (II):
Образующийся осадок имеет желтый цвет, но при нагревании переходит в красную модификацию оксида ртути (II). Данная реакция является качественной на катион ртути Hg 2+
Соли ртути
Нитрат ртути ( I ) Нg2(NО3)2— одна из немногих растворимых солей ртути (I). Получается при действии разбавленной холодной азотной кислоты на избыток ртути:
Хлорид ртути(I) Hg2C12, или каломель, представляет собой белый, нерастворимый в воде порошок. Его получают, нагревая смесь HgCl2 с ртутью:
Каломель может быть получена также действием соляной кислоты или хлорида натрия на растворимые соли ртути (I):
Нитрат ртути ( II ) Нg(NО3)2 получается при действии избытка горячей азотной кислоты на ртуть:
Хорошо растворим в воде. В разбавленных растворах при отсутствии свободной кислоты гидролизуется с образованием белого осадка основной соли НgО ∙ Нg(NО3)2. При нагревании с большим количеством воды основная соль также разлагается, в результате чего получается оксид ртути (II).
Хлорид ртути ( II ), или сулема, HgC12 может быть получен непосредственным взаимодействием ртути с хлором. Это бесцветное вещество, сравнительно мало растворимое в холодной воде (6,6 г в 100 г воды при 20 0 С). Однако с повышением температуры растворимость сулемы сильно возрастает, достигая при 100 0 C58 г в 100 г воды. Из раствора HgC12 кристаллизуется в виде длинных блестящих призм. Обычно эту соль получают, нагревая сульфат ртути (II) с хлоридом натрия:
Йодид ртути ( II ) HgI2 выпадает в виде красивого оранжево-красного осадка при действии раствора йодида калия на соли ртути (II):
В избытке йодида калия соль легко растворяется, образуя бесцветный раствор комплексной соли K2[HgI4]:
Сульфид ртути ( II ) HgS встречается в природе Искусственно он может быть получен в виде вещества черного цвета прямым соединением серы со ртутью или действием сероводорода на растворы солей ртути (II):
Задания для самоконтроля:
1. К какому электронному семейству относятся элементы IIВ группы?
2. Как доказать амфотерные свойства оксида и гидроксида цинка?
4. К каким элементам –переходным или непереходным относят цинк, кадмий, ртуть? Назовите основные сходные черты этих металлов с переходными и непереходными элементами.
5. Как и почему изменяется термическая устойчивость и кислот-но-основные свойства гидроксидов в ряду Zn(OH)2–Hg(OH)2?
6. Чем можно объяснить, что для ртути, в отличие от цинка и кадмия, характерна переменная степень окисления (+ 1 и + 2)? Какова валентность ртути в соответствующих соединениях?
7. Что представляют собой сулема и каломель?
8. Как следует собирать разлитую в помещении ртуть и обезвреживать ее следы?
9. Что такое амальгамы, как их можно получить? В чем заключается химическая причина того факта, что амальгамы щелочных и щелочно-земельных металлов спокойно без взрыва контактируют с водой. Что наблюдается при этом?
Задания для самостоятельной работы:
1. Киноварь и каломель растворяются в «царской водке». Какие продукты при этом получаются? Напишите уравнения соответствующих реакций.
2. Как реагируют цинк, кадмий и ртуть с разбавленными и кон-центрированными а) серной, 2) азотной, в) соляной кислотами. Напишите уравнения соответствующих реакций.
3. Составьте электронную формулу атома ртути в степени окисления +1 и сделайте вывод о парамагнетизме атома. Однако известно, что катионы ртути(I) в водном растворе диамагнитны. Объясните этот факт с учетом состава и строения катиона ртути(I).
4. Написать уравнения реакций, протекающих при добавлении щелочи к растворам нитратов ртути(I) и ртути(II). Изменятся ли продукты реакций, если вместо щелочи использовать водный раствор аммиака?
5. Напишите уравнения реакций, иллюстрирующих амфотерность гидроксида цинка(II).
6. Смесь оксидов цинка и магния массой 0.3 г растворили в 1 М растворе соляной кислоты объемом 17 мл. Избыток кислоты нейтрализовали 0.5 М раствором гидроксида натрия объемом 8 мл. Вычислите массовую долю оксида цинка в смеси.
7. Составьте уравнения следующих реакций с участием цинка:
Какие химические свойства цинка проявляются в этих реакциях? Предложите способы химической идентификации образующихся в этих реакциях газов.
8. Определите, к каким соединениям цинка, кадмия и ртути относятся следующие тривиальные и минералогические названия: сулема, киноварь, каломель, цинковые белила, цинковый купорос, госларит, кадмиевые шениты, гремучая ртуть. Напишите их химические формулы.
9. В лаборатории оказались без этикеток банки с твердыми солями ZnCl2, CdCl2и HgCl2. Все эти вещества имеют одинаковую окраску (укажите какую). Какой способ идентификации этих веществ Вы можете предложить, если в Вашем распоряжении имеются только вода и аналитические весы.
10. Составьте уравнения следующих реакций, протекающих в водном растворе.
Какие химические свойства соединений ртути(I) и ртути(II) проявляются в этих реакциях?
11. Какова масса ZnSO4∙7H2O, полученного при взаимодействии цинка с 200 мл 20% раствора H2SO4 (ρ = 1,14 г/см).
12. Массу сулемы 10,8 г обработали 200 мл раствора аммиака концентрации 0,2 моль/ дм3. Вычислите массу осадка, выделившегося в результате реакции.
Подготовьте доклад, реферат или презентацию на тему:
· Важнейшие соединения цинка и его аналогов.
· Комплексные соединения цинка, кадмия и ртути.
· Биологическая роль и применение в фармации и медицине соединений d-элементов.
· Соединения ртути. Оксиды ртути. Соли ртути.
· Качественные реакции на катионы цинка. Качественные реакции на катионы ртути.
· Биологическая роль цинка, влияние соединений ртути на живые организмы. Применение соединений ртути и цинка в медицине, в народном хозяйстве.
· Комплексные соединения цинка. Биологическая роль цинксодержащих ферментов.
Список рекомендуемой литературы:
1. Пустовалова Л.М., Никанорова И.Е. Неорганическая химия. Ростов-н/Д. Феникс, 2005
2. Бабков, А.В. Общая и неорганическая химия [Текст]: учебник / А.В. Бабков, Т.И. Барабанова, В.А. Попков. – М.: ГЭОТАР-Медиа, 2014. – 384 с.
Тема 2.10. Побочная подгруппа VI группы
Содержание учебного материала:Общая характеристика элементов. Строение атомов. Изменение по группе атомных радиусов и ионизационных потенциалов. Валентность и степени окисления атомов. Окислительно-восстановительные свойства соединений в разных степенях окисления атомов. Характер химических связей в соединениях.Соединения хрома. Оксиды, гидроксиды. Хроматы. Дихроматы. Окислительные свойства соединений хрома (VI).Биологическая роль хрома. Применение соединений хрома.
Основные понятия: химический элемент, атом, химическая связь, электроотрицательность, валентность,степень окисления, основные типы реакций в неорганической химии; комплексные соединения.
Основные законы химии: Периодический закон Д.И. Менделеева.
Основные теории химии:Теории строения атома, химической связи, строения неорганических соединений
Методические рекомендации: При изученииматериала необходимо отметить, какие элементы относятся к побочной подгруппе VI группы. Обратите внимание на строение электронных уровней элементов. Также рассмотрите физические и химические свойства соединений элементов.
Краткое изложение теоретических вопросов:
Докажите амфотерные свойства оксида хрома(III) и гидроксида цинка, приведите уравнения соответствующих реакций.
Гидроксид цинка — амфотерный гидроксид, имеющий формулу Zn(OH)2.
Чтобы доказать амфотерность гидроксида рассмотритепример. Для этого используйте гидроксид цинка Zn(OH)2.
В обе колбы со шлифом налейте равное небольшое количество раствора хлористого цинка. Вставьте в первую колбу капельную воронку с раствором гидроксида натрия, осторожно отверните кран и медленно начните приливать щелочь к цинковой соли. Почти сразу образуется рыхлый белый осадок. Это показатель, что протекает следующая реакция: ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Далее продолжайте приливать раствор гидроксида натрия к осадку гидроксида цинка. Через некоторое время вы заметите, что осадок начинает постепенно исчезать, и вскоре в колбе будет лишь прозрачный раствор. Что же произошло? Гидроксид цинка превратился в растворимое комплексное соединение Na2ZnO2. Произошла реакция: Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
То есть гидроксид цинка вступает в реакцию с сильной щелочью. Но вступает ли он в реакцию с кислотой? В другую колбу точно так же начните доливать раствор гидроксида натрия. Как только образуется рыхлый белый осадок, смените капельную воронку и начните вливать уже соляную кислоту, только делайте все медленно. Вы заметите, что осадок очень быстро исчезнет. Почему так случилось? Гидроксид цинка вступил в реакцию с соляной кислотой, образовав растворимую соль, произошла следующая реакция: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Поскольку гидроксид цинка реагирует и со щелочью, и с кислотой, он амфотерен. Таким образом, вы доказали, что требовалось
Дата добавления: 2015-01-21 ; просмотров: 4009 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Как доказать амфотерные свойства оксида и гидроксида цинка напишите уравнения реакций
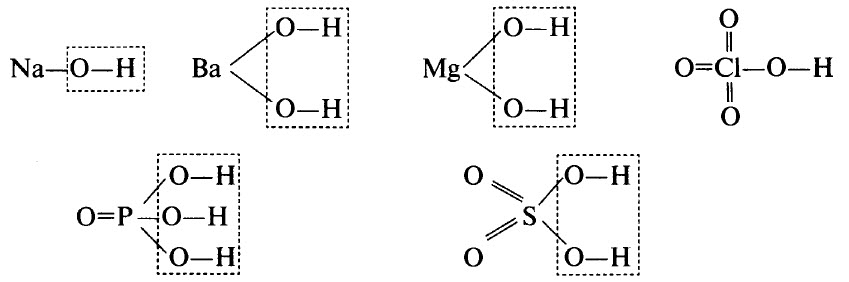
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
В образовавшейся соли алюминий образует анион AlO2 – (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4] – :
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока по химии для 8 класса «Амфотерные оксиды и гидроксиды». Выберите дальнейшее действие:
Докажите амфотерные свойства оксида хрома(III) и гидроксида цинка, приведите уравнения соответствующих реакций.
Гидроксид цинка — амфотерныйгидроксид, имеющий формулу Zn(OH)2.
Чтобы доказать амфотерность гидроксида рассмотритепример. Для этого используйте гидроксид цинка Zn(OH)2.
В обе колбы со шлифом налейте равное небольшое количество раствора хлористого цинка. Вставьте в первую колбу капельную воронку с раствором гидроксида натрия, осторожно отверните кран и медленно начните приливать щелочь к цинковой соли. Почти сразу образуется рыхлый белый осадок. Это показатель, что протекает следующая реакция: ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Далее продолжайте приливать раствор гидроксида натрия к осадку гидроксида цинка. Через некоторое время вы заметите, что осадок начинает постепенно исчезать, и вскоре в колбе будет лишь прозрачный раствор. Что же произошло? Гидроксид цинка превратился в растворимое комплексное соединение Na2ZnO2. Произошла реакция: Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
То есть гидроксид цинка вступает в реакцию с сильной щелочью. Но вступает ли он в реакцию с кислотой? В другую колбу точно так же начните доливать раствор гидроксида натрия. Как только образуется рыхлый белый осадок, смените капельную воронку и начните вливать уже соляную кислоту, только делайте все медленно. Вы заметите, что осадок очень быстро исчезнет. Почему так случилось? Гидроксид цинка вступил в реакцию с соляной кислотой, образовав растворимую соль, произошла следующая реакция: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Поскольку гидроксид цинка реагирует и со щелочью, и с кислотой, он амфотерен. Таким образом, вы доказали, что требовалось
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ №25
Виды и особенности химической связи.
Степень окисления (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Окислитель – принимает электроны (восстанавливается)
Восстановитель – отдает электроны (окисляется)
Окисление – процесс отдачи электронов.
Восстановление – процесс принятия электронов.
Составьте формулы
Гидроксокарбоната меди(II).
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 26
Ковалентная связь. Метод валентных связей.
Ковалентная связь – возникает между атомами в результате образования общих электронных пар.
Основные положения метода валентных связей:
1) В образовании химической связи участвуют только неспаренные электроны внешней электронной оболочки.
2) Химическая связь образуется между двумя электронами, имеющими противоположно направленные спины
3) При образовании химической связи происходит перекрывание электронных облаков. В области перекрывания создается зона повышенной электронной плотности. Она способствует притяжению атомов друг к другу.
4) Химическая связь осуществляется в том направлении, где обеспечивается наибольшее перекрывание электронных облаков.
Метод электронного баланса.
Метод электронного баланса — один из методов уравнивания окислительно-восстановительных реакций (ОВР).Заключается в том чтобы на основании степеней окисления расставить коэффициенты в ОВР. Для правильного уравнивания следует придерживаться определённой последовательности действий:
1) Найти окислитель и восстановитель.
2) Составить для них схемы (полуреакции) переходов электронов, отвечающие данному окислительно-восстановительному процессу.
3) Уравнять число отданных и принятых электронов в полуреакциях.
4) Просуммировать порознь левые и правые части полуреакций.
5)Расставить коэффициенты в уравнении окислительно восстановительной реакции.