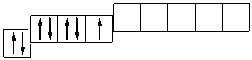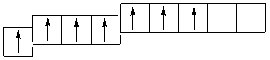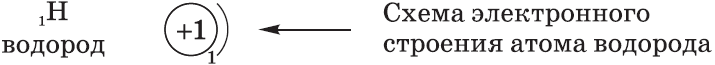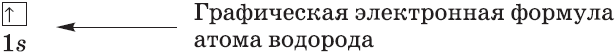Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов
Содержание:
Электронная конфигурация атомов
Записать распределение электронов по энергетическим уровням можно несколькими способами.
Запись по электронным оболочкам (схема электронного строения)
Показывает заряд ядра и количество электронов на каждом энергетическом уровне.
Легче всего начинать с неё, потому что она показывает структуру атома «крупным планом».
Запись с обозначением энергетических уровней и подуровней
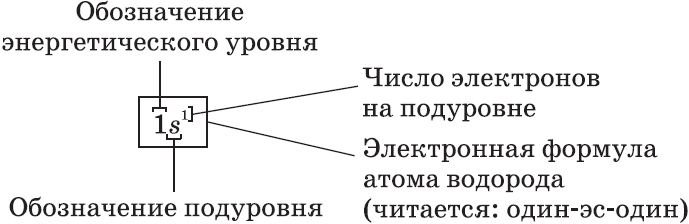
Каждая орбиталь обозначается квадратной ячейкой. Электрон обозначается стрелкой. Различное направление стрелок указывает на противоположные спины.Под ячейкой подписывают номер энергетического уровня, буквенное обозначение орбитали и количество электронов на ней.
Буквенно-числовое обозначение такого «адреса» электрона – это электронная формула. Электронная конфигурация – это электронная формула, которая показывает распределение электронов по энергетическим уровням.
Электронная конфигурация атомов 1 и 2 периодов
Электронная конфигурация атомов 3 периода
Электронная конфигурация атомов 4 периода
Заполнение орбиталей атомов 4 периода имеет свои особенности.
На движение электрона влияют поле ядра и поле других электронов. Поэтому в атомах с большим количеством электронов энергия электрона определяется главным и орбитальным квантовыми числами.
Здесь уже надо смотреть на сумму обоих квантовых чисел (n+l). Если для двух подуровней эта сумма равна: 3d, 4p, 5s (n+l=5), то сначала заполняются уровни с меньшими значениями n. То есть последовательность заполнения будет следующей: 3d – 4p – 5s.
Поэтому в 4 периоде сначала заполняется подуровень 4s, а потом подуровень 3d.
Есть ещё одна особенность, которая появляется в 4 периоде. Хром и медь имеют на 4s-орбитали по одному электрону. Всё дело в заполнении d-оболочек. Полузаполненные или заполненные d-оболочки устойчивее частично заполненных. В атоме хрома на каждой из 5 3d-орбиталей есть по одному электрону. В атоме меди на каждой на каждой 3d-орбитали есть по два электрона.
Алгоритм записи электронной конфигурации атома
Электронная конфигурация ионов
Электронная конфигурация ионов составляется по тем же принципам. Нужно учитывать изменения количества электронов на внешнем энергетическом уровне.
Атом электронейтрален, то есть сколько протонов ядре, столько же электронов в атоме. Если атом принимает электроны, он становится отрицательно заряженным ионом (анионом), если отдаёт электроны – положительно заряженным ионом (катионом).
Атому легче всего отдать электроны внешнего энергетического уровня, «чужие» электроны он тоже примет на внешний энергетический уровень. На внешнем энергетическом уровне не может находиться более 8 электронов. Теория «октета» была предложена в 1916 году Гилбертом Ньютоном Льюисом и Вальтером Косселем
Атом «стремится» добрать электроны на внешний уровень или избавиться от них, поэтому и становится ионом. Полное заполнение s- и p-подуровней внешнего уровня придаёт атому стабильность. Только атом гелия имеет на единственном внешнем энергетическом уровне 2 электрона, а не 8, потому что первый энергетический уровень состоит только из одной s-орбитали.
Количество электронов на внешнем энергетическом уровне определяется по таблице Менделеева. У элементов главных подгрупп номер группы – это и есть количество электронов на внешнем уровне. У элементов побочных подгрупп количество электронов на внешнем уровне не больше двух.
Основное и возбуждённое состояния атома
На первый взгляд кажется, что атом хлора может образовывать только одну связь и соединения одного типа – например, хлориды. Но откуда берутся хлорная, хлорноватая, хлористая и хлорноватистая кислоты?
Дело в том, что атом можно перевести из основного состояния в возбуждённое.
Основное состояние – это состояние атома с наименьшей энергией. Атом обладает наименьшей энергией в основном состоянии. Но если ему передать дополнительную энергию, он перейдёт в возбуждённое состояние. Электроны перейдут на уровень или подуровень с большей энергией.
Сначала разрываются электронные пары на 3p-подуровне, электроны переходят на 3d-подуровень. Если атом хлора получит ещё больше энергии, спаренный электрон покинет даже 3s-орбиталь и перейдёт на 3d-подуровень.
Благодаря этому атом хлора может образовывать больше химических связей. Затраты энергии, потраченные на распаривание электронов, окупаются при образовании новых химических связей.
Но в возбуждённое состояние могут перейти атомы, у которых есть неспаренные электроны и свободные орбитали. Длится возбуждённое состояние недолго: атом отдаст энергию и вернётся в основное состояние. Хотя если сообщить атому слишком много энергии, электрон покинет его и атом станет ионом.
Основное и возбужденное состояние атома
Как известно, атомы могут вступать в химические реакции с другими атомами, с образованием химических связей, путем отдачи/принятия своих/чужих электронов, которые называются валентными (см. Валентность).
В Периодической таблице химических элементов Д. И. Менделеева все атомы отображены в их основном состоянии (состоянии с минимальной энергией). Основное состояние атома описывается электронной конфигурацией атома, согласно его положению в Периодической таблице (см. Таблицу электронных конфигураций атомов химических элементов по периодам.
В определенных ситуациях, некоторые атомы, получая энергию извне, переходят в, так называемое, возбужденное состояние, в котором пребывают относительно короткое время, поскольку возбужденное состояние является нестабильным, после чего возбужденный атом отдает энергию и возвращается в свое основное (стабильное) состояние.
Рассмотрим основное и возбужденное состояние атома на конкретных примерах.
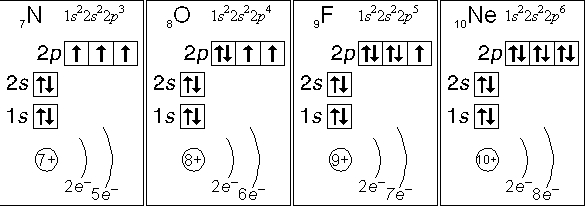
Рис. Электронные конфигурации атомов азота, кислорода, фтора, неона.
Азот, кислород, фтор и неон не могут иметь возбужденного состояния по той простой причине, что они не имеют свободной орбитали с более высокой энергией, на которую могли бы «перескакивать» спаренные электроны с орбиталей с меньшей энергией.
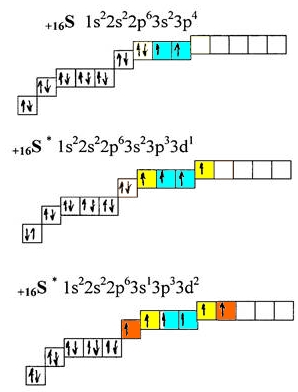
Рис. Возбужденное состояние атома серы.
В основном состоянии атом серы имеет 2 валентных электрона (голубой цвет). Как видно из вышеприведенного рисунка, получая энергию извне, у атома серы могут появляться еще 2 (желтый цвет) или 4 (желтый+оранжевый) дополнительных валентных электрона, при этом общее кол-во валентных электронов увеличивается до 4 или 6 соответственно.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Нормальное и возбужденное состояния атомов. Графическое изображение электронных формул атомов элементов



Квантовое состояние с наименьшей энергией атома называется нормальным, или основным; остальные квантовые состояния с бóльшими уровнями энергии называются возбужденными. Электрон в нормальном состоянии связан с ядром наиболее прочно. В возбужденном состоянии атома связь электрона с ядром ослабевает (вплоть до отрыва электрона от атома).
В нормальном состоянии атом может существовать неограниченное время, в возбужденном же состоянии – ничтожные доли секунды (
Возбуждение атома происходит при нагревании, электроразряде, поглощении света и т.д., и в любом случае атом поглощает лишь определенные порции – кванты энергии.
Возможные энергетические состояния атомов элементов можно наглядно представить с помощью графических формул. Обычно учитывают только валентные электроны, так как именно они обусловливают химические свойства и возможные превращения атомов элементов. Рассмотрим на конкретном примере.
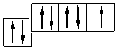
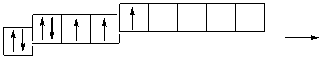
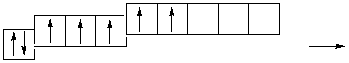
В атоме хлора заполняется электронами третий уровень, в пределах которого энергетически возможен d-подуровень. Энергия его достаточно велика, поэтому заполнение его возможно лишь для элементов 4-го периода (мы это ранее объясняли). Однако, если атому хлора сообщить дополнительную энергию, он может перейти в возбужденное состояние, которое сопровождается постепенным распариванием р- и s-электронов и переходом их на d-подуровень. Для атома хлора возможно несколько возбужденных состояний.
Cl…3s 2 3p 5 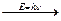
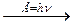
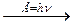
Атомы хлора в возбужденном состоянии приобретают положительную степень окисления, равную +3, +5, +7 (высшая степень окисления), соответственно.
Валентность, обусловленная числом неспаренных электронов, также различна у этих элементов. Фтор может быть только одновалентным, в то время как хлор за счет возможного перехода в возбужденное состояние может проявлять еще валентность, равную трем, пяти и семи. Так, исходя из электронного строения атомов, мы можем объяснить различные возможности этих элементов в химических превращениях. Более подробно зависимость химических свойств элементов и их соединений от электронного строения атомов элементов разберем ниже.
Возбужденные атомы: 1. Кто такие и где встречаются

Три изображения атома: стилизованное, упрощенное и более реалистичное. Упрощенная модель нарисована в соответствии с устаревшей боровской моделью атома, но она удобна для иллюстраций перехода электрона с орбиты на орбиту. Однако не поддавайтесь ложному впечатлению, которое она создает! Реальные электроны в атоме — это вовсе не маленькие шарики, которые летают по четко заданным орбитам; они больше напоминают размазанные в пространстве облака электронной плотности
Атомы — элементарные кирпичики вещества — устроены, на первый взгляд, очень просто. Внутри атома тяжелое и очень компактное ядро, вокруг которого движутся несколько электронов. Законы квантовой механики говорят, что электроны не могут двигаться как угодно, а должны образовывать определенную устойчивую конфигурацию, которая имеет наименьшую энергию и сама по себе уже не развалится. Эта конфигурация называется основным состоянием атома; практически все атомы вокруг нас — именно такие. Вся химия, всё многообразие веществ и материалов возникает из того, как взаимодействуют друг с другом атомы в основном состоянии.
Однако электронную конфигурацию можно «взбаламутить», посветив на атом светом или как-то иначе передав ему дополнительную энергию. Форма электронной оболочки изменится, полная энергия атома повысится, и атом перейдет в новое состояние, которое называется возбужденным. Опять же, по законам квантовой механики возбужденные состояния не могут быть какие угодно, они должны быть строго определенными, с некоторой дополнительной энергией, зависящей от типа возбуждения. Поэтому возбужденные состояния занимают определенные энергетические уровни, причем эта лесенка уровней энергии — своя для каждого сорта атомов.
Вверху: электронные облака для некоторых возбужденных состояний атома водорода. Внизу: энергетический спектр атома водорода. Изображение с сайта en.wikipedia.org
Передав атому очень много лишней энергии, его можно возбудить настолько сильно, что электрон попросту от него оторвется и улетит прочь. Такой процесс называется ионизацией, а получившийся положительно заряженный «недоатом» — ионом. Оставшиеся у иона электроны можно возбуждать дальше, но только лесенка, — или, на научном языке, спектр — возбужденных уровней энергии у него уже будет отличаться от исходного атома. Экстремальный случай возбуждения — это когда у атома отбирают вообще все электроны, и от него остается лишь голое ядро. Так бывает либо при очень высокой температуре, либо в экстремальных условиях, например, при поглощении сверхмощной световой вспышки.
То, что у каждого сорта атомов и даже у каждого типа ионов одного элемента есть свой собственный спектр возбужденных состояний, — очень помогает физикам. Это дает им исключительно удобный метод диагностики на расстоянии, без непосредственного контакта, и самого вещества, и физических условий, в которых оно находится.
Спектральный состав света, исходящего от полярного сияния, позволяет определить, какие именно молекулы испускают это сияние и с какой интенсивностью. Изображение с сайта atoptics.co.uk
Например, в глубоком космосе встречаются огромные облака частично ионизированного газа. От него идет свет, в спектре которого встречаются многочисленные линии излучения или поглощения. Расшифровав эти спектры, можно найти в них «личную подпись» каждого типа ионов, находящихся в том далеком облаке. Сравнив интенсивность линий друг с другом, можно узнать, каких ионов там больше, а отсюда оценить температуру и плотность газа. Ну а если вдруг в спектре светящихся космических облаков встретится какая-то «анонимка» — линия излучения, не соответствующая ни одному известному иону, — это производит в физике настоящий фурор. Один пример такой ситуации, которая развивается прямо на наших глазах, см. в новостях В спектрах скоплений галактик обнаружена неизвестная линия излучения и Новые результаты не подтверждают загадочную рентгеновскую линию излучения
Электронная конфигурация атома
Теория к заданию 1 из ЕГЭ по химии
Понятие атом возникло еще в античном мире для обо значения частиц вещества. В переводе с греческого атом означает «неделимый».
Электроны
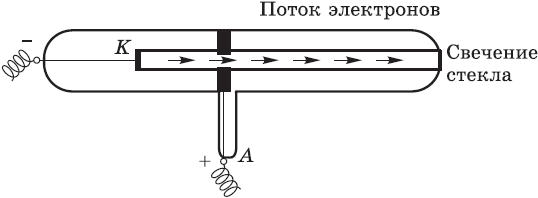
Томсон и Перрен соединяли полюса источника тока с двумя металлическими пластинами — катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к аноду (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами, а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод: электроны вырываются из атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например, при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы I группы таблицы Менделеева (например, цезий).
Состояние электронов в атоме
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве, в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точки. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек больше всего.
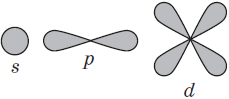
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
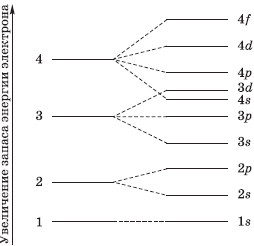
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внеш него уровня.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один под уровень; второй — два; третий — три; четвертый — четыре. Подуровни, в свою очередь, образованы орбиталями.
Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях.
Ядро атома
Но не только электроны входят в состав атомов. Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопленки, закрытые от света. Это явление было названо радиоактивностью.
Различают три вида радиоактивных лучей:
Следовательно, атом имеет сложное строение — состоит из положительно заряженного ядра и электронов.
Как же устроен атом?
Расчеты показали, что наблюдаемые явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, расположенному в центре поля.
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Резерфордом, называют планетарной.
Протоны и нейтроны
Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро).
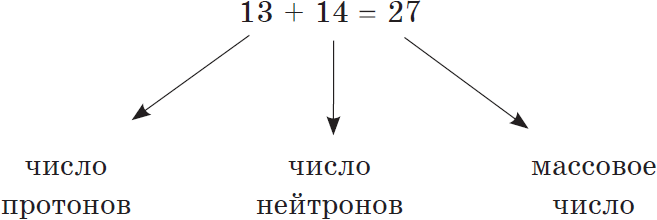
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
Например, число нейтронов в атоме железа равно:
В таблице представлены основные характеристики элементарных частиц.
Основные характеристики элементарных частиц.
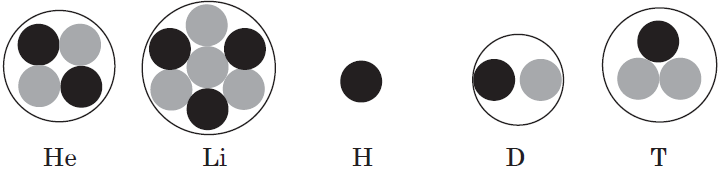
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Слово изотоп состоит из двух греческих слов: isos — одинаковый и topos — место, обозначает «занимающий одно место» (клетку) в Периодической системе элементов.
Химические свойства изотопов хлора совершенно одинаковы, как и изотопов большинства химических элементов, например калия, аргона:
Теперь можно дать современное, более строгое и научное определение химическому элементу.
Химический элемент — это совокупность атомов с одинаковым зарядом ядра.
Строение электронных оболочек атомов элементов первых четырех периодов
Рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Элементы первого периода.
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и под уровням.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и под уровням, но и по орбиталям.
Элементы второго периода.
Элементы третьего периода.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-под уровни.
Строение электронных оболочек атомов элементов третьего периода.
| Символ элемента, порядковый номер, название | Схема электронного строения | Электронная формула | Графическая электронная формула |
| $↙<11> | 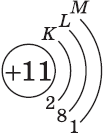 | $1s^2<2>s^2<2>p^6<3>s^1$ | 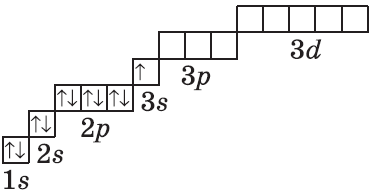 |
| $↙<13> | 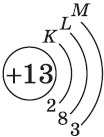 | $1s^2<2>s^2<2>p^6<3>s^2<3>p^1$ | 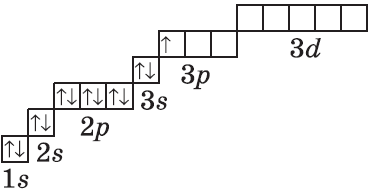 |
| $↙<18> | 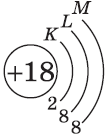 | $1s^2<2>s^2<2>p^6<3>s^2<3>p^6$ | 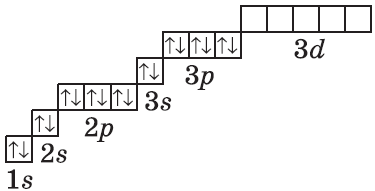 |
Элементы четвертого периода.
$4f$-элементы называют лантаноидами.
$5f$-элементы называют актиноидами.
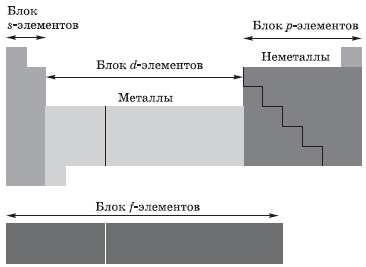
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства, или блока:
Электронная конфигурация атома. Основное и возбужденное состояние атомов
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т.е. электроны с противоположными спинами.
На рисунке показана схема деления энергетических уровней на подуровни.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, т.е. записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например:
Очень часто строение электронных оболочек атомов изображают с помощью энергетических, или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, и лишь затем спариваются, но спины при этом, по принципу Паули, будут уже противоположно направленными.