Учебно-методическое пособие
по органической химии
Тема 2.
Предельные углеводороды.
Циклопарафины
Знать: общие формулы алканов и циклоалканов, строение алканов, гомологический ряд алканов, изомерию и номенклатуру алканов и циклоалканов, их физические и химические свойства; получение, применение и механизмы реакций замещения алканов и циклоалканов.
Уметь: давать названия алканам и циклоалканам, составлять их формулы по названиям веществ; составлять структурные формулы гомологов и изомеров для предложенного алкана или циклоалкана; составлять уравнения реакций, характеризующих свойства алканов, циклоалканов и галогеналканов; составлять структурные формулы галогеналканов, называть их, графически обозначать распределение электронной плотности в молекулах; решать расчетные задачи на нахождение молекулярной формулы вещества по массовым долям элементов и по массе (объему) продуктов сгорания.
Основные понятия: алканы, циклоалканы, тетраэдрическое строение молекул, общая формула, гомологи, гомологическая разность, взаимное влияние атомов, заместитель, изомерия положения заместителей, индукционный эффект, цепная реакция, простейшая формула, истинная формула.
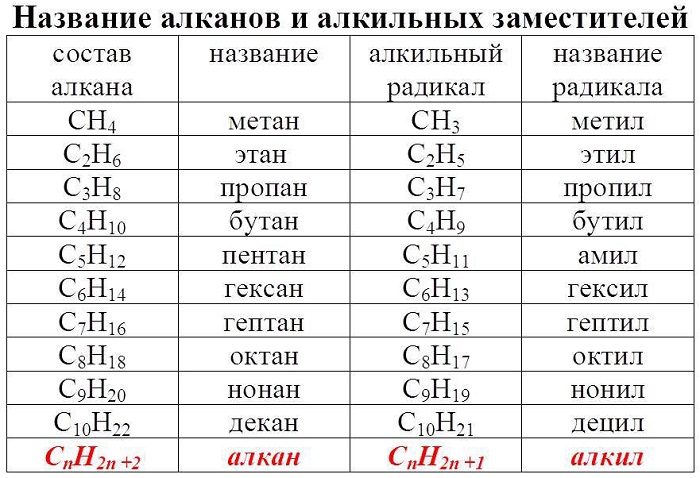
Алгоритм 2.1. Номенклатура алканов
Задание 1. Назвать вещество по систематической номенклатуре:
1. Выбрать главную цепь (наиболее длинная цепь углеродных атомов):
2. Пронумеровать атомы углерода в главной цепи с того конца, к которому ближе стоит заместитель (углеводородный радикал):
1) номер углеродного атома, с которым связан радикал;
3) углеводород, которому соответствует длинная цепь: 2-метилбутан.
Задание 2. Составить структурную формулу углеводорода по его названию «2,3-диметилпентан».
Анализируем название углеводорода, начиная с конца слова.
1. «Пентан» – в главной цепи находится пять атомов углерода:
2. «Диметил» – в состав углеводорода входят два радикала CH3.
3. «2, 3-» – радикалы находятся у 2-го и 3-го углеродных атомов:
4. Дописать недостающие атомы водорода, соблюдая четырехвалентность атома углерода:
Алгоритм 2.2. Гомологи и изомеры
Задание. Для 2,2,3-триметилпентана составить формулы двух гомологов и двух изомеров.
1. Составить формулу исходного вещества, используя задание 2 алгоритма 2.1:
2. Составить формулы г о м о л о г о в, сохраняя строение (разветвление 2,2,3-триметил-). Для этого уменьшить главную цепь на группу СН2 (гомологическая разность) – пример а или увеличить главную цепь на СН2 – пример б:
3. Составляя формулы и з о м е р о в, изменить строение, сохраняя состав исходного углеводорода (C8H18), примеры в, г:
Алгоритм 2.3. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
1. Записать условие задачи.
2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной плотности:
3. Найти индексы х и y по отношению 
4. Записать простейшую формулу: С3Н8.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
1. Записать условие задачи.
2. Найти массовую долю водорода:

3. Найти индексы и простейшую формулу для углеводорода CхHy:
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая формула алканов СnH2n+2, то истинная формула – С4Н10.
Алгоритм 2.4. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 1. При сжигании 29 г углеводорода образовалось 88 г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
1. Записать условие задачи.
2. Найти относительную молекулярную массу вещества:
3. Найти количество вещества образовавшегося оксида углерода(IV):
4. Найти количество вещества углерода в сожженном веществе:


5. Найти количество вещества воды:

6. Найти количество вещества водорода в сожженном веществе:



7. Найти простейшую формулу углеводорода:


следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
следовательно, истинная формула – C4H10.
Задача 2. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
1. Записать условие задачи.
2. Найти молекулярную массу вещества из пропорции:
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:


4. Найти количества веществ воды и водорода:


5. Найти сумму масс углерода и водорода:
6. Найти массу сожженного вещества:
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:


следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
следовательно, истинная формула – С3Н6.
1. Какие углеводороды называют предельными?
3. Физические свойства алканов.
4. Виды изомерии алканов и циклоалканов.
5. Причины инертности алканов.
6. Какие типы химических реакций характерны для алканов, циклоалканов и галогеналканов?
7. Какова последовательность замещения атомов водорода на галоген в алканах, содержащих более двух углеродных атомов?
8. Каков механизм реакции замещения?
9. Каковы способы получения алканов, галогеналканов и циклоалканов?
10. Дайте определения следующим понятиям: гомологи, изомеры, заместитель, электронный эффект, электронная плотность связи, индуктивный эффект, электронодоноры, электроноакцепторы.
Задания для самоконтроля
1. Назвать предельные углеводороды:
2. Составить структурную формулу 2,4,5,5-тетраметил-3-этилоктана. Указать все первичные, вторичные, третичные и четвертичные углеродные атомы.
3. Составить структурные формулы трех углеводородов, содержащих четвертичный углеродный атом, выбирая из первых семи членов ряда алканов С1–С7. Назвать эти углеводороды.
4. Привести структуры и названия продуктов взаимодействия следующих алканов с хлором (в мольном соотношении 1:1):
5. Написать уравнения реакций, которые нужно провести для осуществления следующих превращений:
CH3COONa 






6. Привести уравнения реакций получения и названия дигалогеналканов, необходимых для получения следующих соединений:
7. Органическое вещество содержит 84,21% углерода и 15,79% водорода. Плотность паров вещества по воздуху 3,93. Определить формулу вещества.
8. Алкан имеет плотность паров по воздуху 4,414. Определить формулу алкана.
9. При сгорании 3,6 г алкана получили 5,6 л оксида углерода(IV) (н.у.). Какие объемы кислорода и воздуха затратились на эту реакцию?
Ответ. 8,96 л О2 и 42,67 л воздуха.
10. Углеводород содержит 82,76% углерода и 17,24% водорода (по массе). При монохлорировании этот углеводород образует два изомерных алкилхлорида – первичный и третичный. Определить строение исходного углеводорода.
Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос A13 ЕГЭ по химии —
Теория строения органических соединений: гомология и изомерия. Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Темы, которые нужно знать:
Эти вопросы входят в анализ строения каждого класса веществ в органической химии, но в данном вопросе нам нужно свести все эти знания воедино. Давайте рассмотрим каждое определение, каждый пункт этого вопроса, исходя из знаний строения всех органических веществ.
Изомеры и гомологи
Не вдаваясь в сложные формулировки, давайте определим, что такое гомологи и изомеры.
Гомологи — относятся к одному классу веществ (например, алканы). Это значит, что у них:
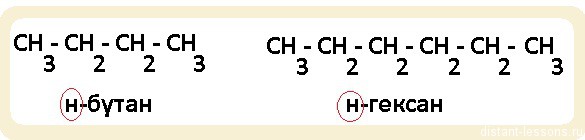
Обратите внимание, именно н-бутан и н-гексан будут относится к гомологам. Если мы возьмем н-алкан (линейная молекула) и разветвленный алкан, то, хотя у них будет одна и та же общая формула (СnH2n+2), по химическим свойствам они будут несколько различаться, т.к. разветвленное строение этих органических соединений будет оказывать влияние на направление протекания реакций.
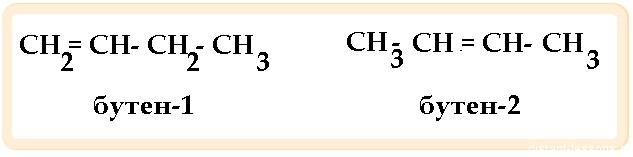
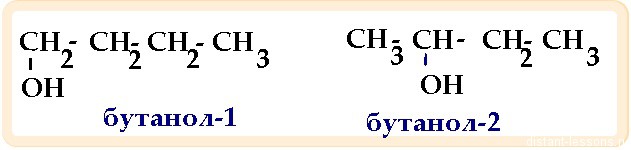
Изомеры —химические соединения, одинаковые по составу и молекулярной массе, но различающиеся по строению и свойствам (химическим и физическим)
Виды изомерии:
Виды химической связи в органической химии
Т.к. органическая химия — это химия соединений углерода, то основным видом химической связи является ковалентная химическая связь.
Как и в неорганических соединениях, в органических вид химической связи определяют исходя из строения вещества.
Тип гибридизации атомов в органических соединениях
Как образуется гибридизация атомных орбиталей в молекуле мы подробно рассматривали при изучении каждого класса органических соединений, здесь мы рассмотрим практическое применение этих знаний.
На что нужно обратить внимание:
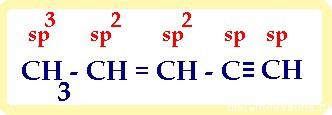
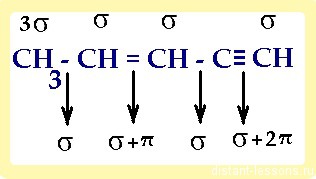
1) в молекуле, имеющей не только один вид связи, каждый атом имеет свой тип гибридизации :
итого: 10 сигма- и 3 π-связей
Давайте систематизируем все эти вопросы по классам углеводородов
| Класс соединения | Общая формула | Тип гибридизации атомов С | Виды изомерии |
| Алканы | СnH2n+2 | Sp 3 | |
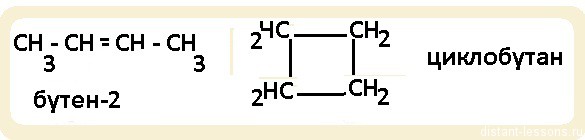
| Циклоалканы | СnH2n | Sp 3 | углеродного скелета, межклассовая (циклоалкалканы изомерны алкенам) |
| Алкадиены | СnH2n-2 | Sp 2 и Sp 3 | |
| Бензол и его гомологи | СnH2n-6 | Sp 2 и (Sp 3 — в боковой цепи) | углеродного скелета (в боковых цепях) |
| Алифатические спирты | СnH2n+1OH | Sp 3 | углеродного скелета положения функциональной группы межклассовая — (спирты изомерны простым эфирам) |
| Ароматические спирты | СnH2n-7OH | Sp 2 и (Sp 3 — в боковой цепи) | |
| Простые эфиры | СnH2n+1O | Sp 3 | углеродного скелетамежклассовая (простыеэфиры изомерны спиртам) |
| Альдегиды и кетоны | СnH2nO | Sp 2 (-С=O) и Sp 3 | углеродного скелета — альдегиды изомерны кетонам |
| Кислоты | СnH2n+1COOH | Sp 2 (-С=O) и Sp 3 |




























 Или так:
Или так: