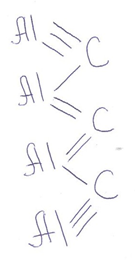Карбид алюминия
| Карбид алюминия | |
|---|---|
 | |
| Хим. формула | Al4C3 |
| Состояние | светло жёлто-коричневые кристаллы без запаха |
| Молярная масса | 143,96 г/моль |
| Плотность | 2,36; 2,99 г/см³ |
| Температура | |
| • плавления | 2100 °C |
| • кипения | (разлагается) 2200 °C |
| Мол. теплоёмк. | 116,8 Дж/(моль·К) |
| Энтальпия | |
| • образования | −209 кДж/моль |
| Растворимость | |
| • в воде | реагирует |
| Кристаллическая структура | ромбоэдрическая, hR21 |
| Рег. номер CAS | 1299-86-1 |
| PubChem | 16685054 |
| Рег. номер EINECS | 215-076-2 |
| SMILES | |
| ChemSpider | 21241412 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Содержание
Получение
Карбид алюминия получается прямой реакцией алюминия с углеродом в дуговой печи:
Небольшое количество карбида алюминия является нормой в примеси технического карбида кальция. В электролитическом производстве алюминия данное соединение получается как продукт коррозии в графитовых электродах.
Получается при реакции углерода с оксидом алюминия:
Химические свойства
При реакции с водой или разбавленными кислотами карбид алюминия образует метан:
Реагирует с водородом:
Реагирует с концентрированным гидроксидом натрия и водой, образуя комплексную соль — тетрагидроксоалюминат натрия и метан:
Физические свойства
Применение
Карбид алюминия иногда используется в пиротехнике, для достижения эффекта искр. Можно использовать в качестве абразива в режущих инструментах. Имеет приблизительно такую же твердость как топаз. Используется в качестве химического реагента для определения содержания трития в воде.
Формула карбида алюминия
Определение и формула карбида алюминия
Частицы вещества имеют кристаллическую структуру.
Рис. 1. Карбид алюминия. Внешний вид.
Тугоплавкий (1400 o C).
Химическая формула карбида алюминия
Общая химическая формула карбида алюминия Al4C3. Химическая формула показывает качественные и количественный состав молекулы (сколько и каких атомов присутствует в ней): четыре атома алюминия (Ar = 276 а.е.м.) и три атома углерода (Ar = 12 а.е.м.). По химической формуле можно вычислить молекулярную массу вещества:
Mr(Al4C3) = 4×27 + 3×12 = 108 + 36 = 144.
Структурная (графическая) формула карбида алюминия
Структурная (графическая) формула карбида алюминия является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
Примеры решения задач
| Задание | Молярная масса соединения азота с водородом равна 32 г/моль. Определите молекулярную формулу вещества, массовая доля азота в котором составляет 85,7%. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Вычислим массовую долю водорода в соединении:
ω (H) = 100% — ω(N) = 100% — 85,7% = 14,3%.
Обозначим количество моль элементов, входящих в состав соединения за «х» (азот), «у» (водород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
Значит простейшая формула соединения азота с водородом будет иметь вид NH2 и молярную массу 16 г/моль [M(NH2) = Ar(N) + 2×Ar(H) = 14+ 2×1 = 14 + 2 = 16 г/моль].
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Значит индексы атомов азота и водорода должны быть в 2 раза выше, т.е. формула вещества будет иметь вид N2H4. Это гидразин.
| Задание | Установите массовую формулу вещества, содержащего 26,5% калия, 35,4% хрома и 38,1% кислорода. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим количество моль элементов, входящих в состав соединения за «х» (калий), «у» (хром) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(K)/Ar(K) : ω(Cr)/Ar(Cr) : ω(O)/Ar(O);
x:y:z= 26,5/39 : 35,4/52 : 38,1/16;
x:y:z= 0,7 : 0,7:2,4 = 1 : 1: 4.
Значит формула соединения калия, хрома и кислорода будет иметь вид KCrO4. Это хромат калия.
Как пишется карбид алюминия
Формула карбида алюминия
Определение и формула карбида алюминия
Частицы вещества имеют кристаллическую структуру.
Рис. 1. Карбид алюминия. Внешний вид.
Химическая формула карбида алюминия
Общая химическая формула карбида алюминия Al4C3. Химическая формула показывает качественные и количественный состав молекулы (сколько и каких атомов присутствует в ней): четыре атома алюминия (Ar = 276 а.е.м.) и три атома углерода (Ar = 12 а.е.м.). По химической формуле можно вычислить молекулярную массу вещества:
Mr(Al4C3) = 4×27 + 3×12 = 108 + 36 = 144.
Структурная (графическая) формула карбида алюминия
Структурная (графическая) формула карбида алюминия является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
Примеры решения задач
| Задание | Молярная масса соединения азота с водородом равна 32 г/моль. Определите молекулярную формулу вещества, массовая доля азота в котором составляет 85,7%. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
Вычислим массовую долю водорода в соединении:
ω (H) = 100% — ω(N) = 100% — 85,7% = 14,3%.
Обозначим количество моль элементов, входящих в состав соединения за «х» (азот), «у» (водород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
Значит простейшая формула соединения азота с водородом будет иметь вид NH2 и молярную массу 16 г/моль [M(NH2) = Ar(N) + 2×Ar(H) = 14+ 2×1 = 14 + 2 = 16 г/моль].
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Значит индексы атомов азота и водорода должны быть в 2 раза выше, т.е. формула вещества будет иметь вид N2H4. Это гидразин.
| Задание | Установите массовую формулу вещества, содержащего 26,5% калия, 35,4% хрома и 38,1% кислорода. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
Обозначим количество моль элементов, входящих в состав соединения за «х» (калий), «у» (хром) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(K)/Ar(K) : ω(Cr)/Ar(Cr) : ω(O)/Ar(O);
Значит формула соединения калия, хрома и кислорода будет иметь вид KCrO4. Это хромат калия.
Карбид алюминия
| Карбид алюминия | |
 | |
| Общие | |
|---|---|
| Химическая формула | Al4C3 |
| Физические свойства | |
| Состояние (ст. усл.) | светло жёлто-коричневые кристаллы без запаха |
| Молярная масса | 143,96 г/моль |
| Плотность | 2,36; 2,99 г/см³ |
| Термические свойства | |
| Температура плавления | 2100 °C |
| Температура кипения | (разлагается) 2200 °C |
| Молярная теплоёмкость (ст. усл.) | 116,8 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | −209 кДж/моль |
| Химические свойства | |
| Растворимость в воде | реагирует г/100 мл |
| Структура | |
| Кристаллическая структура | ромбоэдрическая, hR21 |
| Классификация | |
| Рег. номер CAS | 1299-86-1 |
| Рег. номер PubChem | 16685054 |
Карби́д алюми́ния (алюмокарби́д) — бинарное неорганическое соединение алюминия с углеродом. Химическая формула — 
Устойчиво до 1400 °C.
Содержание
Получение
Карбид алюминия получается прямой реакцией алюминия с углеродом в дуговой печи [1] :
Небольшое количество карбида алюминия является нормой в примеси технического карбида кальция. В электролитическом производстве алюминия данное соединение получается как продукт коррозии в графитовых электродах.
Получается при реакции углерода с оксидом алюминия:
Химические свойства
При реакции с водой или разбавленными кислотами карбид алюминия образует метан:

Реагирует с концентрированным гидроксидом натрия и водой, образуя комплексную соль — тетрагидроксоалюминат натрия и метан:
Физические свойства
Применение
Карбид алюминия, характеристика, свойства и получение, химические реакции
Карбид алюминия, характеристика, свойства и получение, химические реакции.
Карбид алюминия – неорганическое вещество, имеет химическую формулу Al4C3.
Краткая характеристика карбида алюминия:
Карбид алюминия – неорганическое вещество желтовато-коричневого цвета, соединение алюминия и углерода.
Карбид алюминия представляет собой желтовато-коричневатые кристаллы.
Химическая формула карбида алюминия Al4C3.
Карбид алюминия имеет необычную кристаллическую структуру, которая состоит из чередующихся слоев Al2C и Al2C2.
Соединение является очень устойчивым к воздействию внешней среды. Оно имеет высокую температуру плавления – 2100 о С.
Растворяется в расплавленном алюминии, снижая склонность алюминия к ползучести.
Карбид алюминия имеет приблизительно такую же твердость как у топаза.
Физические свойства карбида алюминия:
| Наименование параметра: | Значение: |
| Химическая формула | Al4C3 |
| Синонимы и названия иностранном языке | aluminum carbide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | желтовато-коричневые гексагональные кристаллы |
| Цвет | желтовато-коричневый |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 25 °C), кг/м 3 | 2360 |
| Плотность (состояние вещества – твердое вещество, при 25 °C), г/см 3 | 2,36 |
| Температура кипения, °C | — |
| Температура плавления, °C | 2100 |
| Температура разложения, °C | > 2200 |
| Молярная масса, г/моль | 143,96 |
Получение карбида алюминия:
Карбид алюминия получается в результате следующих химических реакций:
4Al + 3C → Al4C3 (t = 1500-1700 о С).
Небольшие количества карбида алюминия также образуются в качестве примеси при получении технического карбида кальция. Кроме того, при электролитическом производстве алюминия карбид алюминия образуется как продукт коррозии графитовых электродов.
Химические свойства карбида алюминия. Химические реакции карбида алюминия:
1. реакция карбида алюминия и водорода:
2. реакция карбида алюминия и кислорода:
В результате реакции образуются оксид алюминия и оксид углерода (IV).
3. реакция карбида алюминия и хлора:
В результате реакции образуются хлорид алюминия и хлорид углерода (IV) (тетрахлорметан).
4. реакция карбида алюминия, гидроксида натрия и воды:
5. реакция карбида алюминия и азотной кислоты:
Аналогичные реакции карбида алюминия происходят и с другими кислотами.
6. реакция разложения карбида алюминия (реакция карбида алюминия и воды):
7. реакция термического разложения карбида алюминия:
Al4C3 → 4Al + 3C (t > 2200 о С).
Применение и использование карбида алюминия:
Карбид алюминия используется лишь в нескольких отраслях:
– в качестве добавки при производстве алюминия и алюминиевых сплавов (в целях снижения ползучести алюминия ).
Примечание: © Фото https://www.pexels.com, https://pixabay.com

карбид алюминия реагирует кислота 1 2 3 4 5 вода соль гидролиз цинка
уравнение реакций соединения масса взаимодействие масса карбида алюминия
реакции
Справочники
Мировая экономика
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Вода + карбид алюминия что будет?
Получение
Карбид алюминия получается прямой реакцией алюминия с углеродом в дуговой печи:
Небольшое количество карбида алюминия является нормой в примеси технического карбида кальция. В электролитическом производстве алюминия данное соединение получается как продукт коррозии в графитовых электродах.
Получается при реакции углерода с оксидом алюминия:
Химические свойства
При реакции с водой или разбавленными кислотами карбид алюминия образует метан:
Реагирует с водородом:
Реагирует с концентрированным гидроксидом натрия и водой, образуя комплексную соль — тетрагидроксоалюминат натрия и метан:
Физические свойства
Видео
Физические свойства карбида алюминия:
| Наименование параметра: | Значение: |
| Химическая формула | Al4C3 |
| Синонимы и названия иностранном языке | aluminum carbide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | желтовато-коричневые гексагональные кристаллы |
| Цвет | желтовато-коричневый |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 25 °C), кг/м 3 | 2360 |
| Плотность (состояние вещества – твердое вещество, при 25 °C), г/см 3 | 2,36 |
| Температура кипения, °C | — |
| Температура плавления, °C | 2100 |
| Температура разложения, °C | > 2200 |
| Молярная масса, г/моль | 143,96 |
Применение и использование карбида алюминия:
Карбид алюминия используется лишь в нескольких отраслях:
– в качестве добавки при производстве алюминия и алюминиевых сплавов (в целях снижения ползучести алюминия ).
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Найти что-нибудь еще? 

карбид алюминия реагирует кислота 1 2 3 4 5 вода соль гидролиз цинка уравнение реакций соединения масса взаимодействие масса карбида алюминия реакции