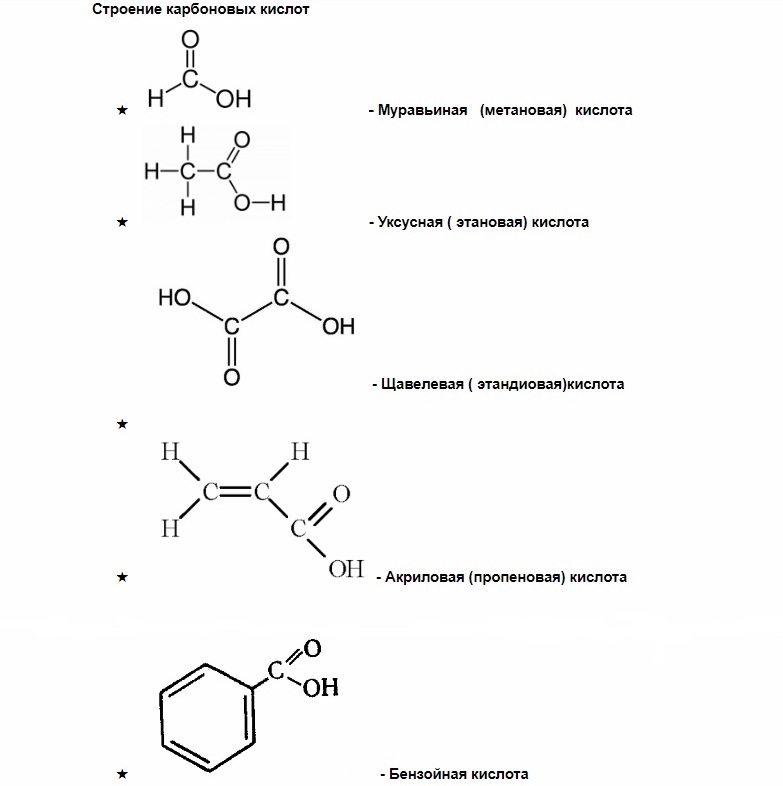
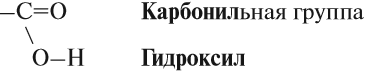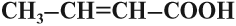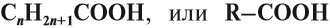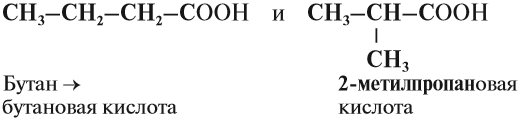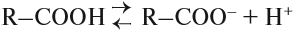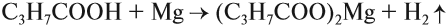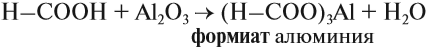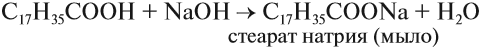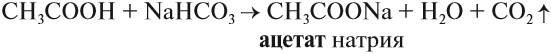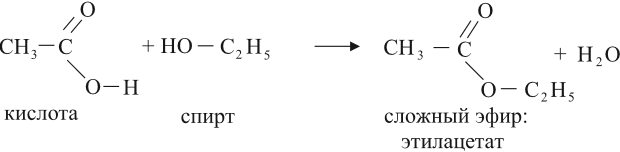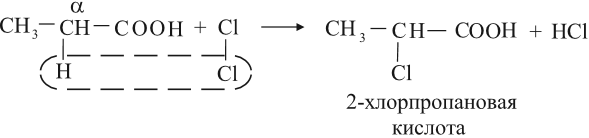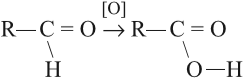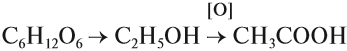Карбоновые кислоты
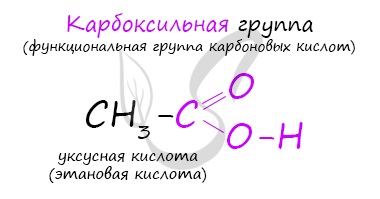
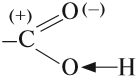
Карбоксильная группа, в свою очередь, делится на карбонильную группу С=О и гидроксильную группу О-Н.
Карбоновые кислоты — группа органических веществ, в состав которых входят одна или несколько карбоксильных групп и углеводородный радикал (алкил).
Как вы можете заметить, у муравьиной кислоты одна группа СООН, у щавелевой две, а у лимонной – целых три.
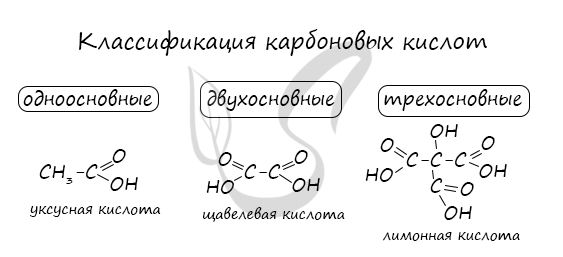
По количеству карбоксильных групп карбоновые кислоты делятся на
В зависимости от структуры углеводородного радикала карбоновые кислоты делятся на
насыщенные — (муравьиная, щавелевая) — все связи углерода одинарные.
ненасыщенные (олеиновая, линолевая) — в составе радикала, между атомами углерода есть двойные связи.
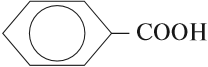
ароматические (бензойная) — в составе радикала есть бензольное кольцо. Хотя имеют специфический запах все карбоновые кислоты, эта группа особенно ароматна.
Номенклатура карбоновых кислот.
Некоторые карбоновые кислоты имеют свои народные или тривиальные названия: муравьиная, уксусная, лимонная и т.д.
Также есть официальное название кислоты в зависимости от углеводородного радикала.
Для того, чтобы правильно назвать карбоновую кислоту, нужно:
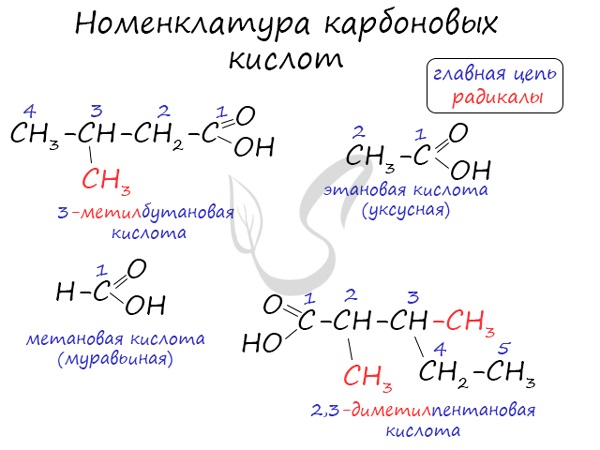
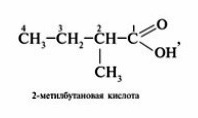
1.Определить и пронумеровать самую длинную (главную) углеродную цепочку, считая от атома карбоксильной группы.
2. Назвать согласно номенклатуре углеводород (как это сделать, можно посмотреть в учебнике Химия.10 класс под редакцией Габриеляна на портале LECTA)
Получение карбоновых кислот
Первой открыли и начали использовать уксусную кислоту. Как и большинство открытий, произошло это случайно. Содержимое одной из винных бутылок, простояв дольше нужного времени, превратилось из вина в уксус.
На языке науки эта несложная реакция называется окислением спиртов.
Поскольку большинство из карбоновых кислот входят в состав природных продуктов, до сих пор около 30% получают из биологических объектов.
Однако карбоновые кислоты активно используются в фармацевтической, кожевенной, металлообрабатывающей промышленности и получать их химическим путем быстрее и дешевле. Одно дело год ждать превращения уксуса в вино, и совсем другое — окислить подходящий углеводород, добытый на месторождении полезных ископаемых.
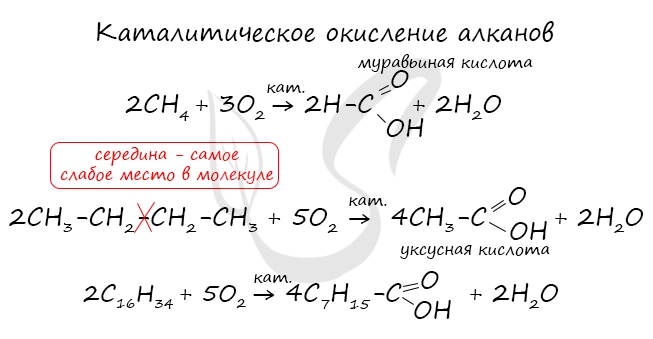
Муравьиная кислота — в ряду карбоновых кислот эта самая скромная кислота с единственным атомом углерода в структуре обладает уникальными свойствами за счет одновременного присутствия в структуре карбонильной и карбоксильной групп.
При реакции муравьиной кислоты с аммиачным раствором оксида серебра образуется блестящий осадок — реакция серебряного зеркала.
HCOOH + Ag2O (аммиачный раствор) 
Больше интересных материалов:
Способы получения карбоновых кислот в химической промышленности
1. При помощи различных катализаторов (оксид серебра, перманганат калия) окислить подходящий альдегид
2 RCHO + O2 
2. При помощи катализатора провести реакцию окисления спиртов
RCH2OH + O2 
3. При помощи окисления различных углеводородов (алкинов, алкенов, алкилбензолов) можно получить соответствующие карбоновые кислоты.
2 C4H10 + 5O2 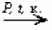
Физические свойства карбоновых кислот
Поскольку, карбоновые кислоты довольно разнородная группа веществ, говорить об общих физических свойствах, характерных для всех представителей группы неправомерно.
По количеству атомов углерода, входящих в состав вещества, карбоновые кислоты делятся на:
низшие — количество атомов от 1 до 3 — (муравьиная кислота) прозрачные жидкости с характерным запахом, отлично растворяются в воде
средние — количество атомов от 4 до 9 — ( валериановая кислота) жидкости с резким, неприятным запахом. маслянистые на ощупь.
высшие — количество атомов превышает 9 — (олеиновая кислота) — твердые вещества, нерастворяются в воде.
Молекулярная масса кислоты влияет на температуры плавления и кипения.
Плотность карбоновых кислот (за исключением муравьиной и уксусной кислот) меньше единицы.
Химические свойства карбоновых кислот.
1. Карбоновые кислоты обратимо диссоциируют. Проверить это можно с помощью лакмусовой бумажки. Она покраснеет, как в растворе любой кислоты.
Чем длиннее радикал, тем меньше степень диссоциации, и тем меньше проявляются кислотные свойства.
2. Карбоновые кислоты по своей природе являются слабыми кислотами, и участвуют во всех реакциях, характерных для неорганических кислот. Реагируют с солями, металлами, оксидами и гидроксидами металлов. В результате образуются соли карбоновых соединений и вода.
Карбоновые кислоты. Свойства и применение карбоновых кислот
Все началось с уксуса, по крайней мере, открытие карбоновых кислот. Название объединяет органические соединения, содержащие карбоксильную группу COOH.
Важно расположение атомов именно в таком порядке, поскольку есть и другие кислородосодержащие соединения.
Уксусную кислоту из карбоновых открыли первой, но ее строение многие века оставалось тайной. Вещество знали, как продукт скисания вин.
Свойства карбоновых кислот
Отличаясь от другой органики наличием карбоксильных групп, карбоновые кислоты классифицируются по их числу.
Есть одно-, двух-, и многоосновные соединения. Одноосновные карбоновые кислоты выделяются связью между карбоксильной группой и углеводородным радикалом.
Соответственно, общая формула веществ группы: — CnH2n+1COOH. Уксусная кислота – одноосновная. Ее химическая запись: — CH3COOH. Еще проще строение муравьиного соединения: — COCOOH.
К простейшим отнесена и пропионовая кислота с формулой C2H5COOH. У остальных соединений одноосновного ряда есть изомеры, то есть, разные варианты строения.
У муравьиной же, уксусной и пропионовой кислот есть лишь один план строения.
Если у карбоновой кислоты формула с двумя карбоксильными группами, она может называться диосновной.
Общая запись веществ категории: — COOH-R-COOH. Как видно, карбоксильные группы располагаются по разные стороны линейной молекулы.
Подразделяют карбоновые соединения и по характеру углеводородного радикала. Химические связи между его атомами могут быть одинарными.
В этом случае перед нами предельные карбоновые кислоты. Наличие двойных связей указывает на непредельные вещества.
Формула непредельных карбоновых кислот может одновременно являться записью высших представителей класса.
Высшими называют соединения, в которых боле 6-ти атомов углерода. Соответственно, от 1-го до 5-ти атомов углерода – признак низших веществ.
Имея органическое происхождение, большинство карбоновых кислот пахнут, хотя бы слегка. Однако, есть группа особенно ароматных.
В их состав входит бензольное ядро. То есть, кислоты группы являются производными бензола. Его формула: — C6H6.
У вещества сладковатый запах. Поэтому, карбоновые кислоты с бензольным ядром именуют ароматическими. Причем, обязательна прямая связь ядра и карбоксильных групп.
По физическому состоянию карбоновые кислоты бывают, как жидкими, так кристаллическими. Имеется в виду агрегатность веществ при обычных условиях.
Часть соединений растворима в воде, другая часть смешивается лишь с органикой. Нюансы химического поведения зависят от количества в молекулах карбоксильных групп.
Так, типичная реакция карбоновых кислот одноосновной категории– окрашивание лакмусовой бумаги в красный цвет.
Классикой, так же, считается взаимодействие с галогенами, тогда как дикарбоновые соединения могут образовывать эфиры карбоновых кислот. Они «рождаются» во взаимодействии со спиртами.
Карбоновая кислота с двумя основаниями всегда содержит метиленовую группу, то есть, двухвалентную CH2.
Двухосновные соединения образуют, так же, соли карбоновых кислот. Они используются на производстве моющих средств, в частности, мыла.
Впрочем, о том, где пригождаются карбоновые кислоты и их соединения, поговорим отдельно.
Применение карбоновых кислот
В производстве мыла особенно важны стеариновая и пальмитиновая кислоты. То есть, используются высшие соединения.
Они делают мыльные брикеты твердыми и позволяют смешать фракции, расслаивающие без присутствия кислот.
Способность делать массы однородными пригождается и на производстве лекарств. Большинство связующих элементов в них – карбоновые кислоты.
Соответственно, применение реагентов внутрь, как и наружно, безопасно. Главное, знать предельную дозировку.
Превышение дозы, или концентрации кислот, ведет к разрушительным последствиям. Возможны химические ожоги, отравления.
Зато, едкость соединений наруку металлургам, мебельщикам, рестовраторам. Им карбоновые кислоты и смеси с ними помогают полировать и очищать неровные, заржавевшие поверхности.
Растворяя верхний слой металла, реагенты улучшают его внешний вид и эксплуатационные характеристики.
Химические карбоновые кислоты могут быть очищенными, или же, техническими. Для работы с металлами подойдут и последние.
Но, в качестве косметических и лекарственных средств применяют лишь высокоочищенные соединения. Такие нужны и в пищевой промышленности.
Около трети карбоновых кислот – официально зарегистрированные добавки, известные простым обывателям, как ешки.
На упаковках они отмечаются букврй Е и порядковым номером рядом с ней. Уксусная кислота, к примеру, пишется, как Е260.
Пищей карбоновые кислоты могут служить и для растений, входя в состав удобрений. Одновременно, можно создавать яды для вредоносных насекомых и сорняков.
Около трети карбоновых соединений используют в качестве протрав для тканей. Обработка необходима, чтобы материи равномерно окрашивались. С этой же целью реактивы применяют в кожевенной промышленности.
Добыча карбоновых кислот
Поскольку карбоновые кислоты биогенны, около 35% из них получают из природных продуктов. Но, химический синтез выгоднее.
Поэтому, при возможности переходят на него. Так, гиалуроновую кислоту, используемую для омоложения, долгое время добывали из пуповин младенцев и глаз крупного рогатого скота.
Теперь же, соединение получают биохимическим способом, выращивая на пшеничном субстрате бактерий, беспрерывно дающих кислоту.
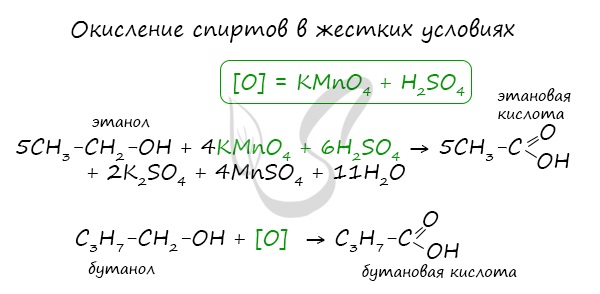
Получение карбоновых кислот чисто химическим путем – это окисление спиртов и альдегидов.
Под последним понятием скрываются спирты, лишенные водорода. Реакция протекает так: — СН3 – СН2ОН → СН3 – СОН → СН3 – СООН.
От схемы производства, количества его ступеней, расходных материалов, во многом зависит стоимость конечных продуктов. Узнаем, каков ценник на карбоновые кислоты в их чистом виде.
Цена карбоновых кислот
Большинство карбоновых кислот продают большими объемами. Фасуют, обычно, по 25-35 килограммов. Жидкости разливают в канистры.
Так, 1000 граммов лимонной кислоты стоит в районе 80-ти рублей. Столько же берут за муравьиную и щавелевую.
Стоимость олеиновой – около 130-ти рублей за килограмм. Салициловая кислота оценивается уже в 300. Стеариновая кислота на 50-70 рублей дешевле.
Ряд карбоновых кислот оценивается в долларах, поскольку основные поставки ведутся из США и стран Евросоюза.
Оттуда поступает, к примеру, гиалуроновая кислота. За килограмм отдают уже не пару сотен рублей, а несколько сот баксов.
Отечественный продукт присутствует, но ему не доверяют, в первую очередь, клиенты салонов красоты.
Они знают, что омоложение с помощью гиалуроновой кислоты – придумка американцев, практикуемая ими полвека.
Соответственно, велика практика производства препарата, который должен быть качественным, ведь попадает в кожу и организм.
Карбоновые кислоты
Классификация карбоновых кислот
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
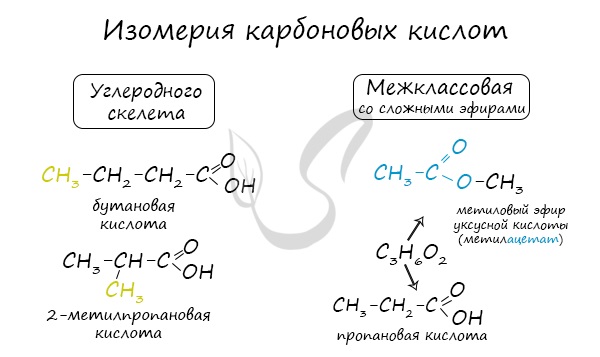
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
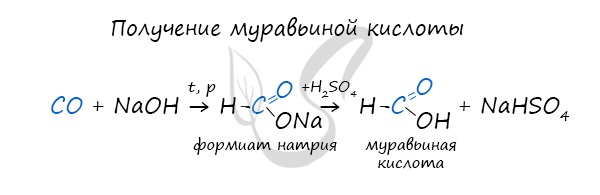
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
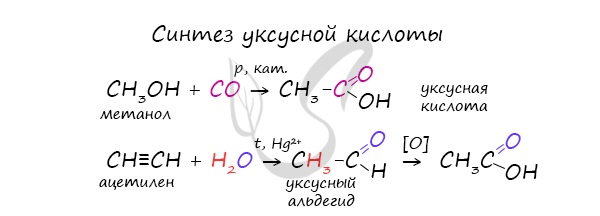
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
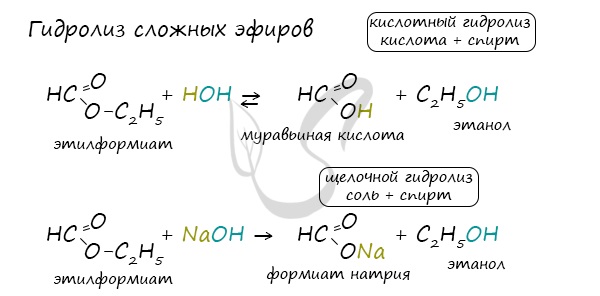
Сложные эфиры
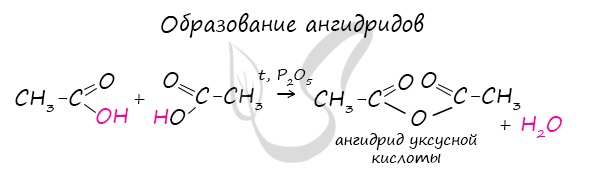
Ангидриды
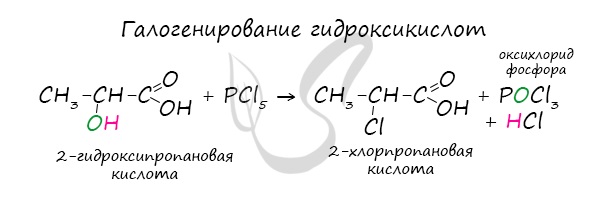
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
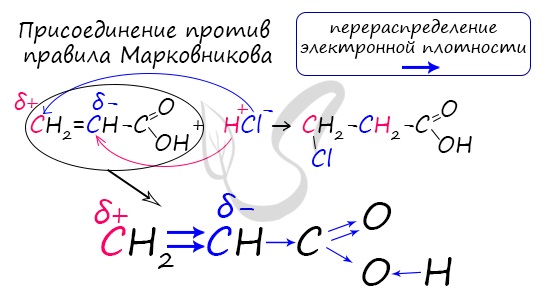
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Урок 24. Карбоновые кислоты
Определение
Карбоновые кислоты — это производные углеводородов, в молекулах которых содержится одна или несколько карбоксильных групп:
Карбоксильная группа имеет сложный состав. Она состоит из карбонильной и гидроксильной (гидроксо) групп:
Карбоновые кислоты часто встречаются в природе, придавая ягодам и фруктам, а также некоторым другим продуктам питания кислый вкус. Их делят на различные группы (классы) по некоторым признакам:
в углеводородном радикале только простые связи;
– Непредельные (в углеводородном радикале есть кратная связь);
в углеводородном радикале есть кратная связь;
имеется бензольное кольцо.
Задание 24.1. Определите состав этих кислот.
Для того чтобы различить по составу предельные и непредельные кислоты, нужно умножить на два число атомов углерода в углеводородном радикале и сравнить полученную величину (С) с числом атомов водорода (В) в углеводородном радикале:
Предельные одноосновные карбоновые кислоты образуют гомологический ряд с общей формулой:
Вопрос. По какому принципу составляются названия кислот?
Для того чтобы составить название кислоты, нужно:
Кроме того, для кислот чаще всего используют тривиальные названия (муравьиная, уксусная), которые указывают на происхождение кислоты или её отличительные признаки. Например, название муравьиная указывает, что эта кислота входит в состав жгучего сока муравьёв. А слово «уксусная» происходит от греческого слова «оксос», что означает «кислый». Запомните некоторые из этих названий:
Задание 24.3. Назовите по ИЮПАК пропионовую и масляную кислоты.
Если вы выполнили вышеизложенные правила, у вас получилось: пропановая кислота, бутановая кислота.
Начиная с n = 3, у кислот появляются изомеры. Изомерия предельных кислот связана со строением углеводородного радикала:
Задание 24.4. Составьте молекулярные формулы этих кислот и убедитесь, что это изомеры.
Строение молекул
В состав карбоксильной группы входит гидроксогруппа ОН.
Вопрос. В каких соединениях встречается функциональная группа ОН?
Такая же группа входит в состав молекул спиртов. Спирты проявляют очень слабые кислотные свойства, могут вступать в реакции только с очень активными, щелочными металлами, не изменяют окраску индикатора, не реагируют с растворами щелочей.
Если в раствор карбоновой кислоты добавить индикатор (лакмус), то раствор окрасится в красный цвет. Это означает, что кислоты проявляют более кислые свойства, чем спирты. Почему? Потому что карбонильная группа, которая расположена рядом с гидроксогруппой, влияет на неё.
Карбонильная группа, которая входит в состав карбоксильной группы, имеет (+) на атоме углерода. За счёт этого небольшого положительного заряда происходит смещение общих электронных пар связей «С–О» и «О–Н», поэтому эти связи становятся более полярными:
Таким образом, карбонильная группа увеличивает полярность связи О–Н, делая её более полярной. Поэтому атом водорода карбоксильной группы становится очень подвижным. Он легко замещается на атом металла, способен отщепляться в растворах: кислоты диссоциируют:
Гидроксогруппа тоже влияет на карбонильную группу, делая ее неактивной, поэтому кислоты не участвуют в реакциях с разрывом π-связи карбонильной группы.
Карбоксильная группа влияет на углеводородный радикал, делая некоторые связи С–Н в нём более полярными, и кислоты могут участвовать в реакциях замещения атомов водорода радикала.
Свойства кислот
Физические свойства
Кислоты с небольшим числом атомов углерода (1–10) — жидкости с резким запахом. Вкус у них разный — уксусная кислота — кислая, а масляная — горькая. Низшие кислоты растворимы в воде, причём с увеличением длины радикала их растворимость ухудшается.
Например, уксусная кислота — бесцветная жидкость с резким запахом. Смешивается с водой в любых соотношениях. 60…90 %-ные растворы уксусной кислоты (уксусная эссенция) опасны для жизни, в то время как 6…8 %-ные растворы столового уксуса широко применяются при приготовлении пищи.
Высшие кислоты, например стеариновая кислота, твёрдые, нерастворимые в воде вещества, лишённые запаха. Смесь таких кислот называется «стеарин». Из стеарина делают свечи.
Химические свойства
Кислоты проявляют все свойства неорганических кислот.
Вопрос. Какие свойства кислот вам известны?
Кислоты реагируют с металлами, которые стоят в ряду напряжений до водорода:
При составлении таких реакций следует помнить, что
В результате такой реакции образуется соль и выделяется водород.
Кислоты реагируют с основными и амфотерными оксидами:
В этом случае образуется соль и вода. Такие же продукты реакции образуются при взаимодействии кислоты и основания:
Большинство карбоновых кислот — слабые кислоты. Тем не менее они могут вытеснять более слабые кислоты из их солей:
Итак, во всех этих реакциях образуются соли. Названия солей происходят от латинских названий кислот. Запомните эти названия!
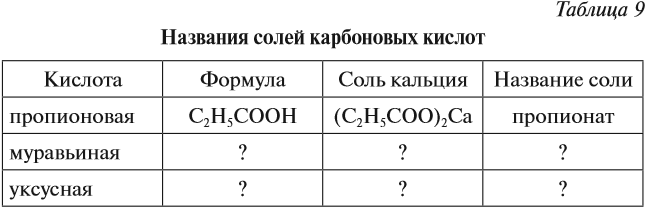
Задание 24.5. Составьте для известных Вам карбоновых кислот таблицу по схеме:
Названия солей см. выше (в уравнениях химических реакций).
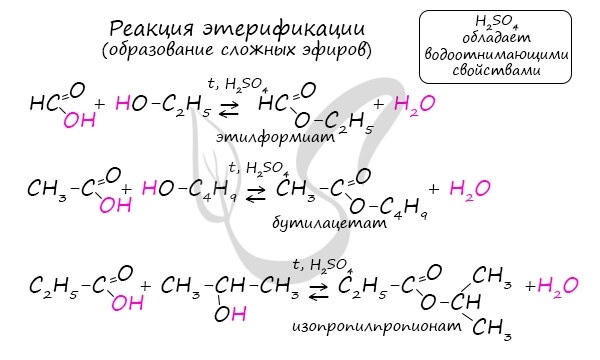
Кислоты могут реагировать со спиртами, в результате получаются сложные эфиры:
Это реакция этерификации. Она происходит в присутствии концентрированной серной кислоты. (Подробнее о названиях и свойствах сложных эфиров см. урок 25.)
Кислоты могут реагировать с галогенами за счёт углеводородного радикала, при этом на атом галогена замещается атом водорода у ближайшего к карбоксильной группе атома углерода (это α-углеродный атом):
Получение и применение кислот
Кислоты можно получить при помощи окисления соответствующего альдегида:
Задание 24.6. Какой альдегид нужно взять для получения уксусной кислоты? 2-метилпропановой кислоты? Составьте уравнения реакций.
Вопрос. В каких условиях происходят процессы окисления альдегидов? Являются ли эти реакции качественными на альдегидную группу?
Некоторые (жирные) кислоты входят в состав жиров (см. урок 25).
Выводы
Кислоты — это производные углеводородов, содержащие карбоксильную группу. Для них характерны реакции:
Кислоты входят в состав различных овощей, фруктов и других пищевых продуктов. Используются при приготовлении пищи, например уксус.