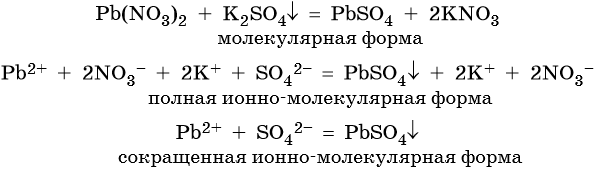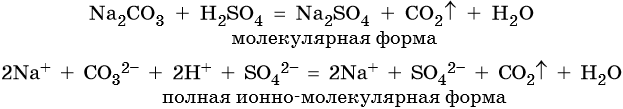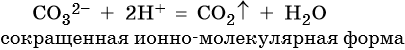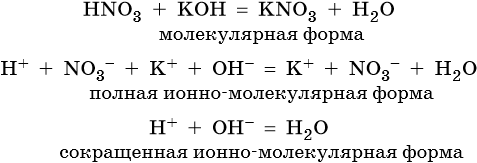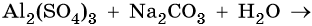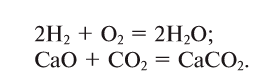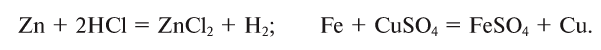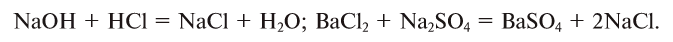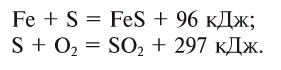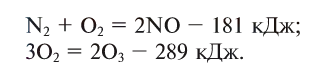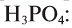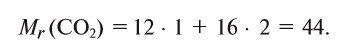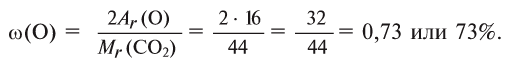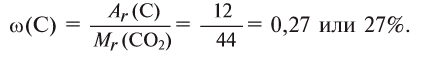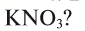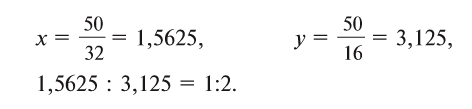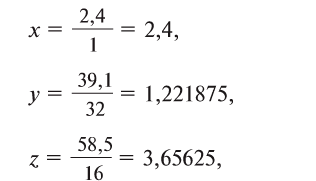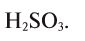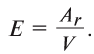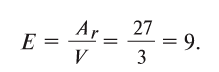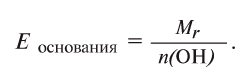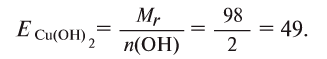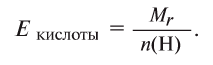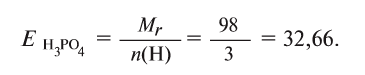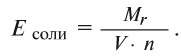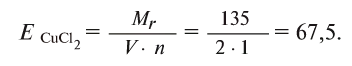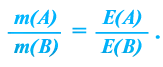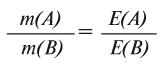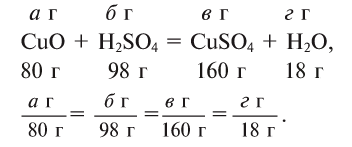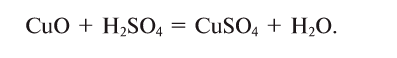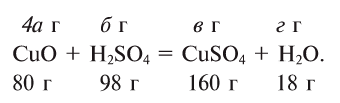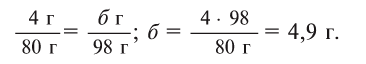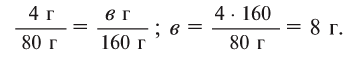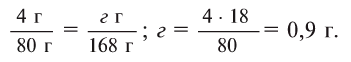1.4.6. Реакции ионного обмена.
Реакции ионного обмена — реакции в водных растворах между электролитами, протекающие без изменений степеней окисления образующих их элементов.
Необходимым условием протекания реакции между электролитами (солями, кислотами и основаниями) является образование малодиссоциирующего вещества (вода, слабая кислота, гидроксид аммония), осадка или газа.
Расcмотрим реакцию, в результате которой образуется вода. К таким реакциям относятся все реакции между любой кислотой и любым основанием. Например, взаимодействие азотной кислоты с гидроксидом калия:
Исходные вещества, т.е. азотная кислота и гидроксид калия, а также один из продуктов, а именно нитрат калия, являются сильными электролитами, т.е. в водном растворе они существуют практически только в виде ионов. Образовавшаяся вода относится к слабым электролитам, т.е. практически не распадается на ионы. Таким образом, более точно переписать уравнение выше можно, указав реальное состояние веществ в водном растворе, т.е. в виде ионов:
Уравнения вида (3) называют сокращенными ионными уравнениями, вида (2) — полными ионными уравнениями, а вида (1) — молекулярными уравнениями реакций.
Фактически ионное уравнение реакции максимально отражает ее суть, именно то, благодаря чему становится возможным ее протекание. Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
Соляная кислота, гидроксид бария и хлорид бария являются сильными электролитами, то есть существуют в растворе преимущественно в виде ионов. Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
2H + + 2Cl − + Ba 2+ + 2OH − = Ba 2+ + 2Cl − + 2H2O
Сократим одинаковые ионы слева и справа и получим:
Разделив и левую и правую часть на 2, получим:
Полученное сокращенное ионное уравнение полностью совпадает с сокращенными ионным уравнением взаимодействия азотной кислоты и гидроксида калия.
При составлении ионных уравнений в виде ионов записывают только формулы:
1) сильных кислот (HCl, HBr, HI, H2SO4, HNO3, HClO4 ) (список сильных кислот надо выучить!)
2) сильных оснований (гидроксиды щелочных (ЩМ) и щелочно-земельных металлов(ЩЗМ))
3) растворимых солей
В молекулярном виде записывают формулы:
1) Воды H2O
2) Слабых кислот (H2S, H2CO3, HF, HCN, CH3COOH (и др. практически все органические)).
3) Слабых оcнований («NH4OH» и практически все гидроксиды металлов кроме ЩМ и ЩЗМ.
4) Малорастворимых солей (↓) («М» или «Н» в таблице растворимости).
5) Оксидов (и др. веществ, не являющихся электролитами).
Попробуем записать уравнение между гидроксидом железа (III) и серной кислотой. В молекулярном виде уравнение их взаимодействия записывается следующим образом:
Сократив сульфат-ионы слева и справа, получаем:
разделив обе части уравнения на 2 получаем сокращенное ионное уравнение:
Теперь давайте рассмотрим реакцию ионного обмена, в результате которой образуется осадок. Например, взаимодействие двух растворимых солей :
Все три соли – карбонат натрия, хлорид кальция, хлорид натрия и карбонат кальция (да-да, и он тоже) – относятся к сильным электролитам и все, кроме карбоната кальция, растворимы в воде, т.е. есть участвуют в данной реакции в виде ионов:
2Na + + CO3 2- + Ca 2+ + 2Cl − = CaCO3↓+ 2Na + + 2Cl −
Сократив одинаковые ионы слева и справа в данном уравнении, получим сокращенное ионное:
Последнее уравнение отображает причину взаимодействия растворов карбоната натрия и хлорида кальция. Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакция соли1 с солью2 протекала, помимо базовых требований к протеканиям ионных реакций (газ, осадок или вода в продуктах реакции), на такие реакции накладывается еще одно требование – исходные соли должны быть растворимы. То есть, например,
реакция не идет, хотя FeS – потенциально мог бы дать осадок, т.к. нерастворим. Причина того что реакция не идет – нерастворимость одной из исходных солей (CuS).
протекает, так как карбонат кальция нерастворим и исходные соли растворимы.
То же самое касается взаимодействия солей с основаниями. Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
т.к. Cu(OH)2 нерастворим, хотя потенциальный продукт CuS был бы осадком.
А вот реакция между NaOH и Cu(NO3)2 протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
Внимание! Ни в коем случае не распространяйте требование растворимости исходных веществ дальше реакций соль1+ соль2 и соль + основание.
Например, с кислотами выполнение этого требования не обязательно. В частности, все растворимые кислоты прекрасно реагируют со всеми карбонатами, в том числе нерастворимыми.
1) Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
2) Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть осадок или гидроксид аммония.
Рассмотрим третье условие протекания реакций ионного обмена – образование газа. Строго говоря, только в результате ионного обмена образование газа возможно лишь в редких случаях, например, при образовании газообразного сероводорода:
В большинстве же остальных случаев газ образуется в результате разложения одного из продуктов реакции ионного обмена. Например, нужно точно знать в рамках ЕГЭ, что с образованием газа в виду неустойчивости разлагаются такие продукты, как H2CO3, «NH4OH» и H2SO3:
(«NH4OH» — такая запись формулы в кавычках подразумевает, что в реальности вещества с такой формулой не существует. Формула используется для большей простоты промежуточных записей. В реальности вместо «гидроксида аммония» правильнее писать формулу гидрата аммиака NH3·H2O).
Другими словами, если в результате ионного обмена образуются угольная кислота, гидроксид аммония или сернистая кислота, реакция ионного обмена протекает благодаря образованию газообразного продукта:
Запишем ионные уравнения для всех указанных выше реакций, приводящих к образованию газов. 1) Для реакции:
В ионном виде будут записываться сульфид калия и бромид калия, т.к. являются растворимыми солями, а также бромоводородная кислота, т.к. относится к сильным кислотам. Сероводород же, являясь малорастворимым и плохо диссоциирцющим на ионы газом, запишется в молекулярном виде:
2K + + S 2- + 2H + + 2Br — = 2K + + 2Br — + H2S↑
Сократив одинаковые ионы получаем:
В ионном виде запишутся Na2CO3, Na2SO4 как хорошо растворимые соли и H2SO4 как сильная кислота. Вода является малодиссоциирующим веществом, а CO2 и вовсе неэлектролит, поэтому их формулы будут записываться в молекулярном виде:
Полное и сокращенное уравнение будут иметь вид:
Обменные реакции
Реакциями ионного обмена называют химические реакции, которые протекают между ионами без изменения степеней окисления элементов и приводят к обмену составных частей реагентов.
Уравнения обменных реакций записывают в молекулярной форме (с указанием формул всех реагирующих веществ со стехиометрическими коэффициентами); в полной ионной форме (с указанием всех существующих в растворе ионов) и в сокращенной ионной форме (с указанием только тех ионов, которые непосредственно взаимодействуют между собой).
При написании уравнений реакций в ионной форме формулы малодиссоциирующих веществ (слабых электролитов) записывают в молекулярной форме.
Уравнения реакций обмена в водных растворах электролитов составляют так.
Реакции ионного обмена в растворах электролитов протекают практически необратимо и до конца, если в качестве продуктов образуются осадки (малорастворимые вещества), газы (легколетучие вещества), слабые электролиты (малодиссоциирующие соединения) и комплексные ионы.
Если при взаимодействии растворов электролитов не образуется ни одно из указанных видов соединений, химическое взаимодействие практически не происходит.
Уравнения обменных реакций можно записать в молекулярной форме, полной ионной форме, с указанием всех существующих в растворе ионов и в сокращенной ионной форме, которая, собственно, и выражает взаимодействие ионов. Следует отметить, что при написании уравнений реакций в ионной форме малодиссоциирующие вещества (слабые электролиты) записывают в молекулярной форме.
Пример 1. Реакция между нитратом свинца и сульфатом калия. В результате этой реакции образуется нерастворимый сульфат свинца и выделяется растворимый нитрат калия:
Пример 2. Взаимодействие карбоната натрия с серной кислотой. При этом выделяется углекислый газ и вода, а в растворе остаются катионы натрия и сульфат-ионы:
Пример 3. Реакция между азотной кислотой и едким кали. В результате данной реакции образуется малодиссоциированное соединение — вода, и в растворе остаются катионы калия и нитрат-ионы:
Иногда в ходе обменных реакций образуются вещества, для которых в таблице растворимости приведены символы «–» (в водной среде разлагается или не существует) или «?» — нет достоверных сведений о существовании соединения. Это означает, что данное соединение водой разлагается на кислоту и основание.
Так, например, сульфид алюминия разлагается водой на Al(OH)3 и H2S, карбонат хрома (III) Cr2(CO3)3 разлагается на Cr(OH)3 и CO2 и т.д.
Пример 4. Реакция между водными растворами сульфата алюминия и карбоната натрия:
Теоретически в результате этой реакции должны образоваться сульфат натрия и карбонат алюминия. Однако последний в водном растворе не существует, а разлагается на Al(OH)3 и CO2. Следовательно, реакция пройдет следующим образом:
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
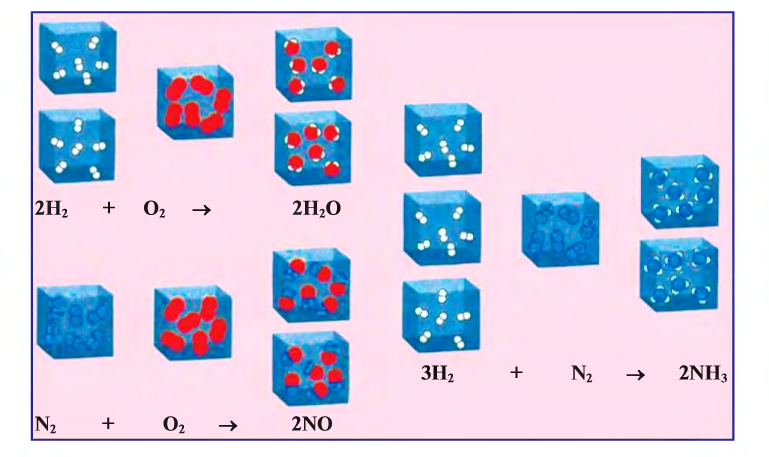
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Понятие о реакции
Курс органической химии рассматривает взаимодействия между соединениями, которые необходимы для жизнедеятельности человека и животных: белками, жирами, углеводами. Химическими принято называть такие процессы, которые протекают между веществами с получением иных соединений, отличающихся от исходных по свойствам и составу.

Реагентами именуют исходные соединения, а продуктами – конечные соединения.
Движущей силой процесса является природа реагентов, особенности продуктов, концентрация реагирующих компонентов, температура, давление.

Особенности взаимодействий
В переводе с латинского языка «реакция» означает «ответное действие, отпор».
Условия протекания
Среди тех факторов, которые необходимы для химического взаимодействия, выделяют:
Варианты классификации реакций
Сложно все процессы, сопровождающиеся изменением состава и свойств соединений, объединить в одну классификацию.
По возможности протекания процессов в прямом и обратном направлении неорганические и органические процессы делят на две группы.
Необратимо протекает реакция ионного обмена между растворами растворимых соединений в том случае, когда между ними образуется нерастворимый продукт. Это применяется в аналитической химии для качественного определения катионов (анионов) в смеси растворов.
К примеру, для обнаружения катионов бария (Ba2+) используют раствор, содержащий сульфат анион (SO4 2-).
Пример ионных уравнений, сопровождающихся выпадением осадка
Как правильно составить уравнение процессов, характерных для этого случая? Рассмотрим на примере этой реакции ионного обмена сокращенные ионные уравнения. Данный вопрос входит в курс школьной программы, поэтому заслуживает пристального рассмотрения.
Первым этапом является написание процесса в молекулярном виде.
Чтобы понять, действительно ли необратимо протекает реакция ионного обмена между растворами этих веществ, потребуется таблица растворимости кислот, солей, оснований. Одним из продуктов является сульфат бария (средняя соль), которая является нерастворимым соединением. Следовательно, процесс действительно необратим, сопровождается выпадением осадка.
Вторым этапом является запись полного ионного уравнения. Каждое из исходных соединений, продуктов взаимодействия записывается в виде катионов и анионов.
Ba2++ 2Cl-+2Na+ +SO42-=BaSO4+2Na+ + 2Cl-
В левой и правой частях данного уравнения положительные и отрицательные ионы, которые не связаны в осадок, малодиссоциируемое или газообразное соединение. После их сокращения получаем вариант краткого ионного уравнения.
Пример процесса с образованием газа
Когда еще могут протекать реакции ионного обмена? Примеры с решением, предполагающим образование газообразного вещества, приведем для карбоната. Качественным реактивом на анион CO32- является взаимодействие с катионов водорода. Итогом процесса является образование углекислого газа.
Представим взаимодействие в молекулярном и ионном виде.
Продуктами реакции является углекислый газ и вода, которые не распадаются на ионы. Представим взаимодействие в полном ионном виде.
После сокращения ионов, повторяющихся в левой и правой частях, получаем следующий вид данного процесса:
Получение малодиссоциируемого соединения
Какими еще признаками могут сопровождаться реакции ионного обмена? Примеры с решением приведем для классического процесса нейтрализации между раствором щелочи и кислоты.
Взаимодействие раствора соляной кислоты с гидроксидом натрия сопровождается образованием воды (малодиссоциируемого соединения). Проверить полноту протекания процесса можно с помощью индикатора. Если первоначально к щелочи добавить спиртовой раствор фенолфталеина, по мере добавления к нему соляной кислоты окраска будет исчезать (идет нейтрализация).
В молекулярном виде процесс выглядит следующим образом:
Краткое ионное уравнение отражает процесс нейтрализации:
Заключение
В отличие от других разновидностей химических процессов, ионный обмен происходит только между растворами сложных соединений. Также среди обязательных условий, которые связаны с подобными процессами, отметим их необратимость. В тех случаях, когда среди продуктов есть малодиссоциируемое соединение, газообразное вещество, осадок, то можно говорить о полноте протекания процесса.
Если в случае замещения у соединений меняются степени окисления, то в случае ионного обмена валентное состояние атомов не меняется. Такие процессы протекают между сложными веществами: солями, кислотами, основаниями, оксидами.
Частным случаем таких взаимодействий является нейтрализация между щелочью и кислотой. Они подчиняются законам химического равновесия, идут в том направлении, где одно из соединений удаляют из реакционной сферы в летучем, газообразном виде, или как малодиссоциируемое вещество.
Химическая реакция является сложным процессом, который предполагает превращение одних веществ в другие, которые отличаются от исходных по строению, составу. Только при наличии одного из трех признаков, перечисленных выше, можно вести речь о полноте протекания взаимодействия.
Содержание:
Типы химических реакций: присоединения, разложения, обмена и замещения:
Химические реакции подразделяются на несколько типов в зависимости от вступающих в реакцию исходных веществ (реагентов), количества образующихся продуктов реакции и выделения или поглощения энергии.
Рис. 17. Образование различных веществ (реакции присоединения)
По количеству образующихся и вступающих в реакцию компонентов их можно разделить на следующие типы:
Реакции присоединения
Реакции разложения
Реакции замещения
3. В реакциях замещения простое вещество, вступая в реакцию со сложным веществом, занимает место в составе сложного вещества, в результате образуются новое простое и сложное вещества: АВ + С = АС + В:
Реакции обмена
4. В реакциях обмена составные части сложных веществ взаимообмениваются: АВ + CD = AD + ВС:
В процессе протекания химических реакций может выделяться или поглощаться тепло.
Энергия, выделяющаяся в процессе химической реакции, называется химической энергией.
Химическая энергия может быть превращена в тепловую, световую, механическую и электрическую энергию.
В большинстве случаев химическая энергия превращается в тепловую энергию и наоборот.
Рис. 18. Экзотермические реакции
Количество выделяемой или поглощаемой во время химической реакции энергии называется тепловым эффектом (Q).
Тепловой эффект наблюдается в результате разрыва или возникновения химической связи и количественно выражается в килоджоулях (кДж).
Реакции, сопровождающиеся выделением тепла (энергии), называются экзотермическими (ekzo — наружу) (см. рис. 18). В этих реакциях тепловой эффект изображается знаком «+» (плюс).
Реакции, сопровождающиеся поглощением тепла (энергии), называются эндотермическими (endo — внутрь). В таких реакциях тепловой эффект обозначается знаком «—» (минус):
Расчет относительной молекулярной массы и количества вещества
Для определения относительной молекулярной массы вещества 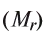
Например,
Зная относительную атомную массу водорода, фосфора и кислорода, вычисляем относительную молекулярную массу
1. Определите относительную молекулярную массу следующих веществ:
Расчет массовой доли элементов в сложных веществах
Массовые доли (содержание) элементов в составе вещества выражаются в процентах (%).
Найдем процент содержания (со) углерода и кислорода в углекислом газе
1. Вычисляем относительную молекулярную массу
2. Находим массовую долю кислорода в
3. Находим массовую долю углерода в
О т в е т: 73% О и 27% С.
1. Определите массовые доли элементов, входящих в состав следующих веществ:
2. Каковы массовые доли (%) S и О в составе оксида серы (IV)?
3. На предприятии «Ферганаазог» производится минеральное удобрение 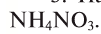
4. В каком из этих удобрений процентная доля азота наибольшая: 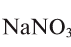
Определение формулы вещества по количественным отношениям входящих в его состав элементов
1. Определите формулу соединения, в состав которого входит 50% серы и 50% кислорода.
Из условия задания известно, что вещество содержит атомы серы (S) и кислорода (О). Следовательно, формулу вещества можно изобразить как 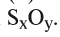
2. Определите формулу соединения, содержащего 2,4% Н, 39,1% S и 58,5% О.
Известно, что в состав вещества входят атомы Н, S и О. Искомая формула вещества будет иметь вид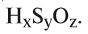
Из этого следует, что формула вещества —
Вычисление эквивалента простых и сложных веществ
Определение эквивалента простых веществ и элементов.
Эквивалент химического элемента (£) — отношение атомной массы 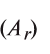
Пользуясь этой формулой, можно легко вычислить эквивалент элемента. Например, Аг алюминия — 27, а его валентность V — 3. Подставляя эти значения в формулу, находим его эквивалент:
Если элемент обладает переменной валентностью, то меняется и его эквивалент. Например, медь может иметь валентность 1 и 2, при этом в первом случае ее эквивалент будет равен 64, а во втором — 32.
Определение эквивалента оксидов
Чтобы определить эквивалент оксида, необходимо его относительную молекулярную массу 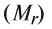
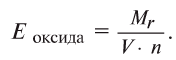
Например, эквивалент оксида меди (СиО) будет равен:
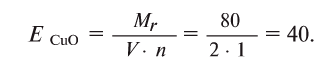
Определение эквивалента оснований
Для определения эквивалента оснований следует относительную молекулярную массу вещества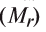
Например, эквивалент гидроксида меди 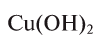
Определение эквивалента кислот
Для определения эквивалента кислот нужно относительную молекулярную массу вещества 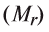
Например, эквивалент 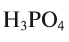
Определение эквивалента солей
Для определения эквивалента солей следует относительную молекулярную массу вещества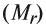
Например, эквивалент хлорида меди (II) 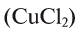
Решение задач на закон эквивалентов
Под эквивалентностью вещества понимают количество участвующего в определенной реакции вещества с 1 г водорода 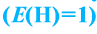
Вещества вступают в реакции пропорционально их эквивалентам.
При вступлении в реакцию вещества A и вещества В математическое выражение их эквивалентной закономерности будет следующим:
1. В составе оксида алюминия имеется 52,94% алюминия и 47,06% кислорода. Найдите эквивалент алюминия, если известно, что эквивалент кислорода равен 8.
Из условия задачи известно массовое соотношение А1 и О: 52,94 : 47,06
В соответствии с формулой
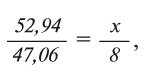
Следовательно, эквивалент алюминия А1 равен 9.
Расчеты по уравнениям химических реакций и закону сохранения массы
Массы всех веществ, участвующих в химических реакциях, находятся в постоянных пропорциональных соотношениях. Например:
Если известно количество хотя бы одного вступающего в реакцию вещества, то можно рассчитать количество других участвующих в реакции веществ.
Пример:
Сколько граммов 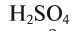
Напишем уравнение реакции:
Под формулами участвующих в реакции веществ запишем значения их молярных масс. Над уравнением запишем приведенные в условиях задачи значения масс веществ и те, которые необходимо найти:
Теперь находим, сколько серной кислоты нужно для реакции. Для этого составляем пропорцию и решаем ее:
Далее рассчитываем, сколько образуется сернокислой меди (II):
Теперь находим количество образовавшейся воды:
Ответ: 4,9 г серной кислоты, 8 г сульфата меди и 0,9 г воды.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.