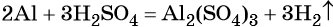Урок 12. Составление уравнений химических реакций
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.
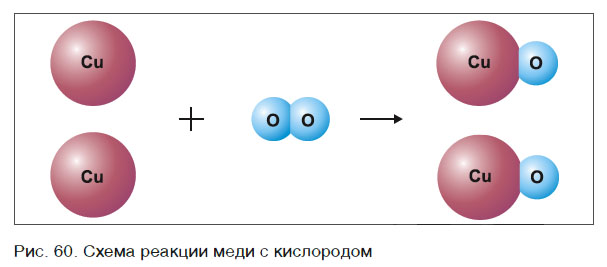
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
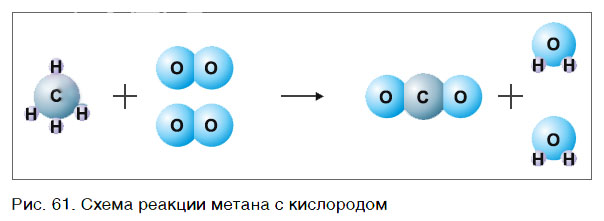
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Как пишется химическая реакция
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Химическое уравнение — это условная запись химической реакции с помощью формул и символов.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.

Интересное по рубрике
Найдите необходимую статью по тегам
Подпишитесь на нашу рассылку
Мы в инстаграм
Домашняя онлайн-школа
Помогаем ученикам 5–11 классов получать качественные знания в любой точке мира, совмещать учёбу со спортом и творчеством

Рекомендуем прочитать
Реальный опыт семейного обучения
Звонок по России бесплатный
Посмотреть на карте
Если вы не нашли ответ на свой вопрос на нашем сайте, включая раздел «Вопросы и ответы», закажите обратный звонок. Мы скоро свяжемся с вами.
Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
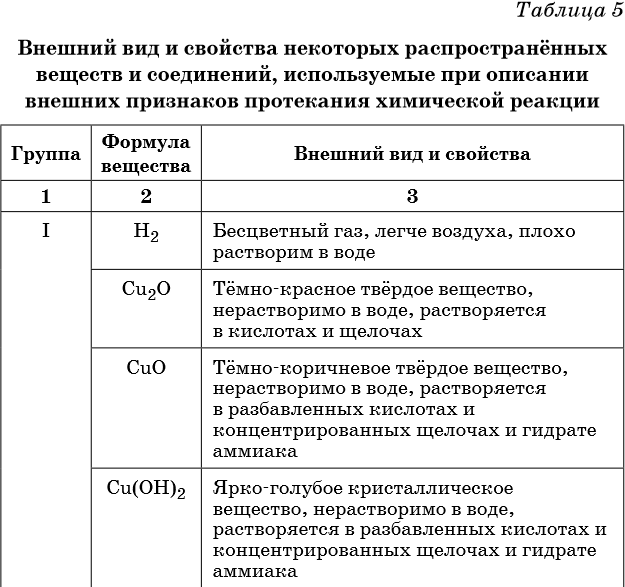
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
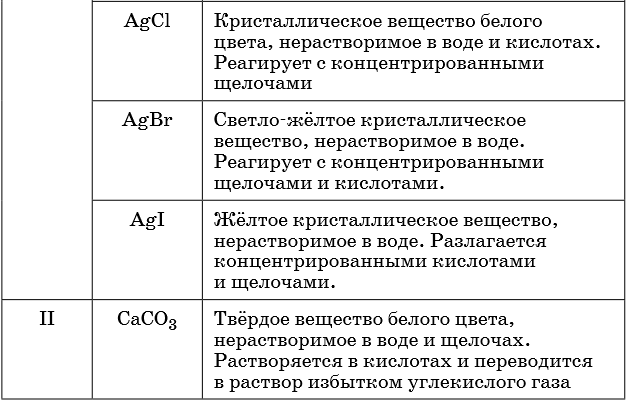
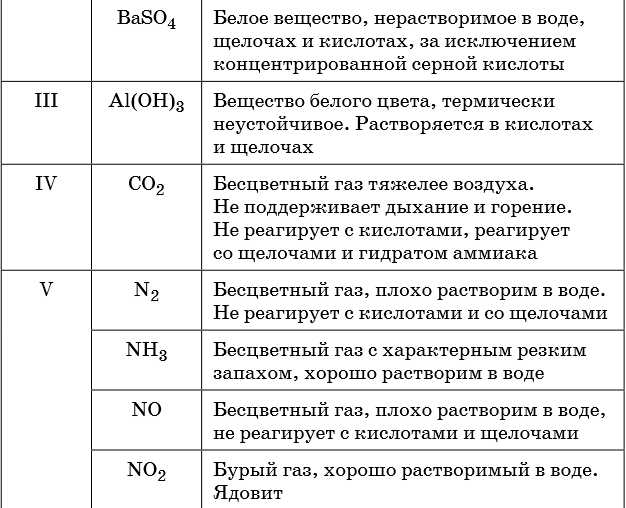
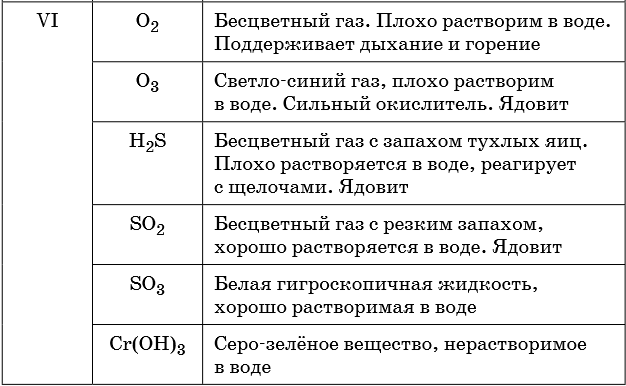
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
Основные термины и понятия
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.

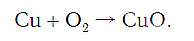
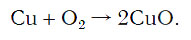
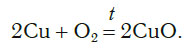
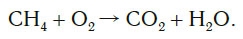
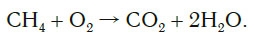
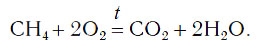
.jpg)
.jpg)
.jpg)
.jpg)


.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)