Лакмус
| Лакмус | |
 | |
 | |
| Общие | |
|---|---|
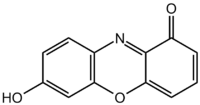
| Систематическое наименование | 7-гидроксифеноксазон (хромофорный компонент лакмуса) |
| Традиционные названия | Лакмус |
| Термические свойства | |
| Классификация | |
| Рег. номер CAS | 1393-92-6 |
| Регистрационный номер EC | 215-739-6 |
Лакмус (от нидерл. lakmoes ) — красящее вещество природного происхождения, один из первых и наиболее широко известных кислотно-основных индикаторов.
Наименование стандартного химического препарата «лакмусовая бумага» стало нарицательным в русском языке, как в химии для всех типов индикаторных бумаг, так и в повседневной жизни при описании знаковых явлений и событий.
Содержание
Свойства
В чистом виде представляет собой тёмный порошок со слабым запахом аммиака. Хорошо растворяется в чистой воде, образуя растворы фиолетового цвета. В кислых средах (pH 8,3) — синюю.
У лакмуса, по сравнению с остальными индикаторами, сравнительно небольшая погрешность в определении среды вещества.
Состав
| Лакмус (pH индикатор) | ||
| нижний предел pH 4.5 | верхний предел pH 8.3 | |
| red | ↔ | blue |
Фактически природный лакмус представляет собой сложную смесь 10—15 различных субстанций. Основными компонентами лакмуса считаются [1] :
Также экстракционным разделением из лакмуса могут быть выделены:
Применение
Применяется как индикатор для определения реакции среды. На практике используется несколько препаративных форм лакмуса: водный раствор лакмуса, полоски и клочки ленты фильтровальной бумаги, пропитанные лакмусом — т. н. лакмусовая бумага, «лакмусовое молоко» (нем. Lackmusmilch ).
Происхождение
Добывается из растительного сырья, в частности из некоторых лишайников: Roccella tinctoria ((о-ва Кабо-Верде, Канарские о-ва, Мадейра, Азорские о-ва, западное побережье Южной Америки), Roccella fuciformis (Ангола и Мадагаскар), Roccella pygmaea (Алжир), Roccella phycopsis, Lecanora tartarea (Норвегия, Швеция), Variolaria dealbata (Пиренеи и Аверн), Ochrolechia parella (северо-запад Атлантического побережья Европы), Parmotrema tinctorum (Канарские острова), из различных видов рода Parmelia, Dendrographa leucophoea (США, Калифорния). Основными производителями лакмуса являются Мозамбик (из Roccella montagnei) и США (из Dendrographa leucophoea).
Получение
В течение длительного времени производство лакмуса было монополизировано и подробности методов его выделения были неизвестны.
Изначально для получения лакмуса применялся следующий способ:
Современный способ получения орцеинового пигмента и лакмуса запатентованный двумя английскими химиками (G. Gordon и Cuthbert Gordon) в 1758г заключался в следующем:
История
В 1640 году ботаники описали красящее вещество, которое они получали из душистого растения с тёмно-лиловыми цветками — гелиотропа. Химики вскоре стали использовать этот краситель в качестве индикатора (в растворах кислот он становился красным, а в щелочах синим). Изначально лакмус использовали в основном для исследования минеральных вод, но с 1670-х годов им в полной мере заинтересовались химики. Французский химик Пьер Поме писал:
Мнемоническое правило
Для того, чтобы запомнить цвет лакмуса в различных средах, существует стихотворение:
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Но есть также небольшое словосочетание, которое тоже частично раскрывает индикаторные свойства лакмуса: лак краскис (слышится как «лак раскис»). Данное словосочетание означает, что «ЛАКмус КРАСный в КИСлоте».
Лакмус формула химическая как пишется
Истинная, эмпирическая, или брутто-формула: C12H7NO3
Химический состав Лакмуса
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 12 | 67,6% |
| H | Водород | 1,008 | 7 | 3,3% |
| N | Азот | 14,007 | 1 | 6,6% |
| O | Кислород | 15,999 | 3 | 22,5% |
Молекулярная масса: 213,192
Лакмус (от нидерл. lekken жидкий, текучий и нидерл. moes — смесь, паста, каша) — красящее вещество природного происхождения, один из первых и наиболее широко известных кислотно-основных индикаторов. Наименование стандартного химического препарата «лакмусовая бумага» стало нарицательным в русском языке, как в химии для всех типов индикаторных бумаг, так и в повседневной жизни при описании знаковых явлений и событий.
В чистом виде представляет собой тёмный порошок со слабым запахом аммиака. Хорошо растворяется в чистой воде, образуя растворы фиолетового цвета. В кислых средах (pH менее 4,5) лакмус приобретает красную окраску, в щелочных (pH более 8,3) — синюю. У лакмуса, по сравнению с остальными индикаторами, сравнительно небольшая погрешность в определении среды вещества.
Фактически природный лакмус представляет собой сложную смесь 10—15 различных субстанций. Основными компонентами лакмуса считаются:
Также экстракционным разделением из лакмуса могут быть выделены:
Применяется как индикатор для определения реакции среды. На практике используется несколько препаративных форм лакмуса: водный раствор лакмуса, полоски и клочки ленты фильтровальной бумаги, пропитанные лакмусом — т. н. лакмусовая бумага, «лакмусовое молоко» (нем. Lackmusmilch).
Добывается из растительного сырья, в частности из некоторых лишайников: Roccella tinctoria (о-ва Кабо-Верде, Канарские о-ва, Мадейра, Азорские о-ва, западное побережье Южной Америки), Roccella fuciformis (Ангола и Мадагаскар), Roccella pygmaea (Алжир), Roccella phycopsis, Lecanora tartarea (Норвегия, Швеция), Variolaria dealbata (Пиренеи и Аверн), Ochrolechia parella (северо-запад Атлантического побережья Европы), Parmotrema tinctorum (Канарские острова), из различных видов рода Parmelia, Dendrographa leucophoea (США, Калифорния). Основными производителями лакмуса являются Мозамбик (из Roccella montagnei) и США (из Dendrographa leucophoea).
В течение длительного времени производство лакмуса было монополизировано и подробности методов его выделения были неизвестны. Изначально для получения лакмуса применялся следующий способ:
Современный способ получения орцеинового пигмента и лакмуса, запатентованный двумя английскими химиками (G. Gordon и Cuthbert Gordon) в 1758 году, заключался в следующем:
Впервые лакмус был применён в качестве химического реагента и индикатора других веществ около 1300 г. испанским врачом и алхимиком Арнальдусом де Виланова (исп. Arnaldus de Villanova). С XVI-ого века, когда информация о способе получения лакмуса распространилась, голубой лакмус из лишайников Leuconora tartarea и Rocella tinctoria в промышленных количествах начал производиться в Голландии на экспорт под названиями «Bergmoos» и «Klippmoos». В 1704 году этот индикатор получил своё нынешнее название — лакмус. Название Lakmoes, ставшее прародителем современного названия препарата (англ. Litmus, нем. Lackmus, рус. Лакмус), было образовано от индогерманских корней «leg» (капать) и «mus» (каша) и отражало способ получения лакмуса — экстракцию по каплям из измельчённых в кашу лишайников. В 1640 году ботаники описали красящее вещество, которое они получали из душистого растения с тёмно-лиловыми цветками — гелиотропа. Химики вскоре стали использовать этот краситель в качестве индикатора (в растворах кислот он становился красным, а в щелочах синим). Изначально лакмус использовали в основном для исследования минеральных вод, но с 1670-х годов им в полной мере заинтересовались химики. Французский химик Пьер Поме писал: «Как только вношу незначительно малое количество кислоты, он становится красным, поэтому если кто хочет узнать, содержится ли в чём-нибудь кислота, его можно использовать». В связи с тем, что во Франции в широкое употребление у химиков сначала вошёл лакмус, выделенный из гелиотропа, во французском языке прижилось иное название лакмуса: tournesol, что означает «поворачивающийся за солнцем», а на греческом то же самое означает слово «гелиотроп». Позднее весь лакмус стали получать более дешёвым способом — из некоторых видов лишайников.
Для того, чтобы запомнить цвет лакмуса в различных средах, существует стихотворение:
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Существует словосочетание-мнемоника для запоминания индикаторных свойств лакмуса: «лак краски́с» (слышится как «лак раски́с»). Данное словосочетание означает, что «ЛАКмус КРАСный в КИСлоте».
ЛАКМУС
Лакмус — добывается из лишаев Rocella tinctoria, Lecanora tartarea и проч., из которых готовится также орсин и орсеин. Под влиянием кислорода воздуха и аммиака красящее вещество этих растений дает орсеин, в присутствии же соды или поташа при этих условиях получаются красящие вещества Л. Для приготовления Л., по Жели, поступают следующим образом. Измельченные растения смешивают с половинным (по весу) количеством поташа и смачивают несколько раз мочой, насыщенной углекислым аммонием, или водным раствором этой соли. Через 3 дня масса принимает рыжий оттенок, через 20—25 дней она становится ярко-красной, а через 30 — синей; лучшего качества Л. получается через 40 дней. Массу после этого смешивают с мелом и гипсом, формуют в небольшие кубики и высушивают, так что в продажном Л., кроме собственно красящих веществ, всегда встречаются аммиачные соли, поташ, мел, гипс, известь и пр. При действии на орсин влажного воздуха, в присутствии аммиака и соды, тоже получается Л. Что касается очистки Л., см. Индикаторы. Наиболее полное исследование лакмуса сделано Кеном (Каnе). Он выделил из Л., главным образом, четыре вещества: азолитмин, эритролитмин, эритролеин и спамолитмин. Азолитмин представляет бурый порошок, не растворимый в спирте и мало растворимый в воде; легко растворяется в щелочах и дает синее окрашивание. По Кену, состав его C 9H10NO5; другие красящие вещества Л. не содержат азота. Жерар предполагает, что он образуется непосредственно при действии аммиака и воздуха на орсин или при окислении орсеина. По Жерару, этот окислительный процессе идет скорее и легче в присутствии углекислых щелочей, что и объясняет необходимость поташа при фабричном изготовлении Л., именно образующийся в первую фазу орсеин при действии аммиака и кислорода на растительный пигмент лишаев в дальнейшем дает азолитмин. Эритролитмин — вещество красного цвета, плохо растворимое в воде и эфире и хорошо растворимое в спирте, из которого может быть кристаллизовано. С аммиаком дает соединение синего цвета, нерастворимое в воде. Эритролитмин растворим в крепких, щелочах с синим цветом. Состав его, до Кену, С 13 Н 22 О 6, и он есть продукт окисления эритролеиновой кислоты. Эритролеин не растворим в воде, растворяется в эфире и спирте с красным цветом, со щелочами дает красное окрашивание. Состав его С 13 Н 22 О 2. Спаниолитмин схож с азолитмином. Состав С 9 Н 7O8. Сернистый водород в момент выделения, хлористое олово и пр. восстанавливают эти вещества и обесцвечивают. Азолитмин, напр., дает бесцветное вещество лейказолитмин; на воздухе оно быстро окисляется и вновь приобретает окраску. Азолитмин и эритролитмин, взболтанные в воде, при пропускании хлора обесцвечиваются и дают хлоропроизводные. По Кену, наиболее существенной составной частью Л. (как индикатора) являются азолитмин и эритролитмин, спаниолитмин встречается редко, а эритролеин со щелочами дает красное окрашивание. О лакмусовой бумаге — см. Индикаторы. С. Я. Вуколов. Δ.
ЛА́КМУС, у, ч.
Кислоти кислі на смак, вони однаково діють на лакмус (з навч. літ.);
// перен. Те, за допомогою чого можна перевірити чи виявити певні показники, характерні ознаки тощо.
Нема такого лакмусу, щоб їх [слова] перевірити. Це потрібно для самої людини (Ю. Мушкетик);
Саме преса найчастіше буває не тільки лакмусом стану суспільства, але й деякою мірою його “лікарем” (з газ.).
2. Те саме, що Ла́кмусовий папі́р (див. папі́р ).
⊲ ЛАКМУС 1749, а, м.Гол. lakmoes, через нем. Lackmus. Вещество, краснеющее от кислот и синеющее от щелочей; краска синего цвета, в состав которой входит это вещество. Лакмус синий в качеств ѣ против иностраннаго, токмо оной к высоким работам из масла не употребляется. ПСЗ XIII 167. Лакмус красен становится. Минер. В. 270. Лакмус или Турниса: краска голубаго темнаго цв ѣ та. Ршт. Худ. 43. — Ср. турниса.
Лакмусовый, ая, ое. В лакмусовом раствор ѣ (Lakmus) становится синь. Минер. В. 173.
Cреда водных растворов веществ. Индикаторы
Материалы портала onx.distant.ru
Определение характера среды водных растворов веществ. Индикаторы.
Среда водных растворов
[ Н + ] = [ ОН – ]
[ Н + ] > [ ОН – ]
[ Н + ] ОН – ]
Для характеристики кислотности среды используют водородный показатель рН. Он определяется, как отрицательный десятичный логарифм концентрации ионов водорода. В нейтральной среде рН равен 7, в кислой — меньше 7, в щелочной — больше 7.
| Кислая среда | Нейтральная среда | Щелочная среда |
| [Н + ] > [ОН – ] | [Н + ] = [ОН – ] | [Н + ] – ] |
| pH | pH = 7 | pH > 7 |
Индикаторы
Для определения среды раствора используют специальные вещества, которые изменяют цвет в зависимости от среды раствора: индикаторы. В зависимости от среды эти вещества могут переходить в разные формы с различной окраской.
Чаще всего используют следующие индикаторы: лакмус, метилоранж, фенолфталеин.
Окраска индикаторов в различных средах:
| Индикатор/среда | Кислая | Нейтральная | Щелочная |
| Лакмус | Красный | Фиолетовый | Синий |
| Метилоранж | Красный | Оранжевый | Желтый |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
Растворы кислот и оснований
Характер среды определяется процессами, которые происходят с веществами в растворе. Кислот, основания и соли в воде диссоциируют на ионы. Кислоты диссоциируют на катионы водорода H + и анионы кислотных остатков:
HA = H + + A –
Сильные кислоты диссоциируют в разбавленных растворах практически полностью, поэтому среда разбавленных растворов сильных кислот, как правило, сильно кислотная. Некоторые кислоты (слабые) диссоциируют частично, поэтому среда водных растворов слабых кислот — слабо кислая.
Основания диссоциируют на катионы металлов и гидроксид-анионы ОН – :
МеОH = Ме + + ОН –
Растворы солей
Попадая в воду, соли диссоциируют на катионы металлов (или ион аммония NH4 + ) и анионы кислотных остатков.
Fe 3+ + HOH ↔ FeOH 2+ + H +
CH3COO — + HOH ↔ CH3COOH + OH —
В зависимости от состава соли водные растворы солей могут иметь кислую, нейтральную или щелочную среду.
Типы гидролиза солей в водных растворах:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Гидролиз не идет | Гидролиз по катиону |
| Анион слабой кислоты | Гидролиз по аниону | Гидролиз по катиону и аниону |
Среда водных растворов солей:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Нейтральная | Кислая |
| Анион слабой кислоты | Щелочна я | Нейтральная* |
* на практике среда водных растворов солей, образованных слабым основанием и слабой кислотой, определяется силой кислоты и основания
Тип гидролиза и среда водных растворов некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, гидролиз не идет, среда нейтральная | (NH4)2CO3 гидролиз по катиону, среда щелочная |
| CO3 2 – | Na2CO3, гидролиз по аниону, среда щелочна я | Na2CO3, гидролиз по катиону и аниону, среда определяется силой кислоты и основания |
Индикаторы будут по-разному окрашиваться в водных растворах таких солей, в зависимости от среды. Таким образом, с помощью индикаторов можно различить водные растворы некоторых солей.
Окраска лакмуса в водных растворах солей, в зависимости от строения соли:
| Катио н/анион | Катион сильного основания | Катион слабого основания |
| Анион сильной кислоты | Лакмус фиолетовый | Лакмус красный |
| Анион слабой кислоты | Лакмус синий | Окраска лакмуса зависит от силы кислоты и основания |
Окраска лакмуса в водных растворах некоторых солей:
| Катио н/анион | Na + | NH4 + |
| Cl – | NаCl, лакмус фиолетовый | (NH4)2CO3 лакмус красный |
| CO3 2 – | Na2CO3, лакмус синий | Na2CO3, окраска лакмуса зависит от силы кислоты и основания |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.




