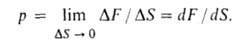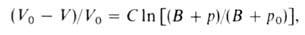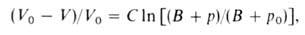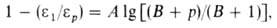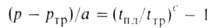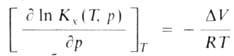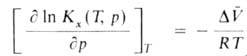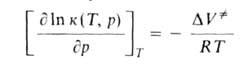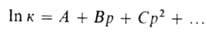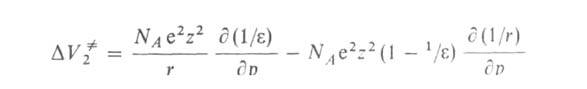ДАВЛЕНИЕ
физ. величина, характеризующая интенсивность нормальных (перпендикулярных к пов-сти) сил, с к-рыми одно тело действует на пов-сть другого. Д.-один из основных параметров состояния термодинамич. системы, входящий в уравнения состояния (вместе с т-рой и уд. объемом). При равномерном распределении сил вдоль пов-сти Д. ропределяется как сила F, действующая по нормали к пов-сти на площадь S: р = F/S. Если распределение сил по пов-сти неравномерно, рассматривают Д. в данной точке:
При сжатии газов и жидкостей прилагаемая нагрузка распределяется в в-ве изотропно, т. е. Д. по всем направлениям одинаково (гидростатич. Д.). При сжатии твердых тел возникающие в объеме тела напряжения обычно распределяются неравномерно. В этом случае под Д. в данной точке понимают среднее арифметическое нормальных напряжений, действующих в трех взаимно перпендикулярных направлениях.
3000 К), а также при дополнительном наложении напряжений сдвига, вызывающих пластическую деформацию. Динамич. Д., при к-рых выполняются физ.-хим. исследования конденсированных систем, достигают 500 ГПа.
Д. до 1 ГПа обычно измеряют манометрами, свыше 1 ГПа-датчиками из сплавов металлов (напр., манганина), электрическое сопротивление которых зависит от Д.
Сведения о влиянии высоких Д. на физ.-хим. св-ва в-в появились в 19 в. Систематич. изучение поведения в-в при высоких Д. было начато в 20-х гг. 20 в. Основополагающие результаты в этой области были получены П. Бриджменом. В СССР аналогичные исследования были начаты в 30-е гг. Важную роль в развитии исследований физ. и хим. процессов сыграли работы Л. Ф. Верещагина с сотр. В данной статье рассматривается действие на в-во статич. Д.; о физ.-хим. исследованиях при динамич. Д. см. в ст. Взрыв, Ударных труб метод.
Влияние Д. на физ. св-ва в-в. Непосредственным результатом действия Д. является сжатие в-ва, т. е. изменение его объема вследствие изменения межатомных (межмолекулярных) расстояний. Способность в-ва изменять свой объем под действием Д. характеризуется сжимаемостью. С увеличением Д. плотность газов растет и при Д. порядка сотен МПа приближается к плотности жидкостей. При 1 ГПа плотность большинства жидкостей возрастает на 20-30% по сравнению с плотностью при нормальном Д. Для многих металлов при 10 ГПа плотность возрастает на 6-15%, для др. твердых тел-на 15-25%. Изменение объема жидкости или сильно сжатого газа в интервале Д. от нек-рого начального р 0 до значения рм. б. описано ур-нием Тейта:
ДАВЛЕНИЕ
При сжатии газов и жидкостей прилагаемая нагрузка распределяется в в-ве изотропно, т.е. давелние по всем направлениям одинаково (гидростатич. давление). При сжатии твердых тел возникающие в объеме тела напряжения обычно распределяются неравномерно. В этом случае под давлением в данной точке понимают среднее арифметическое нормальных напряжений, действующих в трех взаимно перпендикулярных направлениях.
3000 К), а также при дополнительном наложении напряжений сдвига, вызывающих пластическую деформацию. Динамич. давления, при к-рых выполняются физ.-хим. исследования конденсированных систем, достигают 500 ГПа.
Давление до 1 ГПа обычно измеряют манометрами, свыше 1 ГПа-датчиками из сплавов металлов (напр., манганина), электрическое сопротивление которых зависит от давления.
Влияние давления на физ. св-ва в-в. Непосредственным результатом действия давления является сжатие в-ва, т. е. изменение его объема вследствие изменения межатомных (межмолекулярных) расстояний. Способность в-ва изменять свой объем под действием давления характеризуется сжимаемостью. С увеличением давления плотность газов растет и при давлении порядка сотен МПа приближается к плотности жидкостей. При 1 ГПа плотность большинства жидкостей возрастает на 20-30% по сравнению с плотностью при нормальном давлении Для многих металлов при 10 ГПа плотность возрастает на 6-15%, для др. твердых тел-на 15-25%. Изменение объема жидкости или сильно сжатого газа в интервале давлений от нек-рого начального р0 до значения р м. б. описано ур-нием Тейта:
где V0 и V-объем в-ва при давлении р0 и р соотв., С и В-эмпирич. постоянные.
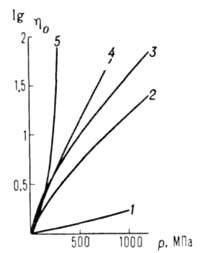
Вязкость жидкостей увеличивается с давлением (см. рис. 1). Ди-электрич. проницаемость 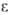
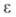
где и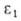
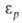
где ртр и tтр-давление и т-ра тройной точки в-ва, а и с-эмпирич. постоянные.
Под давлением твердые тела нередко претерпевают полиморфные переходы. Так, при 20 °С и 5,5 ГПа Ва с кубич. объемноцентрированной решеткой переходит в гексагональную модификацию типа Mg. Другие примеры-фазовые переходы Т1 при 3,7 ГПа, КС1 при 2 ГПа, AgCl при 9 ГПа, нафталина при 2,5 ГПа. При т-рах > 1300 К и давлениях >4 ГПа наблюдается переход графит-алмаз; тройная точка алмаз-графит-расплав соответствует 3000 К и 12,4 ГПа. При давлении свыше 100 ГПа предполагается существование фазового перехода твердого водорода с образованием структуры, построенной из атомов и обладающей металлич. св-ва-ми. У орг. в-в при изменении давления обнаруживается обычно больше полиморфных переходов, чем у неорганических.
Растворимость в жидкостях газов и их смесей (при условии, что они близки по своему поведению к идеальным газам) с ростом давления увеличивается (см. Генри закон, Дальтона законы). Влияние давления на р-римость тел зависит от того, как изменяется с давлением молярный объем в-ва и его парциальный молярный объем в р-ре. Если при нек-ром давлении молярный объем в-ва становится меньше его парциального молярного объема, р-римость в-ва, в соответствии с Ле Шателье Брауна принципом, с ростом давления снижается. Такая закономерность характерна для реальных газов и твердых тел в случае неполярных р-рителей. Напр., при 500 МПа р-римость гексахлорэтана и SnI4 в CS2 уменьшается по сравнению сих р-римостью при 0,1 МПа в 15 и в 7,5 раза соотв. Для газов с ограниченной р-римостью в жидкости характерно наличие максимума на кривой зависимости р-римости от давления. Если в-во при растворении диссоциирует на ионы, то при оценке влияния давления дополнительно следует учитывать изменение молярного объема в результате сольватации ионов молекулами р-рителя.
Рис. 2. Зависимость т-ры плавления tпл от давления р для различных в-в. 1 ацетон, 2 ртуть, 3 хлорбензол, 4-бензол.
При высоких давлениях возможно расслоение гомогенной газовой смеси на две фазы при т-рах, превышающих критич. т-ры компонентов смеси. Этот эффект был экспериментально обнаружен И. Р. Кричевскимссотр. в 1941-43 (см. Критическое состояние).
Влияние давления на хим. р-ции. При сжатии газовых реакц. смесей в области давлений, ограниченных десятками МПа, наблюдается увеличение скорости р-ций и смещение хим. равновесия. Это объясняется гл. обр. изменением концентраций реагирующих в-в (см. Действующих масс закон). Для в-в в конденсированной фазе или для газов при давлених выше 200-300 МПа повышение концентрации реагентов с ростом давления невелико, тем не менее многие процессы чувствительны к давлению. Так, давление существенно влияет на равновесие электролитич. диссоциации к-т и оснований, изменяет концентрацию комплексов с переносом заряда, влияет на равновесие кето-енольной таутомерии, на конформац. равновесие, смещает равновесие мономер-полимер и т.д. Под давлением удается осуществить полимеризацию в-в, для к-рых равновесие мономер-полимер при атмосферном давлении смещено в сторону мономера.
Для идеальных газовых смесей зависимость константы равновесия КХ(Т, р)(концентрации реагирующих в-в выражены в молярных долях х) от давления при постоянной т-ре Т выражается ур-нием:
где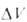
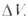
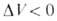
где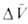
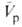
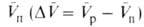
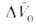
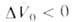
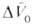
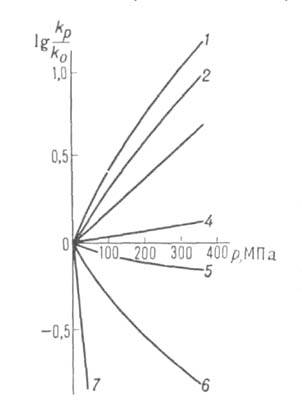
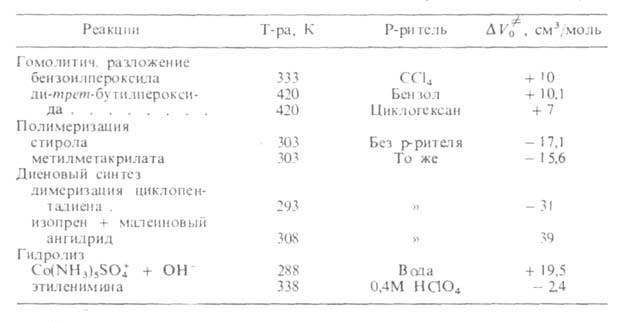
Скорости р-ций по-разному изменяются с давлением (см. рис. 3). Бимолекулярные р-ции обычно ускоряются с давлением, мономолекулярные-замедляются. Так, скорость диенового синтеза при повышении давления до 1000 МПа может возрастать в тысячи раз, а р-ции распада обычно затормаживаются. Согласно активированного комплекса теории, зависимость от давления константы скорости элементарной р-ции к (Т, р)при постоянной т-ре определяется изменением молярного объема реагентов при образовании активированного комплекса 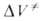
(концентрации реагентов выражены моляльностями). Если полярность активированного комплекса отличается от полярности молекул реагентов, то 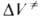
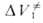
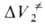
Рис. 3. Зависимость константы скорости kp от давления р для различных р-ций (k0-константа скорости р-ции при 1 агм). 1-ди-меризация циклопентадиена (293 К); 2-полимеризация метилметакрилата (313 К); 3-нитрование толуола (273 К); 4-гидролиз этиленимина (338 К); 5-распад 2,2-азо-бис-изобутиронитрила (313 К); 6-гид-ролиз Co(NH3)5SO4 + + ОН- (288 К).
Величина 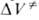
где А, В, С-эмпирич. постоянные.
Для диенового синтеза зависимость 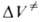
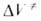
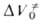
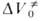
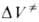
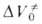
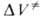
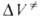
где индексы «и», «р» и «о» относятся соотв. к инициированию, росту и обрыву полимерных цепей.
Табл. 2 ОБЪЕМНЫЕ ЭФФЕКТЫ 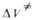
Изменение скорости хим. процессов м. б. обусловлено также влиянием давления на физ. св-ва среды. Так, вследствие возрастания вязкости с повышением давления р-ции могут перейти из кинетич. области протекания в диффузионную, когда скорость р-ции контролируется диффузией реагирующих частиц (см. Макрокинетика). Изменяя е среды, давление влияет на скорость ионных р-ций. При этом объемные эффекты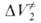
Хим. взаимод. в твердой фазе обычно замедляется с ростом давления. Для интенсификации твердофазных р-ций (синтез минералов, полимеризация и др.) их проводят при высоких т-рах.
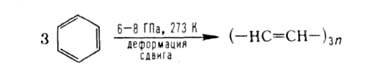
Взаимодействие твердых в-в под давлением резко усиливается, если реагенты подвергаются пластич. деформации сдвига. В этих условиях реализуются многие твердофазные хим. процессы: полимеризация, нуклеоф. присоединение аммиака, воды, карбоксильной группы к связи С=С, синтез амидов и пептидов, разложение пероксидов, карбонилов и оксидов металлов, неорганич. солей, р-ции этерификации и др. Ароматич. соед. при деформации под давлением нередко претерпевают превращения, сопровождающиеся разрывом цикла:
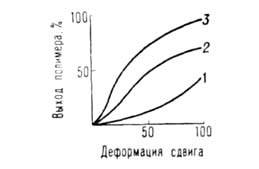
Скорости хим. р-ций при одновременном действии высоких давлений и деформаций сдвига очень велики и могут превосходить скорости соответствующих жидкофазных процессов при тех же давлениях и т-рах в миллионы и более раз. Реакционная способность твердых в-в (константы скорости, выходы продуктов) в значит. степени зависят от физ. св-в среды (пластичности, предельного напряжения сдвига, кристаллич. структуры). Как правило, реакционная способность в-ва возрастает, если его деформировать в смеси с пластичным в-вом, обладающим напряжением сдвига большим, чем у чистого реагента. В условиях деформации выход продуктов р-ции является ф-цией деформации сдвига (при постоянных давлении и т-ре) и в широких пределах не зависит от времени деформирования реакционной смеси (рис. 4). Время деформирования м. б. очень малым и исчисляться долями с. Зависимость выхода продуктов от деформации сдвига удается описать в ряде случаев (напр., при полимеризации акриламида) методами формальной кинетики при замене в дифференц. ур-ниях времени на деформацию сдвига.
Рис. 4. Зависимость выхода полимера (в %) от деформации сдвига (полимеризация при 2 ГПа) (293 К). 1-малеиновый ангидрид, 2-метакриламид, 3-акриламид.
Биохимии, эффекты высоких давлениях. При давлениях в неск. сотен МПа происходит денатурация белков, при этом меняются их антигенные св-ва, снижается активность токсинов. Особенно чувствительны к давлению процессы образования связей белок-лиганд и белок-белок. Так, для белков характерно значит. уменьшение скорости ассоциации с повышением давления ( 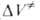
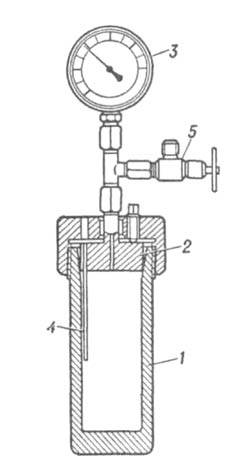
Для создания давлений, исчисляемых ГПа, служат устройства, использующие разл. конструкционные принципы. В-во, помещенное в цилиндрич. сосуд, сжимается при вдавливании штоков с помощью пресса (рис. 6а). Гидравлич. пресс и камера высокого давления могут быть объединены в одну конструкцию-мультипликатор (рис. 6б). Давление в рабочей камере мультипликатора рассчитывается по соотношению: РВ = pH(SH/SB), где SH и SB-площади поршней цилиндров низкого (рн) и высокого (РВ) давления. При использовании высокопрочных сталей для цилиндра и сверхтвердых сплавов для штоков эта конструкция позволяет работать при давлениях до 4-5 ГПа. В аппаратуре типа наковален (рис. 6в) в-во размещается между плоскостями двух усеченных конусов (наковален). Для создания высокого давления наковальни сжимают с помощью пресса. Большая прочность аппаратуры достигается использованием двух конструкционных приемов: заменой напряжений растяжения напряжением сжатия и массивной поддержкой нагруженной центральной части наковален со стороны прилегающих ненагруженных частей. Наковальни изготавливают обычно из твердых сплавов. Достоинства такой аппаратуры-простота конструкции и возможность достижения давления в десятки ГПа, недостаток-малый объем рабочего пространства.
Для физ.-хим. исследований при высоких давлениях применяют установки с прозрачными наковальнями из алмазов, обеспечивающие давления до 200 ГПа и т-ры до 3000 К. Такие установки компактны (располагаются на столике микроскопа). Нагрев образца осуществляют лазерным лучом. Для измерения давления внутрь аппарата помещают кристалл рубина и следят за его спектром люминесценции, линия к-рого смещается с увеличением давления линейно до 30 ГПа. Помимо визуального наблюдения, эти аппараты позволяют проводить исследования методами УФ, ИК, рентгеновской и гамма-резонансной спектроскопии. Для достижения давлений в 100-200 ГПа при т-рах до 2500 К используют установки, в к-рых совмещаются конструкционные приемы аппаратов типа цилиндр-поршень и типа наковален (рис. 6г). Давление в образце создается при вдавливании конич. пуансонов с помощью пресса. Достоинство аппаратов-сравнительно большой объем рабочего пространства, недостаток-сложность в изготовлении.
Для экспериментов в условиях высоких давлений и деформаций сдвига используют аппаратуру типа наковален. Между наковальнями располагают слой твердой реакционной смеси, в к-ром создается давление при сжатии наковален с помощью пресса. Заданная деформация сдвига производится поворотом одной из наковален на определенный угол. Время поворота наковален (а след., и хим. превращения) обычно исчисляется с или долями с.
Статич. высокие давления широко используют в хим. пром-сти. Среди особо важных процессов-произ-во синтетич. алмазов (5-6 ГПа), синтез боразона (6-8 ГПа), полимеризация этилена (120-320 МПа), гидротермальный синтез минералов (до 300 МПа), гидрогенизация угля (до 70 МПа), синтез метанола (30 МПа) и аммиака (30 МПа), гидрокрекинг (5-20 МПа) и др. При лаб. исследованиях жидкофазных хим. процессов высокие давления (500-1500 МПа) используют гл. обр. для сокращения продолжительности хим. превращений. Особенно это важно, если скорость р-ции при атмосферном давлении низка, а повышать ее путем нагрева реакционной смеси нежелательно из-за возможности возникновения побочных р-ций или нестойкости реагентов (продуктов) р-ции. При высоких давлениях проводят распространенные в лаб. практике синтезы, если необходимо увеличить выход целевого продукта.
Страница «ДАВЛЕНИЕ» подготовлена по материалам химической энциклопедии.
ДАВЛЕНИЕ
физ. величина, характеризующая интенсивность нормальных (перпендикулярных к пов-сти) сил, с к-рыми одно тело действует на пов-сть другого. Д.-один из основных параметров состояния термодинамич. системы, входящий в уравнения состояния (вместе с т-рой и уд. объемом). При равномерном распределении сил вдоль пов-сти Д. ропределяется как сила F, действующая по нормали к пов-сти на площадь S: р = F/S. Если распределение сил по пов-сти неравномерно, рассматривают Д. в данной точке:
При сжатии газов и жидкостей прилагаемая нагрузка распределяется в в-ве изотропно, т. е. Д. по всем направлениям одинаково (гидростатич. Д.). При сжатии твердых тел возникающие в объеме тела напряжения обычно распределяются неравномерно. В этом случае под Д. в данной точке понимают среднее арифметическое нормальных напряжений, действующих в трех взаимно перпендикулярных направлениях.
3000 К), а также при дополнительном наложении напряжений сдвига, вызывающих пластическую деформацию.Динамич. Д., при к-рых выполняются физ.-хим. исследования конденсированных систем, достигают 500 ГПа.
Д. до 1 ГПа обычно измеряют манометрами, свыше 1 ГПа-датчиками из сплавов металлов (напр., манганина), электрическое сопротивление которых зависит от Д.
Сведения о влиянии высоких Д. на физ.-хим. св-ва в-в появились в 19 в. Систематич. изучение поведения в-в при высоких Д. было начато в 20-х гг. 20 в. Основополагающие результаты в этой области были получены П. Бриджменом. В СССР аналогичные исследования были начаты в 30-е гг. Важную роль в развитии исследований физ. и хим. процессов сыграли работы Л. Ф. Верещагина с сотр. В данной статье рассматривается действие на в-во статич. Д.; о физ.-хим. исследованиях при динамич. Д. см. в ст. Взрыв, Ударных труб метод.
Влияние Д. на физ. св-ва в-в. Непосредственным результатом действия Д. является сжатие в-ва, т. е. изменение его объема вследствие изменения межатомных (межмолекулярных) расстояний. Способность в-ва изменять свой объем под действием Д. характеризуется сжимаемостью. С увеличением Д. плотность газов растет и при Д. порядка сотен МПа приближается к плотности жидкостей. При 1 ГПа плотность большинства жидкостей возрастает на 20-30% по сравнению с плотностью при нормальном Д. Для многих металлов при 10 ГПа плотность возрастает на 6-15%, для др. твердых тел-на 15-25%. Изменение объема жидкости или сильно сжатого газа в интервале Д. от нек-рого начального р 0 до значения рм. б. описано ур-нием Тейта:
где 0 и V-объем в-ва при Д. р 0 и р соотв., С и В-эмпирич. постоянные.
Вязкость жидкостей увеличивается с Д. (см. рис. 1). Ди-электрич. проницаемость в-ва обычно возрастает с Д., что обусловлено в основном изменением плотности. Для многих в-в зависимость от Д. удовлетворительно описывается ур-нием:
Под Д. твердые тела нередко претерпевают полиморфные переходы. Так, при 20