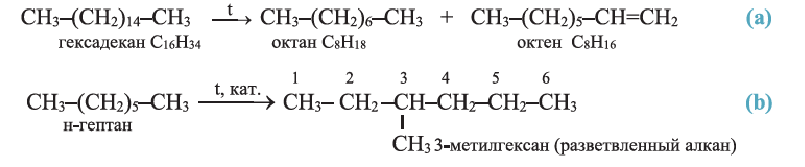
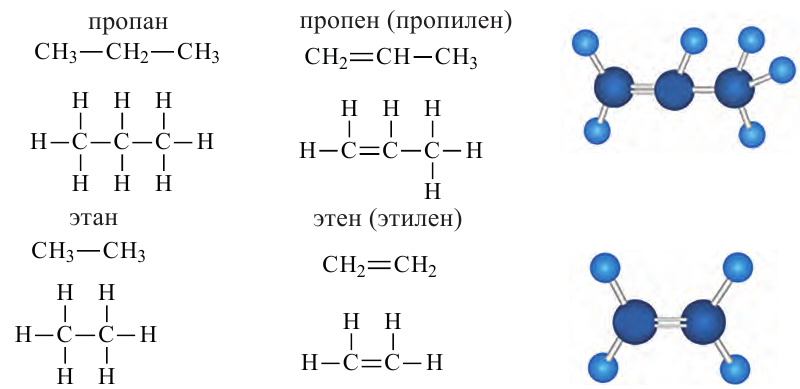
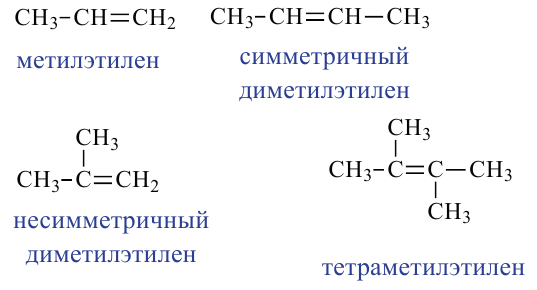
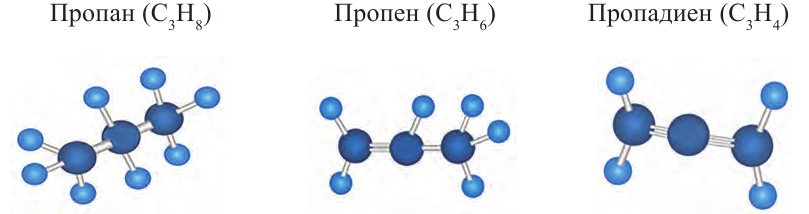
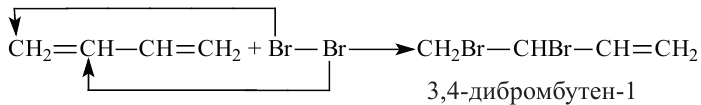
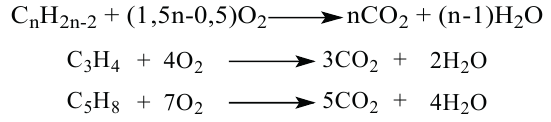
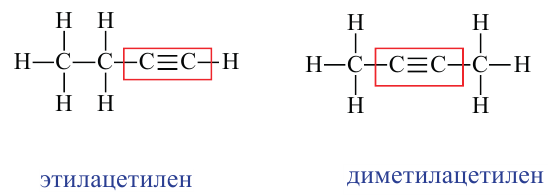
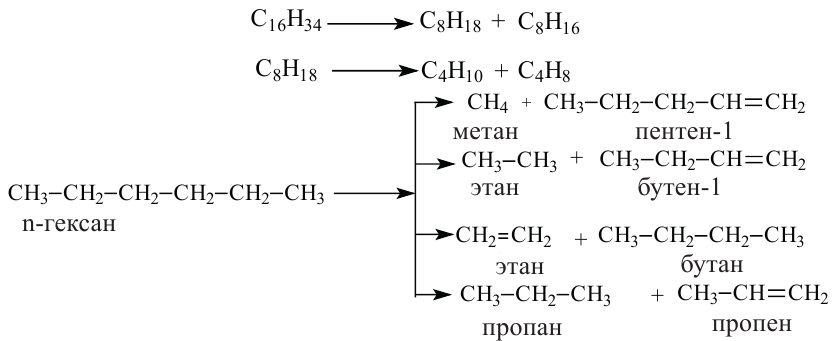
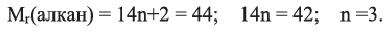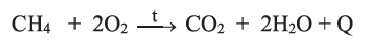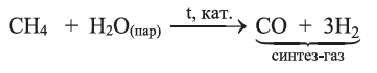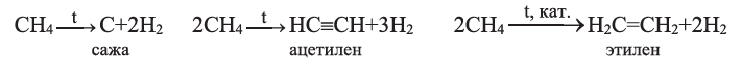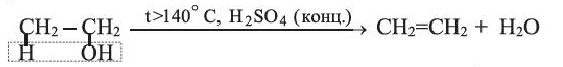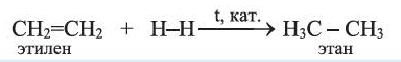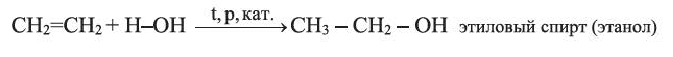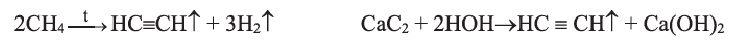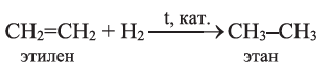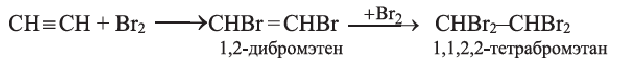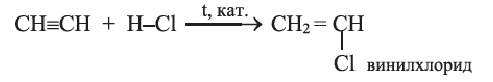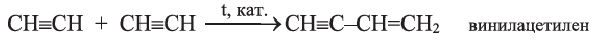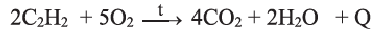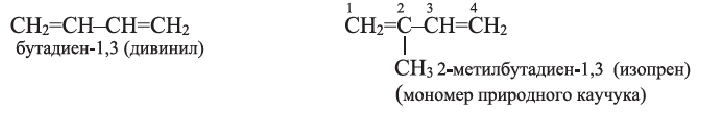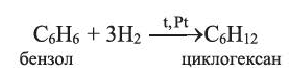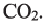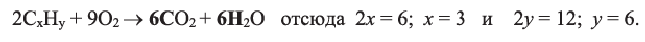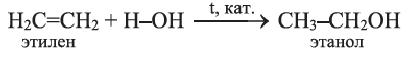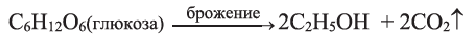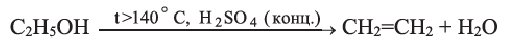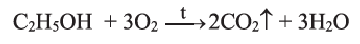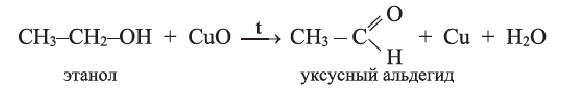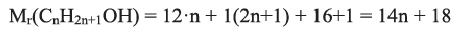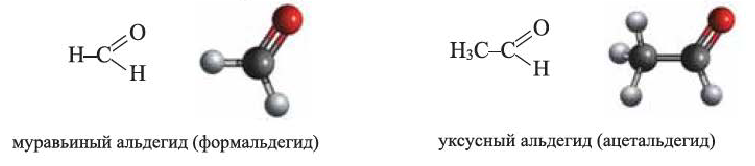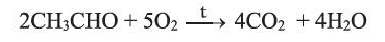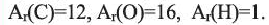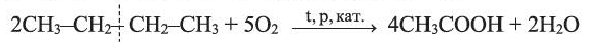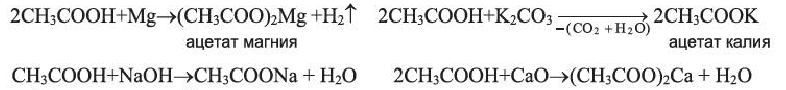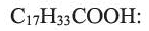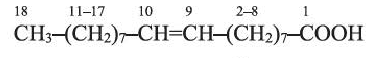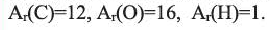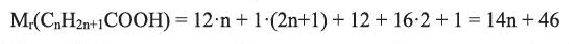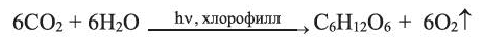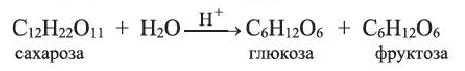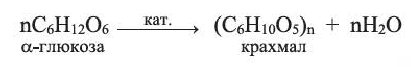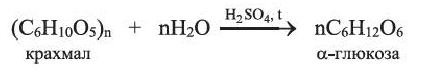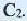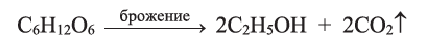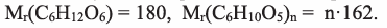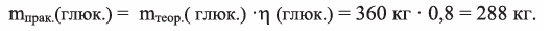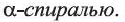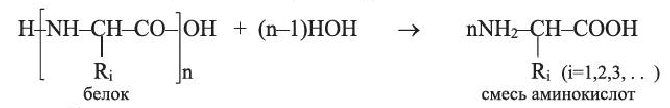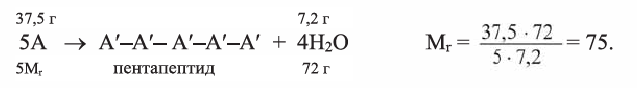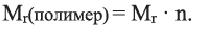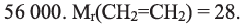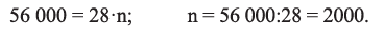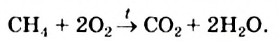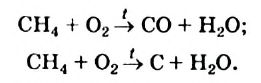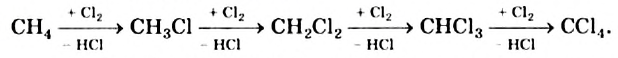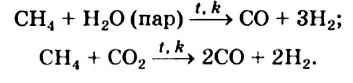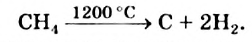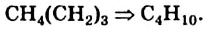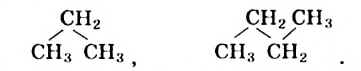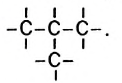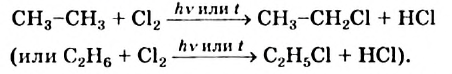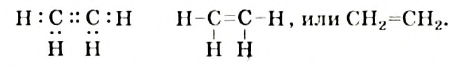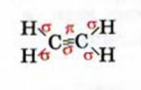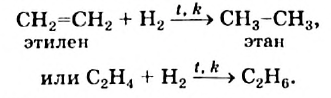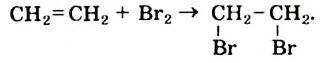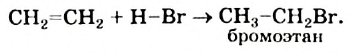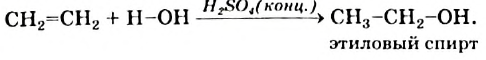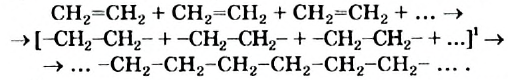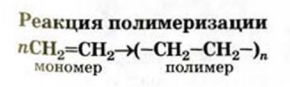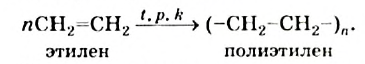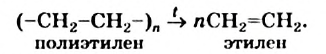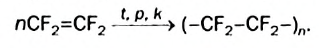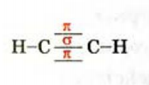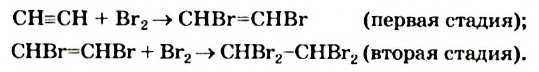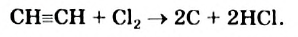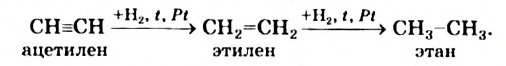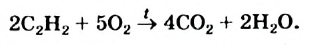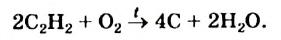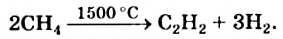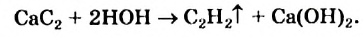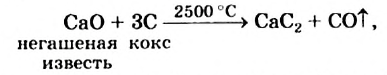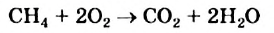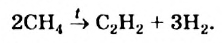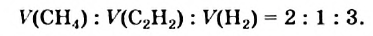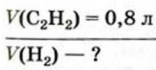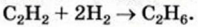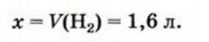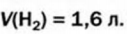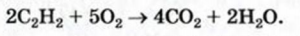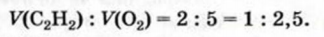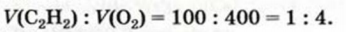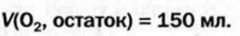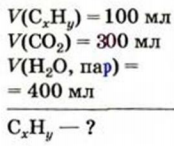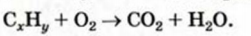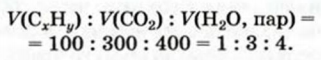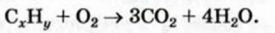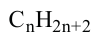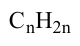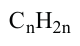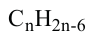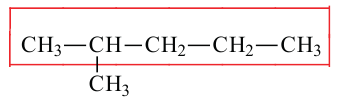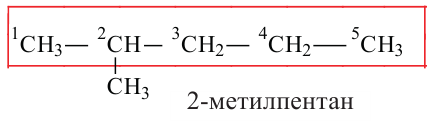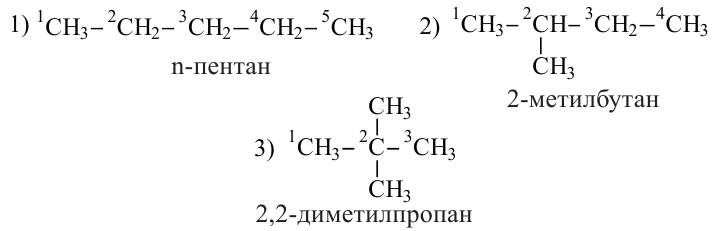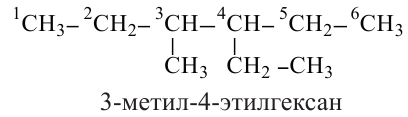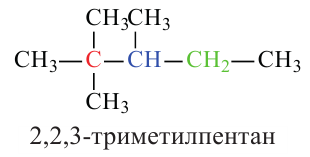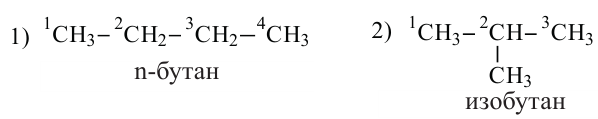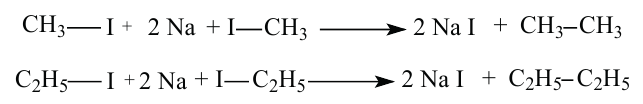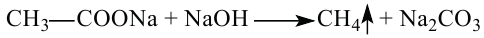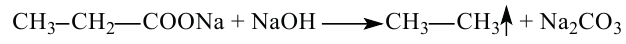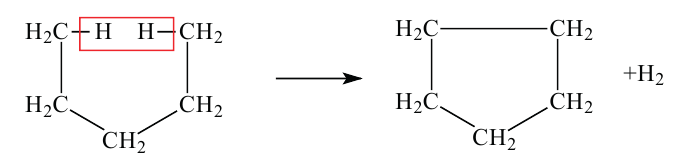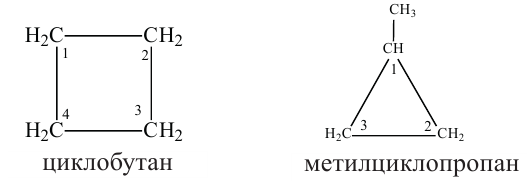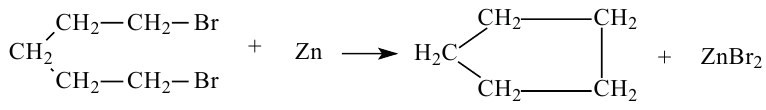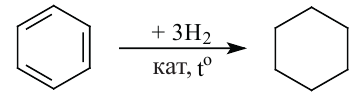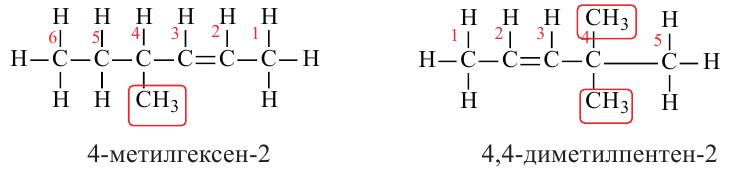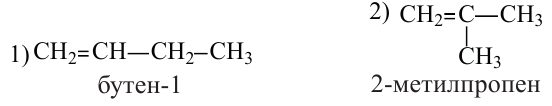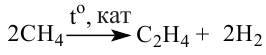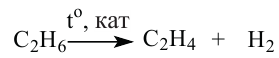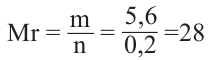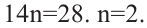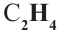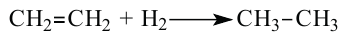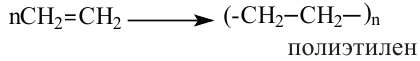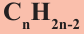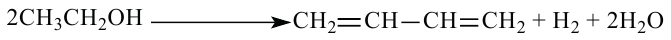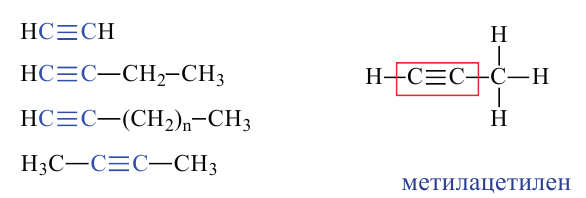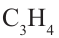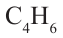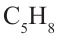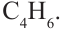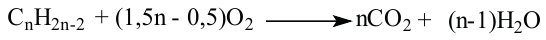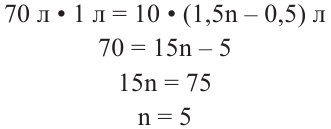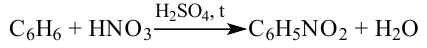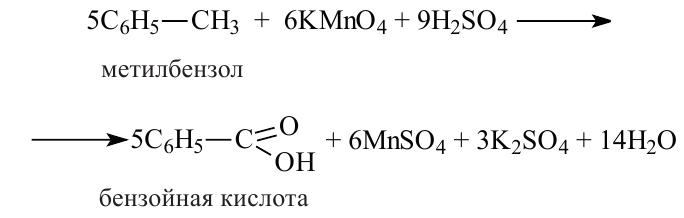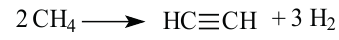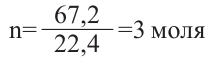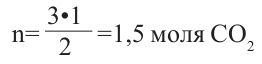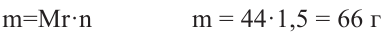Какие углеводы называют непредельными и как их подразделяют напишите общие формулы
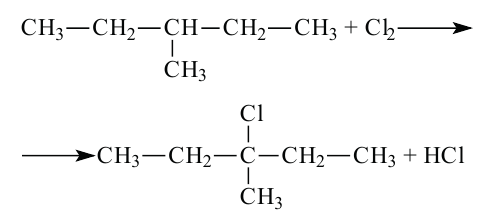
г) гидрогалогенирование (гидрохлорирование):
Присоединение молекул галогеноводородов протекает по правилу Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода).
4. Качественные реакции на алкены: обесцвечивание бромной воды (см. уравнение 2 б ) и раствора перманганата калия
Алкины – это непредельные углеводороды, в молекулах которых есть одна тройная связь между атомами углерода
Физические свойства алкинов
Химические свойства алкинов
В этой реакции температура пламени может достигать 3000 o С, поэтому она применяется для сварки металлов.
в) гидрогалогенирование (первая стадия):
CH CH + HCl CH 2 = CHCl
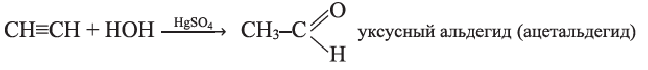
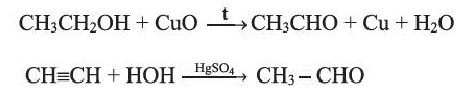
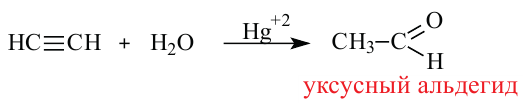
г) гидратация (реакция Кучерова):
ацетальдегид
(уксусный альдегид)
5. Качественные реакции на алкины: обесцвечивание бромной воды (см. реакцию 2 б ) и раствора перманганата калия; образование осадка ацетиленида серебра (см. реакцию 4).
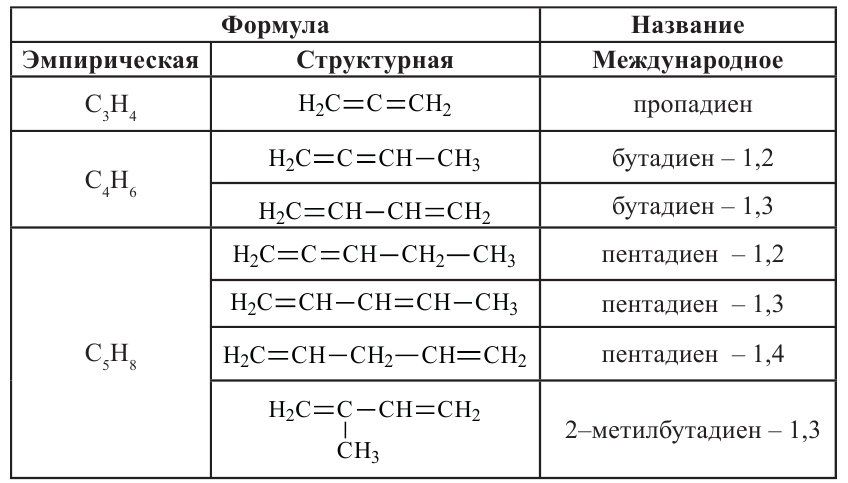
Алкадиены – это непредельные углеводороды, в молекулах которых есть две двойные связи между атомами углерода
Физические свойства алкадиенов
Химические свойства алкадиенов
Такой же состав, как полиизопрен, (C5H8)n – имеет и природный полимер − натуральный каучук.
Алкадиены, как алкены и алкины, обесцвечивают бромную воду (реакция 2 б ) и раствор перманганата калия.
Получение непредельных углеводородов
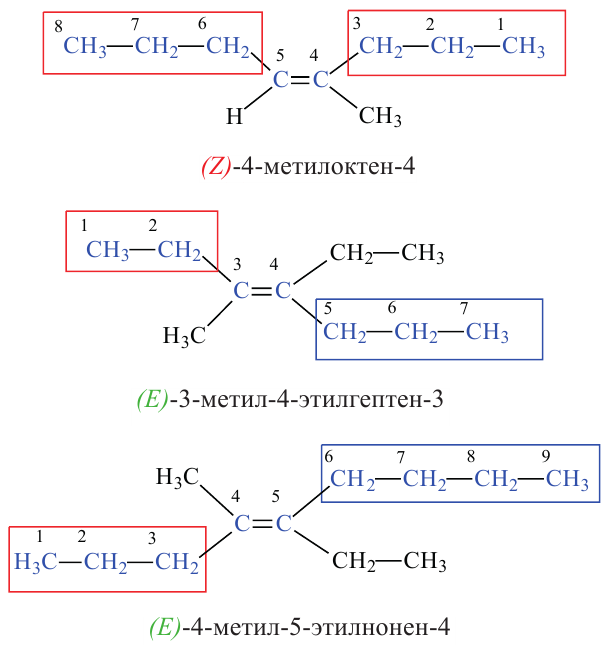
Алгоритм составления названий непредельных углеводородов
Содержание:
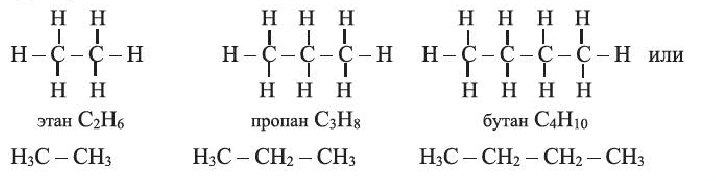
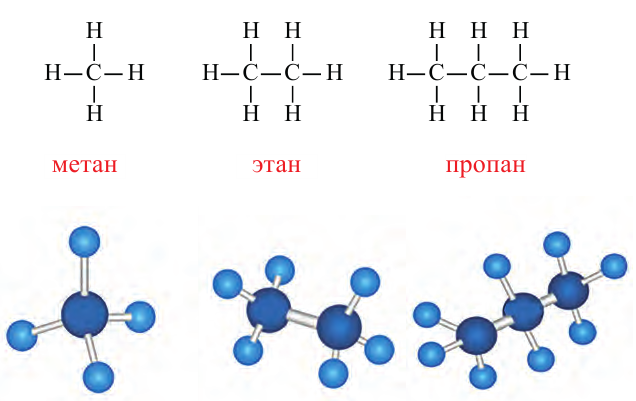
• Ациклические углеводороды, в молекулах которых атомы углерода соединены одинарной С-С связью, называются предельными углеводородами. Например:
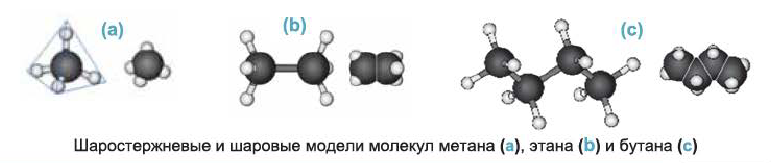
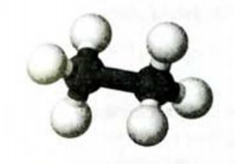
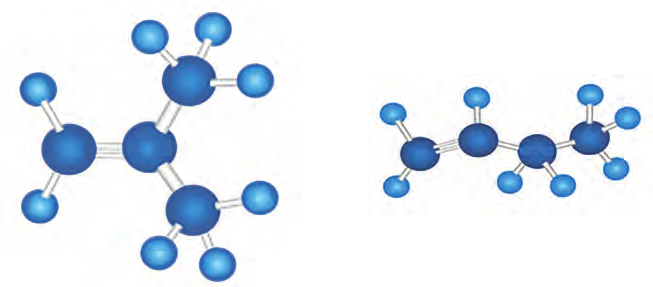
Ниже приведены рисунки моделей молекул метана, этана и бутана (а, b, с). Из моделей следует, что молекула метана, а также любой атом углерода в молекуле другого предельного углеводорода имеет тетраэдрическое строение.
Шаростержневые и шаровые модели молекул метана (а), этана (b) и бутана (с)
Сравнивая формулы метана (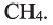
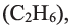
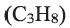
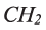

• Вещества, принадлежащие к одному классу и отличающиеся друг от друга на одну или несколько метиленовых групп, называют гомологами.
Вычисления связанные с составом и строением алканов:
Относительная молекулярная масса алкана равна 44. Назовите алкан и вычислите общее число 
Решение.
Из выражения 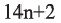
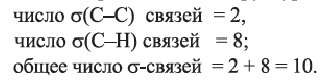
Пропан и бутан при обычной температуре под давлением легко сжижаются.
Метан вступает в реакции замещения, окисления и разложения.
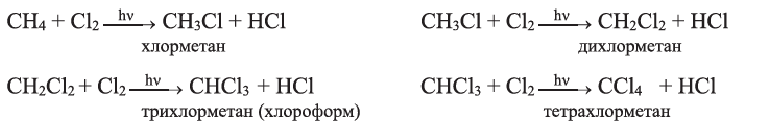
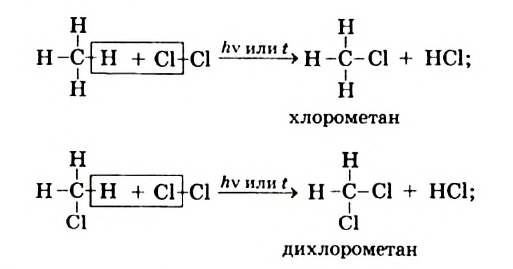
I. В реакциях замещения С-Н связь разрывается и атом H замещается другим атомом. Например, при освещении (hv) или нагревании, атомы хлора последовательно замещает атомы водорода метана, образуя смесь различных хлорпроизводных метана:
Бром с метаном реагирует аналогичным образом.
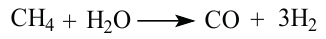
Конверсией метана с водяными парами получают синтез-газ:
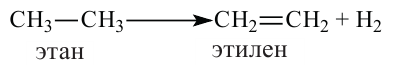
Реакции отщепления молекулы водорода от молекул органических соединений называются реакциями дегидрирования.
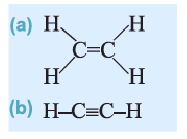
Непредельные углеводороды. Углеводороды этиленового ряда (алкены)
Ациклические углеводороды, в молекулах которых между атомами С имеется двойная или тройная связь, называются непредельными углеводородами.
Из непредельных ациклических углеводородов рассмотрим алкены, алкадиены и алкины.
Углеводороды этиленового ряда (алкены). Этилен
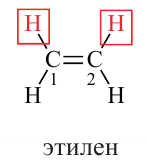
• Ациклические углеводороды, в молекулах которых между атомами углерода имеется одна двойная связь, называются этиленовыми углеводородами.
Из молекулярной модели этилена следует, что в молекуле все атомы расположены в одной плоскости. В молекуле этилена четыре 
Получение: В лаборатории этилен можно получить отщеплением воды от этилового спирта:
Реакции разложения, протекающие с отщеплением воды, называются реакциями дегидратации.
Физические свойства: Этилен — газ без цвета, запаха, немного легче воздуха; в воде практически не растворим. При обычных условиях первые представители ряда 
I. Реакции присоединения.
1. Этилен в присутствии катализатора присоединяет 1 моль водорода, превращаясь в этан:
Реакции присоединения водорода к органическим веществам, называются реакциями гидрирования.
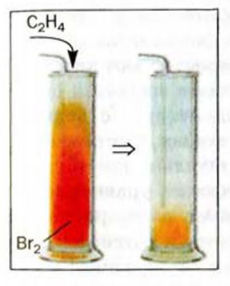
2. Этилен присоединяет галогены. Например, если этилен пропустить через желтовато-бурый раствор бромной воды, то этилен присоединит к себе бром и раствор обесцветится. Эту реакцию используют для определения (распознавания) непредельных углеводородов: 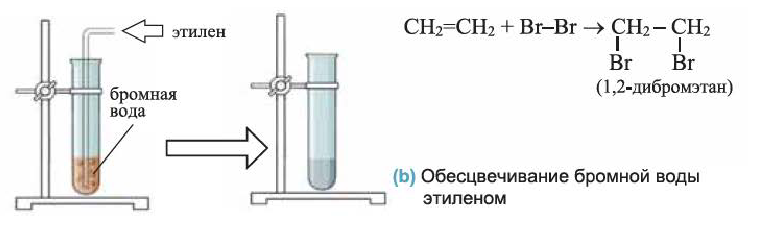
(b) Обесцвечивание бромной воды этиленом
3. В присутствии катализатора этилен присоединяет воду, превращаясь в этиловый спирт:
Вычисления, связанные с химическими свойствами алкенов:
Решение:
Поскольку 1 моль этилена и 1 моль пропилена содержат одинаковое (Na) число молекул, а в каждой молекуле имеется но одной С=С связи, которая и гидрируется, то можно заключить, что расход водорода в обоих случаях будет одинаковым.
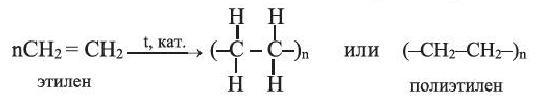
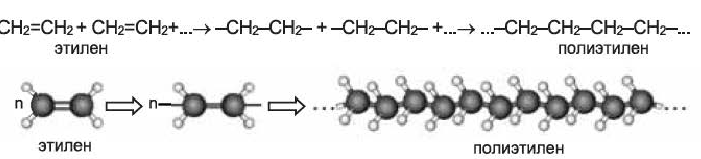
II. Реакции полимеризации. Полимеризация — реакция присоединения большого числа одинаковых молекул с малыми относительными молекулярными массами, приводящая к образованию высокомолекулярных веществ. Полимеризацию этилена в полиэтилен можно изобразить уравнением:
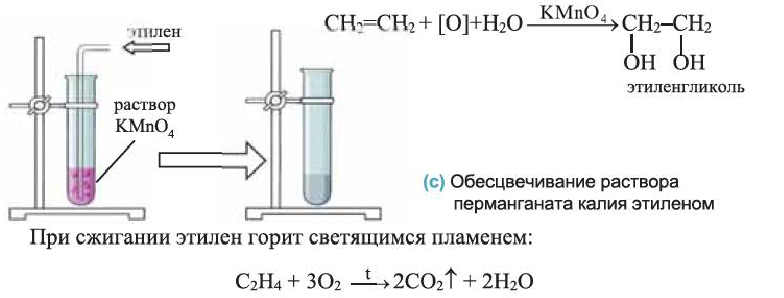
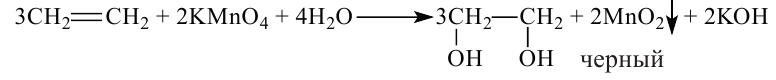
III. Реакции окисления. Этилен легко окисляется. Например, если этилен пропустить через раствор перманганата калия, то фиолетовая окраска раствора исчезнет. В результате реакции образуется двухатомный спирт — этиленгликоль.
Эта реакция также применяется для определения непредельных углеводородов:
Применение: Алкены используют в производстве полимеров (полиэтилена, полипропилена и др.), растворителей (спирты, ацетон), антифризов (незамерзающих при низкой температуре охлаждающих жидкостей), волокна лавсана, взрывчатых веществ, а также синтетических каучуков.
Определение: Этилен, как непредельный углеводород, определяют по обесцвечиванию бромной воды и раствора перманганата калия.
Ацетиленовые и диеновые углеводороды. Ацетилен

Молекула ацетилена 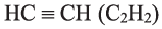
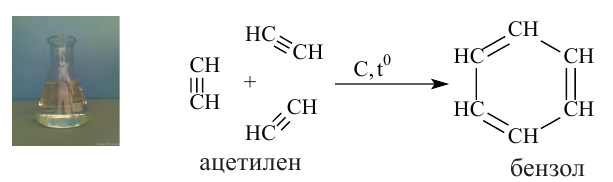
На примере ацетилена рассмотрим получение свойства и применение алкинов.
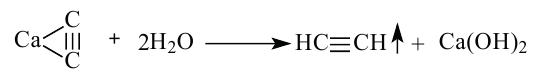
Получение: В промышленности ацетилен получают из метана и карбида кальция:
Гидролизом карбида кальция ацетилен получают и в лаборатории.
Это интересно: Специфический запах ацетилена, получаемого из технического карбида кальция, обусловлен присутствием в нем примесей сероводорода и газа фосфина (РНз) (поэтому такой ацетилен ядовит).
Химические свойства: Ацетилен, как и этилен, вступает в реакции присоединения, полимеризации и окисления.
I. Реакции присоединения. Ацетилен присоединяет водород, галогены, галогеноводороды и воду.
(а) 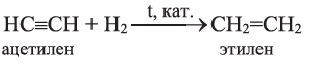
Присоединение галогенов протекает очень легко; например, если ацетилен пропустить через желтовато-бурый раствор бромной воды, то в результате присоединения брома к ацетилену раствор обесцветится. Присоединение идет в две стадии:
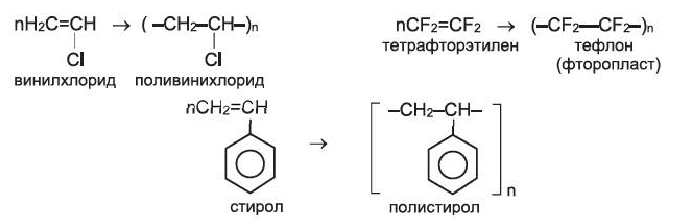
При присоединении 1 моль хлороводорода к ацетилену образуется очень ценный мономер — винилхлорид:
Полимеризацией винилхлорида получают поливинилхлорид (стр. 191).
Присоединением воды к ацетилену получают уксусный альдегид — вещество с неприятным запахом (реакция М.Кучерова):
II. Реакции полимеризации. В присутствии катализатора ацетилен димеризуется в винилацетилен-.
III. Реакции окисления. Ацетилен, как и этилен, легко окисляется. При пропускании ацетилена через раствор перманганата калия, раствор обесцвечивается. При этом ацетилен окисляется в щавелевую кислоту:
В отличие от метана и этилена, ацетилен на воздухе горит коптящим пламенем. В кислороде ацетилен горит ослепительно ярким пламенем (выделяя большое количество тепла):
Смеси ацетилена с воздухом или кислородом взрывоопасны.
Применения: Ацетилен используется при резке и сварке металлов, в производстве уксусной кислоты, этилового спирта, синтетических каучуков, поливинилхлоридных смол, клеев, растворителей
Определение ацетилена: Ацетилен, как непредельный углеводород, определяют по обесцвечиванию бромной воды и раствора перманганата калия при пропускании ацетилена через эти растворы.
Вычисления связанные с строением алканов и алкенов:
Определите пространственное строение молекул этилена и ацетилена и вычислите число 
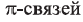
Решение.
b) учитывая, что двойная С=С связь состоит из одной 
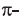
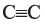
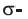
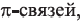
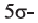
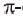
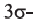
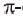
• Ациклические углеводороды, в молекулах которых между атомами углерода имеются две двойные связи, называются диеновыми углеводородами. Например,
Для алкадиенов характерны реакции присоединения и полимеризации.
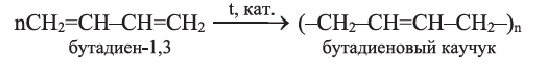
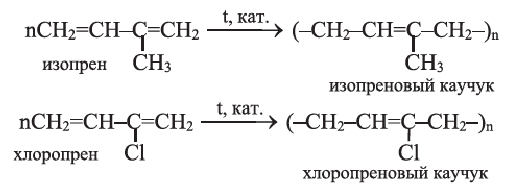
Полимеризацией бутадиена-1,3 и его производных получают промышленно важные каучуки:
Применение: Дивинил, изопрен и хлоропрен (2-хлорбутадиен-1,3) в качестве мономеров применяются в производстве соответствующих каучуков. Эти каучуки используются в производстве автомобильных шин и камер, а также других резиновых изделий.
Ключевые слова • уксусный альдегид • винилацетилен • щавелевая кислота • синтетические каучуки • реакция димеризации • хлоропрен •
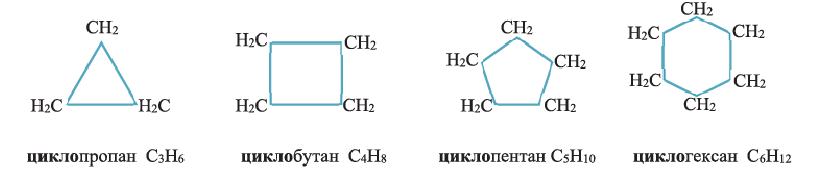
• Циклические углеводороды, в молекулах которых атомы углерода соединены между собой одинарными связями, называются циклопарафинами.
Состав циклоалканов так же, как и алкенов, выражается одной общей формулой 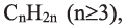
Названия циклоалканов образуются из названий алканов, с тем же числом атомов углерода, что и в цикле, с добавлением приставки «цикло». Например:
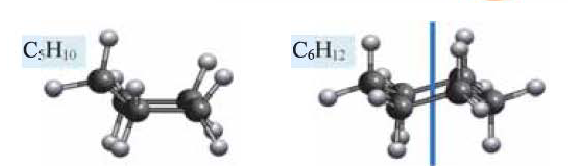
(а) Шаростержневые модели молекул циклолентана и циклогексана
По физическим свойствам циклоалканы похожи на алканы. По химическим свойствам циклоалканы, также, как и алканы, малоактивны.
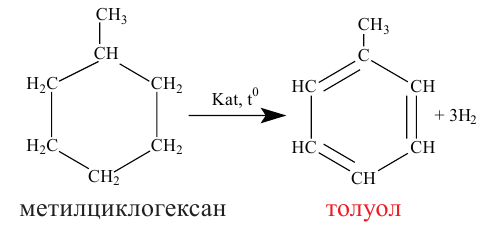
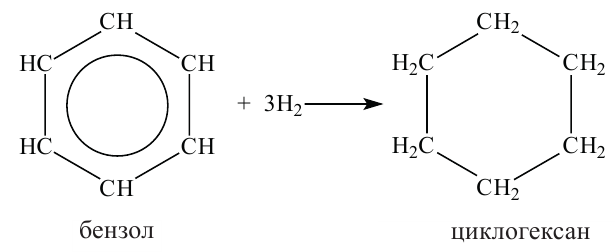
Получение: В промышленности циклоалканы выделяют из фракций нефти. Циклогексан и его гомологи получают также гидрированием ароматических углеводородов:
Применение. Циклогексан и метилциклогексан используют для получения бензола и толуола, а последние — в производстве красителей и лекарственных веществ. Циклопропан применяется в качестве наркоза.
Ароматические углеводороды
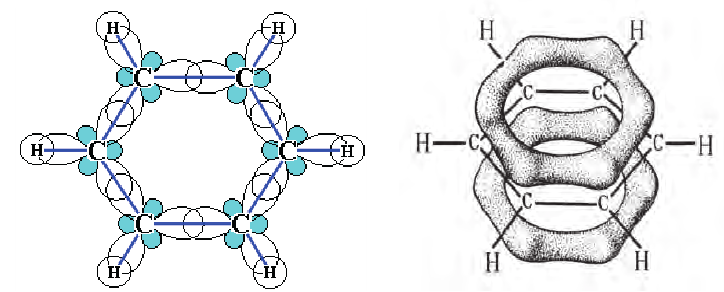
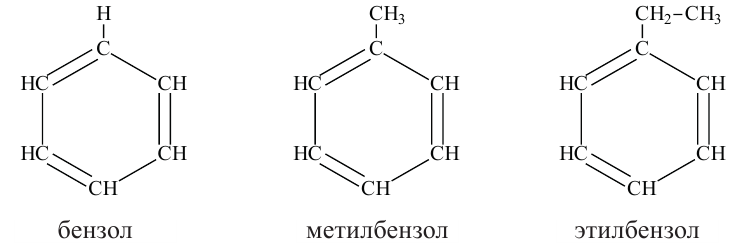
• Углеводороды, молекулы которых содержат одно или несколько бензольных колец, называются ароматическими углеводородами или аренами.
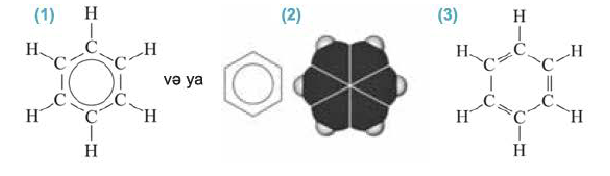
(b) Структурные формулы и шаровая модель молекулы бензола
Бензол получают из продуктов, образующихся при переработке нефти и каменного угля (из каменноугольной смолы стр.167).
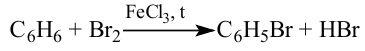
Бензол — бесцветная, летучая, легковоспламеняющаяся жидкость с характерным запахом. В воде не растворяется. При охлаждении он превращается в белую кристаллическую массу с температурой плавления 5,5°С. Кипит при 80,1°С. Бензол и его пары ядовиты. На воздухе горит коптящим пламенем. Не обесцвечивает бромную воду и раствор перманганата калия.
Применение. Бензол используется в производстве анилина, красителей, растворителей, средств защиты растений.
Вычисления на основе уравнения горения циклоалкана:
Для полного сжигания 2 л (н.у.) газообразного углеводорода затрачено 9 л кислорода. Определите формулу углеводорода, если при этом образовалось 6 л
Решение:
Поскольку объемные отношения газов в ходе реакции равны отношениям их стехиометрических коэффициентов, то уравнение реакции можно записать так;
При 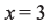
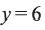
Природные источники углеводородов и их переработка
Почему сжигание нефти, попутных нефтяных газов и каменного угля не считается рациональным способом их использования?
Важнейшими источниками углеводородов являются нефть, природный газ, попутные нефтяные газы и каменный уголь.
Нефть
Нефть — маслянистая горючая жидкость от бурого до черного цвета, со специфическим запахом. Она легче воды (0,73—0,97г/мл) и в ней не растворяется. Нефть (сырая) состоит из смеси жидких, твердых и газообразных углеводородов. Поэтому она кипит не при постоянной температуре, а в некотором температурном интервале.
Продукты, получаемые из нефти, и их применение:
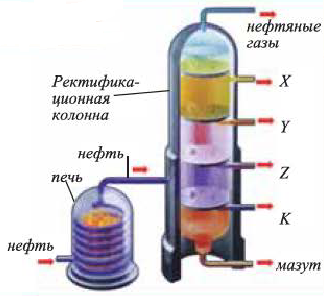
В промышленности осуществляют два типа переработки нефти — первичную и вторичную переработку. Первичная переработка нефти состоит в ее фракционной перегонке. Этот процесс проводят в ректификационной колонне. При этом выделяют — бензиновую, лигроиновую, керосиновую и газойлевую фракции. В остатке остается черная вязкая жидкость — мазут.
Бензин, образующийся при первичной переработке нефти, составляет всего 20% от исходной нефти. С целью увеличения выхода бензина осуществляют вторичную переработку.
Вторичной переработке подвергаются, главным образом: мазут, керосин и газойлевая фракция. При этом широко используют процессы термического и каталитического крекинга.
• Процесс образования углеводородов с меньшим числом атомов углерода в результате разложения углеводородов с большим числом атомов углерода, называется крекингом.
В обоих видах крекинга углеводороды состава 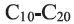
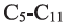
В отличие от первичной переработки нефти в ходе вторичной переработки происходят химические превращения углеводородов.
Природный газ. Попутные нефтяные газы
Наша республика имеет большие запасы природного газа и попутных нефтяных газов.
Природный газ в основном, состоит из метана (80—90%) и его ближайших гомологов — этана, пропана и бутана. Он используется в быту и промышленности в качестве топлива. Он также является источником сырья для химической промышленности (стр. 153).
Попутные нефтяные газы или под давлением растворены в нефти, или расположены над слоем нефти. В их составе содержание метана меньше, чем в природном газе, но содержание его гомологов 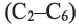
Каменный уголь
Кислородсодержащие и азотсодержащие производные углеводородов
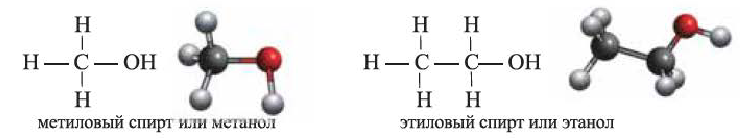
Предельные спирты, этанол, этиленгликоль и глицерин
• Производные предельных углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильные (ОН) группы, называются предельными спиртами.
Одноатомные предельные спирты — этанол:
(а) Структурные формулы и шаростержневые модели молекул метилового и этилового спиртов
Получение: Этанол получают в основном гидратацией этилена в присутствии катализатора:
Этанол получают также брожением сахаристых веществ, содержащих в своем составе глюкозу или остатки глюкозы (в присутствии дрожжевых грибков):
Физические свойства: Этанол (винный спирт) — бесцветная жидкость с (характерным) алкогольным запахом, кипящая при 78°С; легко воспламеняется. Он легче воды и с водой смешивается в любых соотношениях. Многие органические вещества хорошо растворяются в нем.
Этанол — вещество, обладающее наркотическим действием. Для того, чтобы не употребляли внутрь этиловый спирт, используемый для технических нужд, к нему добавляют плохо пахнущие и красящие вещества. Такой спирт называют денатуратом. Раствор спирта, содержащий 96% спирта и 4% воды, называют медицинским спиртом.
Химические свойства: При температуре выше 140°С в присутствии концентрированной серной кислоты этанол дегидратируется, образуя этилен:
Этанол на воздухе горит слабозаметным синеватым пламенем:
При слабом нагревании с оксидом меди (II) этанол окисляется в уксусный альдегид, обладающий неприятным запахом:
Вычисления связанные с составом спиртов:
Выразите относительную молекулярную массу спиртов 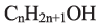
Решение:
Учитывая значение 
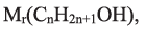
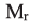
Метанол — очень ядовитая, обладающая характерным алкогольным запахом, бесцветная жидкость, кипящая при 68°С; с водой смешивается в любых соотношениях.
Предельные спирты, содержащие две и три ОН группы, называются соответственно, двухатомными и трехатомными спиртами. Простейшим представителем двухатомных спиртов является этиленгликоль, а трехатомных — глицерин:
(b) Структурные формулы и шаростержневые модели молекул этиленгликоля и глицерина
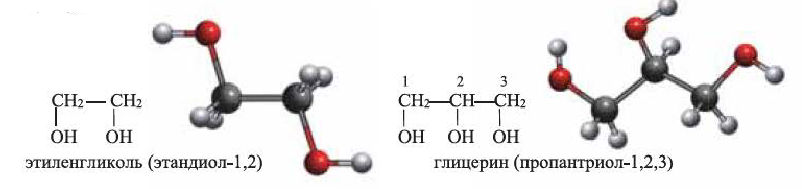
Глицерин применяется для получения нитроглицерина (тринитрата глицерина) и динамита. Он используется также в парфюмерии и медицине (в виде мазей) для придания мягкости коже, в кожевенном производстве — для предохранения кож от высыхания, а также в производстве мыла. 1%-ный спиртовой раствор нитроглицерина применяют в качестве сосудорасширяющего средства при сердечно-сосудистых заболеваниях.
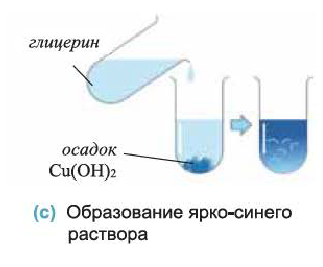
Определение: Определение глицерина и этиленгликоля как многоатомных спиртов основывается на их способности образовывать растворы ярко-синего цвета при взаимодействии со свежеполученным осадком гидроксида меди (II) (с). Одноатомные предельные спирты с гидроксидом меди (II) не реагируют.
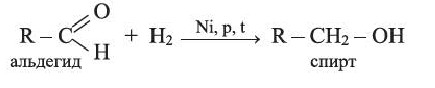
Предельные альдегиды, уксусный альдегид
• Производные предельных углеводородов, в молекулах которых углеводородный радикал связан с альдегидной группой 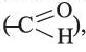
Общая формула альдегидов: R 

Физические свойства: Ацетальдегид — бесцветная, летучая 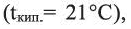
Формальдегид — ядовитый газ. Его 40%-ный водный раствор называют формалином.
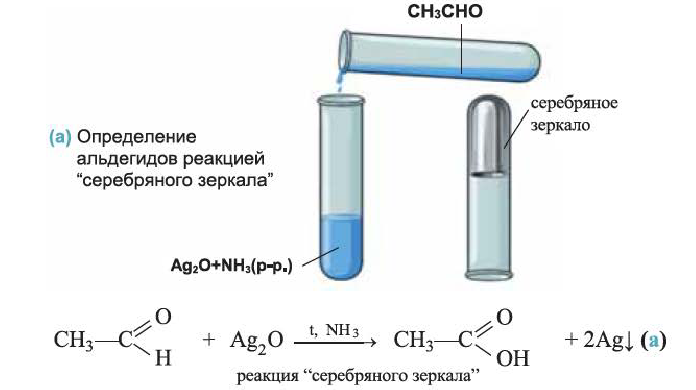
Химические свойства: Ацетальдегид вступает в реакции окисления и присоединения. Например, при действии аммиачного раствора оксида серебра (I) 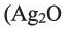
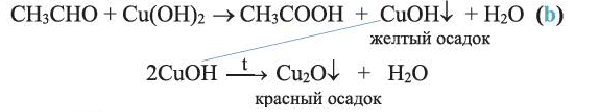
При слабом нагревании уксусный альдегид окисляется и со свежеосажденным гидроксидом меди(II):
Обе реакции (а, b) используются для определения альдегидов. Альдегиды горят, образуя углекислый газ и воду:
Присоединяя водород, альдегиды восстанавливаются до спиртов:
Вычисления, связанные с составом альдегидов:
Выразите относительную молекулярную массу предельных альдегидов 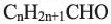
Решение:
Учитывая значения 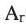
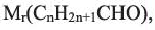
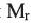
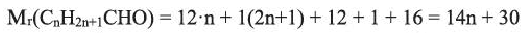
Применение: Из уксусного альдегида получают уксусную кислоту, пластмассы и лекарственные препараты.
Формальдегид используется в производстве различных смол, красителей, лекарственных препаратов. Он применяется для дубления кож, консервирования анатомических препаратов, дезинфекции хирургических инструментов, а также при протравливании семян перед посевом.
Определение: Определение альдегидов основывается на их окислении по реакции «серебряного зеркала» и свежеосажденным гидроксидом меди (II).
Карбоновые кислоты, уксусная кислота и высшие карбоновые кислоты
• Органические соединения, в молекулах которых углеводородный радикал связан с одной или несколькими карбоксильными (-СООН) группами, называются карбоновыми кислотами.
(а) Структурные формулы и шаростержневые модели муравьиной и уксусной кислот
Получение: В промышленности окислением бутана кислородом воздуха в присутствии катализатора получают уксусную кислоту:
Химические свойства: Уксусная кислота обладает общими свойствами минеральных кислот: в воде частично диссоциирует; с активными металлами, щелочами, основными оксидами и с солями более слабых кислот вступает в реакции:
Применение: Уксусная кислота применяется в производстве пластмасс, различных красителей, лекарственных препаратов, ацетатного волокна, негорючей кинопленки и др. Она применяется также при консервировании овощей и как столовый уксус.
Определение: Уксусную кислоту можно отличить по ее характерному запаху.
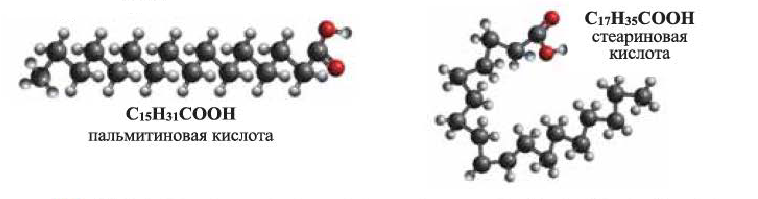
Важнейшими представителями предельных одноосновных высших карбоновых кислот являются пальмитиновая (гексадекановая) и стеариновая (октадекановая) кислоты:
(b) Шаростержневые модели молекул пальмитиновой и стеариновой кислот
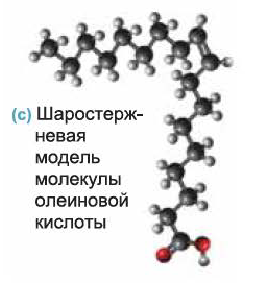
Из непредельных карбоновых кислот, содержащих в углеводородном радикале одну С=С связь, большое практическое значение имеет олеиновая кислота
Вычисления связанные с составом карбоновых кислот
Выразите относительную молекулярную массу предельных карбоновых кислот 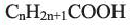
Решение.
Учитывая значения 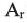
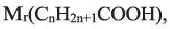
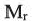
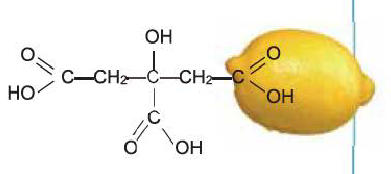
Лимонная кислота проявляет свойство трехосновной карбоновой кислоты. Содержится, в основном, в лимоне и других цитрусовых растениях.
Применяется в пищевой промышленности при приготовлении освежающих напитков и карамельных изделий, а также в фармацевтике.
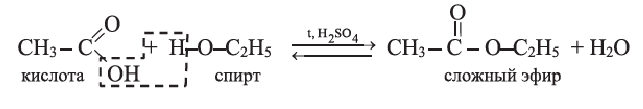
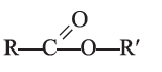
Сложные эфиры
• Органические соединения, образующиеся в результате взаимодействия карбоновых кислот со спиртами, называются сложными эфирами, а сами реакции — реакциями этерификации:
Общую формулу сложных эфиров можно представить так:
Сложные эфиры одноосновных карбоновых кислот с небольшой молекулярной массой — малорастворимые в воде летучие жидкости, легче воды. Многие из сложных эфиров имеют приятный фруктовый запах. Они содержатся в цветах, фруктах, плодах и ягодах. Специфический аромат этих растений обусловлен присутствием в их составах сложных эфиров (а, b, с).
Это интересно: Изоамиловый эфир уксусной кислоты имеет запах груш (а), метиловый эфир бутановой кислоты — запах яблок (b), этиловый эфир бутановой кислоты — залах ананаса (c). 
Сложные эфиры используются в качестве растворителя эфиров целлюлозы. Сложные эфиры в виде фруктовых эссенций, наряду с другими душистыми веществами, применяются в производстве фруктовых соков, освежающих напитков, карамельных изделий, а также в изготовлении духов и одеколонов.
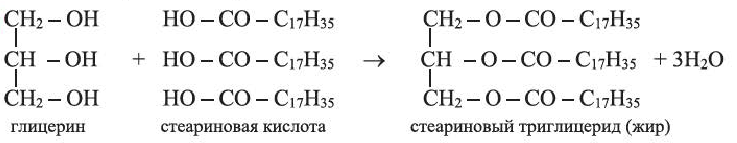
Жиры
В состав жиров входят, главным образом, остатки пальмитиновой, стеариновой и олеиновой кислот. Впервые триглицерид стеариновой кислоты (d) был синтезирован М.Бертло в 1854 г:
(d)
Жиры животного происхождения (говяжий, бараний жир) обычно бывают твердыми, большинство растительных жиров (подсолнечное, кукурузное, оливковое масло) — жидкие жиры.
В технике гидролиз жиров (реакция, обратная реакции (d), широко используется для получения глицерина, карбоновых кислот, мыл, стеарина. Являясь составной частью пищи, жиры играют большую роль в жизни животных и человека. Они являются основным источником энергии в организме.
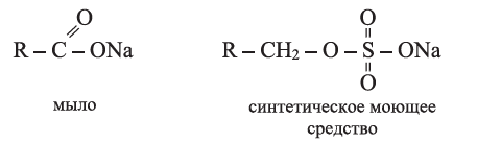
Мыла и другие моющие средства
Раньше мыла получали гидролизом растительных и животных жиров в присутствии щелочи или соды. Поэтому гидролиз жиров в присутствии щелочи называют омылением.
В настоящее время карбоновые кислоты, используемые в производстве мыл, получают окислением парафинов нефти:
В быту и на производстве вместо мыла используют синтетические моющие средства, например, стиральные порошки. Преимущество синтетических моющих средств состоит в том, что они, в отличие от обычных мыл, не теряют моющие свойства в жесткой воде. В общем виде формулы мыл и синтетических моющих средств можно представить следующим образом:
Углеводы
— Что объединяет муку, древесные опилки, сахар, яблоко, виноград?

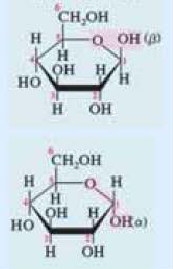
Углеводы подразделяются на моносахариды, дисахариды и полисахариды. Моносахариды — углеводы, неподвергающиеся гидролизу. К ним относятся глюкоза, фруктоза и др. Дисахариды — углеводы, при гидролизе которых из одной молекулы образуются две молекулы моносахарида. К дисахаридам относятся сахароза, мальтоза и др. Полисахариды — углеводы, при гидролизе которых из одной молекулы образуется много молекул моносахаридов. Полисахаридами являются крахмал, целлюлоза и др.
Глюкоза в больших количествах содержится в виноградном соке (поэтому ее называют виноградным сахаром), меде, спелых фруктах и ягодах. В организме человека глюкоза содержится в мышцах и в крови (до 0,1%). В растениях глюкоза образуется в ходе процесса фотосинтеза:
Поскольку молекулярные формулы глюкозы и фруктозы одинаковы, то они являются изомерами друг друга.
Глюкоза используется в медицине для консервирования крови и укрепления ослабленного организма. Она применяется в карамельной промышленности (в производстве карамели, мармелада, помадки и др.), в текстильной промышленности при нанесении узоров на ткани, в синтезе витамина С (аскорбиновой кислоты). В технике брожением глюкозы получают этиловый спирт.
Из углеводов более сложное строение имеют крахмал и целлюлоза.
Крахмал — природный полимер 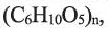
Крахмал получают, в основном, из картофеля, а также из риса и кукурузы.
Крахмал применяется для получения декстринов, патоки (смесь декстринов с глюкозой), использующихся в производстве карамельных изделий, глюкозы и этилового спирта. Его используют как клеящее вещество, а также для накрахмаливания тканей. В медицине крахмал используется для приготовления присыпок, медицинских паст, при изготовлении таблеток и капсул для лекарств.
Определение крахмала основывается на образовании синего окрашивания при его взаимодействии с йодом (а).

(а) Посинение крахмала, содержащегося в картофеле, под влиянием йода
* молекула 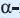
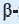
Целлюлоза, по сравнению с крахмалом, более распространенный углевод. Он образует стенки всех растительных клеток. В древесине содержится около 50% целлюлозы, а в волокнах хлопка и фильтровальной бумаге — до 98%.
Целлюлоза, как и крахмал, природный полимер состава 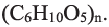
Целлюлоза — белое, твердое вещество, в воде и в обычных органических растворителях (спирт, эфир, ацетон) не растворяется. Как и крахмал, целлюлоза при нагревании в разбавленных кислотах подвергается гидролизу: при этом образуется 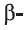
Целлюлоза в виде льна и хлопка используется в производстве тканей. Большое ее количество расходуется в производстве бумаги и этилового спирта. Этиловый спирт получают путем брожения глюкозы, образующейся при гидролизе целлюлозы:
Вычисления, связанные с гидролизом крахмала и брожением глюкозы
Сколько кг глюкозы можно получить гидролизом 324 кг крахмала. Выход глюкозы составляет 80%
Решение:
Вначале вычислим теоретически ожидаемую (базу потери) массу глюкозы, которую можно получить гидролизом 324 кг крахмала. Так как выход 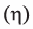
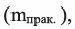
Белки
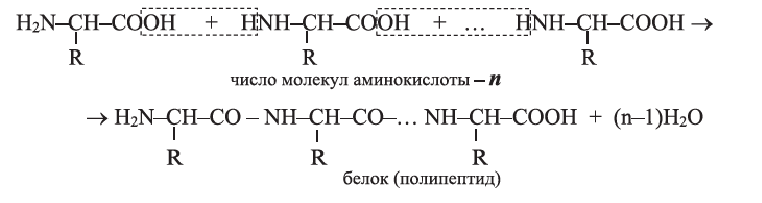
Аминокислоту можно рассматривать как производное карбоновой кислоты, в углеводородном радикале которого атом Н замещен на 
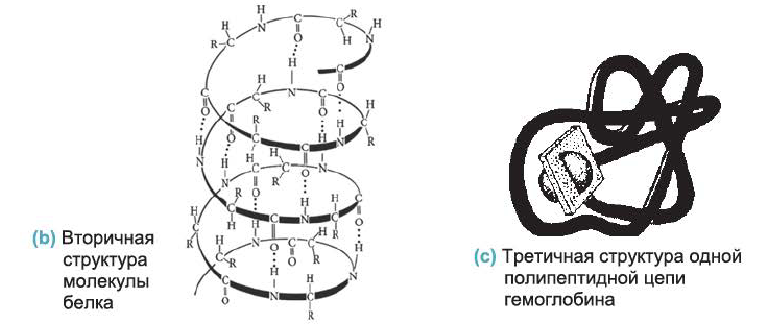
• Реакции образования высокомолекулярного вещества из низкомолекулярного, сопровождающиеся выделением в качестве побочного продукта, например воды, называются реакциями поликонденсации.
В молекуле полимера эта связь многократно повторяется, поэтому полимер называют полипептидом.
Строение и свойства белков:
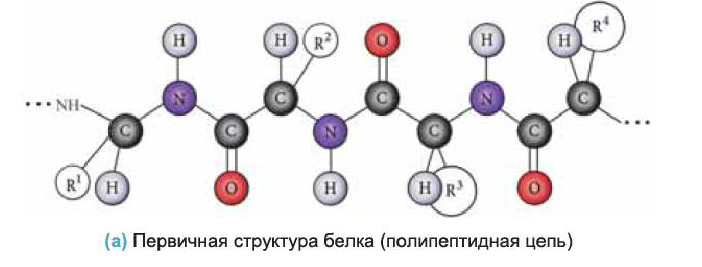
Белки имеют сложное строение. В настоящее время различают первичную, вторичную, третичную и четвертичную структуры белковой молекулы.
• Последовательность аминокислотных остатков в полипептидной цепи называется первичной структурой белка. Например, первичная структура белка, изображенного внизу, определяется 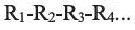
• Вторичная структура белка — пространственная форма полипептидной цепи в отдельных ее участках. В большинстве природных белков полипептидная цепь имеет спиралеобразную форму (b). Такую форму вторичной структуры белка называют
• Третичная структура белка — форма, которую спираль приобретает в пространстве. В простейшем случае третичную структуру белка можно представить в виде клубка, в который свернулась спираль, например, как в случае одной полипептидной цепи гемоглобина (с).

Проводил исследования в области химии белков и ферментов. Выдвинул теорию строения молекулы белка (1888).
Лауреат Нобелевской премии (1902). Исследования посвящены химии углеводов и белков. Синтезировал ряд физиологически активных веществ.
Характерные химические свойства белков определяются их способностью подвергаться гидролизу, денатурации и вступать в цветные реакции. Гидролизом белков получено примерно 20 разных аминокислот:
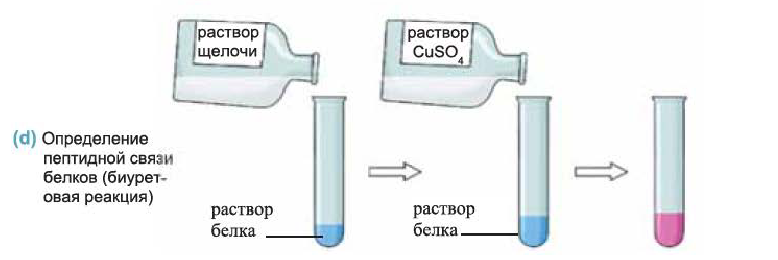
Определение белков. Определение белков основывается на их способности вступать в цветные реакции и на появлении запаха жженых перьев при их сильном нагревании или горении. Например, при действии на белок в щелочной среде водным раствором сульфата меди(II), раствор окрашивается в красно-фиолетовый цвет (d).
Эта реакция (называется биуретовой реакцией) доказывает наличие пептидных связей в исследуемом веществе.
Значения белков:
В промышленности белки применяются в виде природных волокон (шелк, шерсть), кожи, пластмасс и клеев.
В настоящее время многие белковые вещества — гормоны, ферменты, антибиотики—получают биотехнологическими методами с помощью микроорганизмов.
Поликонденсация аминокислоты и гидролиз полипептида
При поликонденсации аминокислоты образовалось 7,2 г воды и 30,3 г пентапептида. Вычислите 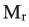
Решение:
Найдя массу аминокислоты, вступившей в реакцию: 30,3 + 7,2 = 37,5 г из уравнения реакции вычислим 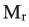
• Вещества, состоящие из многократно повторяющихся групп атомов, называются полимерами или высокомолекулярными соединениями.
Молекулы полимерных веществ (макромолекулы) имеют большие относительные молекулярные массы
Полимеры получают реакциями полимеризации и поликонденсации.
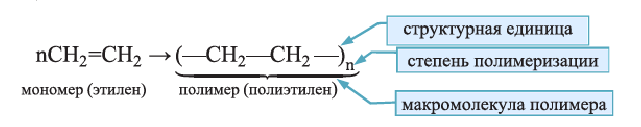
• Реакции образования высокомолекулярных веществ в результате многократного соединения молекул мономеров друг с другом называются реакциями полимеризации.
Реакция полимеризации характерна, в основном, непредельным соединениям и протекает за счет разрыва двойных или тройных связей в исходных молекулах. Например, реакцию полимеризации этилена схематично можно представить так:
Низкомолекулярные вещества, образующие полимеры, называют мономерами. Группы атомов, многократно повторяющиеся в макромолекуле, называют структурной единицей полимера. Число структурных единиц в макромолекуле называют степенью полимеризации (n). Если обозначить «относительную молекулярную массу» структурной единицы как 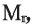
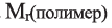
Реакцию полимеризации этилена можно представить следующим образом:
К важнейшим полимерам, получаемым реакцией полимеризации, наряду с полиэтиленом и полипропиленом, относятся также поливинилхлорид, тефлон (политетрафторэтилен), полистирол и др.:
Реакцией поликонденсации образуются белки, в промышленности получают волокна капрона и лавсана (стр. 193). В промышленности совместной поликонденсацией формальдегида с фенолом получают фенолформальдегидную смолу, имеющую важное практическое значение. Реакцию образования фенол-формальдегидной смолы, можно представить так: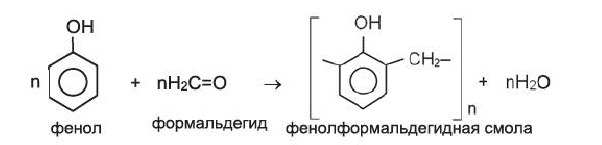
По происхождению полимеры подразделяют на 3 группы: природные (биополимеры), искусственные и синтетические полимеры.
По строению макромолекулы различают полимеры линейного (а), разветвленного (b) и сетчатого (с), строения. Линейными полимерами являются полиэтилен низкого давления, целлюлоза, лавсан, капрон, природный каучук, полистирол; разветвленными полимерами — гликоген, полиэтилен высокого давления, сетчатыми полимерами — фенолформальдегидные смолы, резина (вулканизированный каучук) и др.
Вычисления, связанные с относительной молекулярной массой полимера
Вычислите степень полимеризации полиэтилена, если относительная молекулярная масса полимера равна
Решение.
Пластмассы и волокна
Пластмассы — полимерные материалы, способные приобретать при нагревании заданную форму и сохранять ее после охлаждения.
Из-за своей легкости, большой механической прочности, высокой химической стойкости, хороших теплоизоляционных и электроизоляционных свойств пластмассы находят широкое практическое применение.
Например, такие пластмассы, как полиэтилен, полипропилен, поливинил-хлорид, полистирол и его сополимеры, фенолформальдегидные смолы и др. применяются в различных областях промышленности, сельского хозяйства, в медицине, быту и т.д.
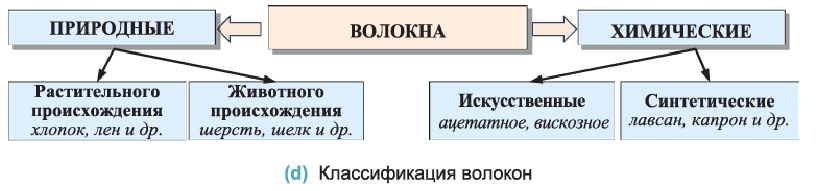
Волокна — природные и синтетические полимеры, способные вытягиваться в длинные гибкие нити, из которых изготавливают пряжу и другие текстильные изделия
Различают волокна природные и химические. Природные или натуральные волокна подразделяются на волокна растительного и животного происхождения (d), например, хлопок, лен, шерсть и шелк.
Химические волокна подразделяются на искусственные и синтетические.
Искусственные ацетатное и вискозное волокна получают химическими превращениями целлюлозы. Синтетические волокна изготавливают из синтетических полимеров; например, капрона, нейлона и лавсана.
Состав и способы получения волокон будут рассмотрены в последующих классах.
Углеводороды
Углеводороды — соединения, от которых происходят все органические вещества. Они широко распространены в природе; из них почти полностью состоят нефть и природный газ. Эти полезные ископаемые и продукты их переработки используют в качестве топлива, горючего, сырья в производстве полимерных материалов, средств защиты растений, товаров бытовой химии, лекарств и т. п.
Слово «углеводород» происходит от двух слов — «углерод» (общее название простых веществ Карбона) и «водород» (название простого вещества Гидрогена).
Углеводороды — соединения Карбона с Гидрогеном.
Общая формула углеводородов — 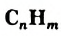
В 9 классе вы будете изучать насыщенные и ненасыщенные углеводороды. Существуют и другие названия этих соединений — предельные углеводороды, непредельные углеводороды.
Углеводороды, в молекулах которых атомы Карбона соединены друге другом простыми ковалентными связями, называют насыщенными, а имеющие также двойные и или тройные связи — ненасыщенными.
Насыщенные углеводороды получили такое название потому, что каждый атом Карбона в их молекулах использует свои валентные возможности в полной мере, соединяясь с максимальным числом других атомов.
Метан
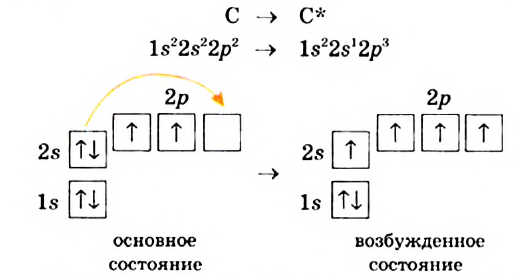
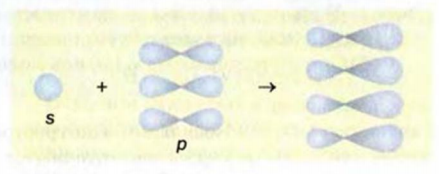
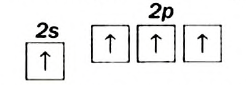
Строение молекулы: В молекуле метана, как и в молекулах других органических соединений, атом Карбона четырехвалентный. Чтобы проявлять такую валентность, он должен иметь четыре неспаренных электрона. Это достигается путем возбуждения атома и перехода одного электрона из 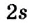
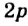
Каждая внешняя орбиталь возбужденного атома Карбона содержит один электрон.
За счет четырех неспаренных электронов атома Карбона и электронов четырех атомов Гидрогена в молекуле метана образуются четыре общих электронных пары:
Приведенные формулы не отражают пространственного строения молекулы метана. В соответствии с ними все атомы в молекуле должны находиться в одной плоскости, а углы между соседними черточками-связями — составлять 90°. На самом деле это не так.
Рис. 45. 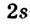
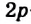
При образовании молекулы метана 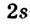
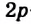
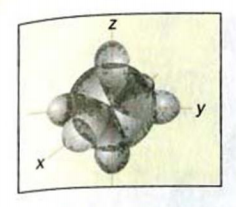
Рис. 46. Размещение орбиталей в молекуле метана
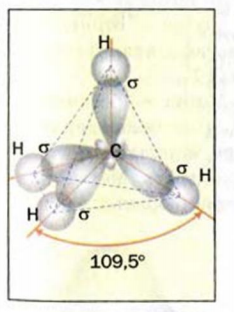
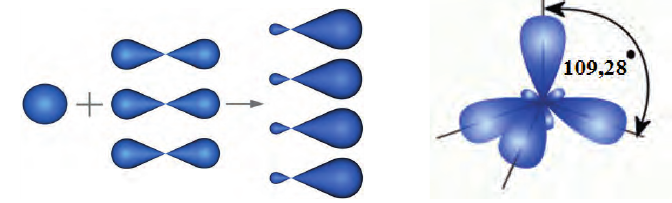
Изменившиеся орбитали размещаются в трехмерном пространстве на одинаковом удалении друг от друга под углами 109,5° (рис. 46).
Больший «лепесток» каждой новой орбитали атома Карбона перекрывается со сферической орбиталью одного из атомов Гидрогена. Так образуются четыре ковалентные связи С-Н. Перекрывание орбиталей атомов Карбона и Гидрогена происходит вдоль линий, которые соединяют центры атомов. Такую кова-лентную связь называют простой, или 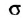
Если соединить линиями центры всех атомов Гидрогена, то получим геометрическую фигуру — тетраэдр’ (рис. 46). Поэтому говорят, что молекула метана имеет тетраэдрическое строение. Слово тетраэдр происходит от греческих слов tetra — четыре и hedra — поверхность. Тетраэдр имеет четыре одинаковые грани, которые являются правильными треугольниками.
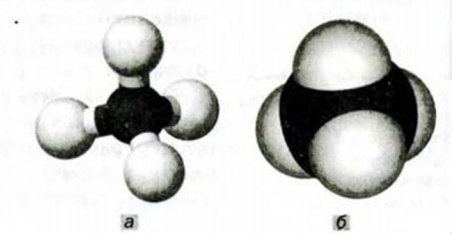
Модели молекулы метана изображены на ‘ рисунке 47. Существуют компьютерные программы, с помощью которых можно «построить» модель любой молекулы.
Рис. 47. Модели молекулы метана: а — шаростержневая; б — масштабная. Белые шарики — атомы Гидрогена, черные — атомы Карбона
Поскольку электроотрицательности Карбона и Гидрогена отличаются мало, то ковалентная связь С-Н является малополярной. Однако сама молекула 
Метан не взаимодействует с водой (в обычных условиях), металлами, оксидами, основаниями, кислотами, солями. Соединение реагирует с кислородом и галогенами — фтором, хлором, бромом.
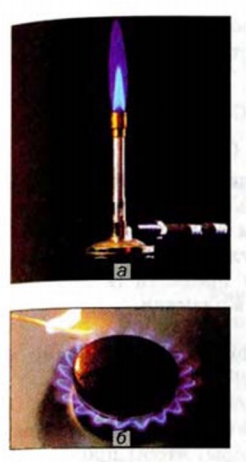
Рис. 48. Горение метана: а — в газовой горелке; б — в конфорке бытовой плиты
Обратите внимание: в уравнениях реакций с участием органических соединений записывают стрелки, а не знаки равенства.
Определить продукты реакции горения метана можно с помощью опыта, изображенного на рисунке 49. Изменение белого цвета безводного купрум(II) сульфата на голубой свидетельствует об образовании при горении метана водяного пара, который взаимодействует с солью (продукт реакции — медный купорос). Помутнение известковой воды вызывает кальций карбонат, образующийся в результате реакции углекислого газа с раствором кальций гидроксида.
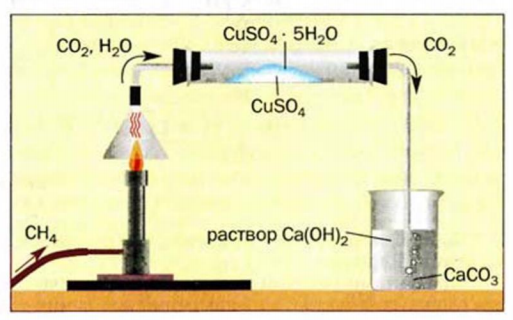
Рис. 49. Обнаружение Продуктов горения метана
Если воздуха (кислорода) недостаточно, то при горении метана может образовываться угарный газ или углерод:
О недостатке кислорода при горении метана может свидетельствовать увеличение яркости пламени (оно становится желтым из-за раскаленных мелких частиц углерода) или появление копоти на поверхности предмета (кастрюли, чайника), находящегося в пламени. Копоть, или сажа, — вещество, которое почти полностью состоит из атомов Карбона.
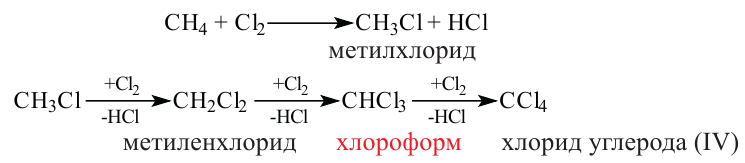
Реакцию между органическим соединением и хлором называют реакцией хлорирования, а ее продукты — хлоропроизводными этого соединения.
Хлорирование метана можно проиллюстрировать такой схемой:
В ней над каждой стрелкой указана формула реагента, а под стрелкой — формула «второстепенного» продукта реакции (в данном случае — хлороводорода). Такую запись последовательных реакций используют в органической химии довольно часто.
Осуществить какую-либо одну стадию взаимодействия метана с хлором не удается; всегда одновременно образуются несколько хлоропро-изводных этого углеводорода.
Смесь 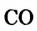
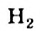
Осуществляя эту реакцию, в промышленности получают водород и сажу — наполнитель резины.
Рис. 50. Автобус, двигатель которого работает на природном газе
Выводы:
Гомологи метана (алканы)
Формулы соединений: В предыдущем параграфе шла речь о простейшем насыщенном углеводороде — метане 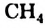
Затем от каждого атома Карбона проведем столько дополнительных черточек, чтобы их у него было всего четыре (атом Карбона четырехвалентный):
После этого допишем к каждой черточке атом Гидрогена и получим формулы соответствующих углеводородов:
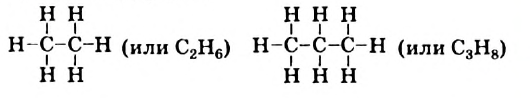
Составленные структурные формулы молекул можно записать в сокращенном виде, оставив черточки только между атомами Карбона:
Таким способом можно вывести структурные формулы молекул других углеводородов с простыми ковалентными связями и открытой неразветвленной цепью из атомов Карбона.
Углеводороды 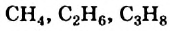
Гомологическим рядом называют ряд органических соединений, молекулы которых имеют сходное строение и отличаются по составу на одну или несколько групп атомов 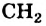
Группа атомов 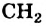
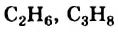
Насыщенные углеводороды, в молекулах которых имеется открытая цепь из атомов Карбона, называют алканами.
Для того чтобы составить химическую формулу алкана с четырьмя атомами Карбона в молекуле, достаточно добавить к формуле 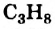
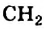
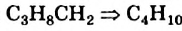
Если алкан содержит 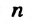
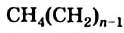
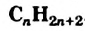
Строение молекул. Вам известно, что молекула метана имеет форму тетраэдра. Выясним пространственное строение молекул других алканов.
Рис. 51. Шаростержневая модель молекулы этана
В соответствии с моделями молекул этана (рис. 51) и пропана, все атомы в них размещены не на плоскости, а в трехмерном пространстве. В молекулах пропана, бутана (рис. 52), других гомологов метана центры атомов Карбона находятся на ломаной, зигзагообразной линии. Поэтому сокращенные структурные формулы молекул пропана и бутана должны выглядеть так:
В школьном курсе химии для упрощения используют не зигзагообразные, а линейные структурные формулы молекул углеводородов.
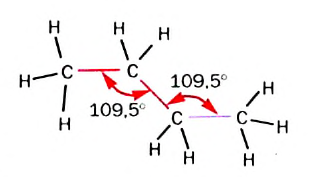
Рис. 52. Зигзагообразная форма карбоновой цепи молекулы бутана
Выводы:
Изомерия:
Для молекулы 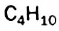
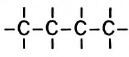
Соответствующие структурные формулы и их сокращенные варианты имеют такой вид:
Каждая формула отвечает определенной молекуле. Таким образом, существуют два насыщенных углеводорода с одинаковыми химическими формулами 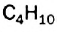
Соединения, молекулы которых имеют одинаковый состав, но разное строение, называют изомерами, а явление существования таких соединений — изомерией.
С увеличением числа атомов Карбона в молекулах углеводородов количество изомеров резко возрастает. Для соединений 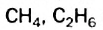
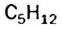
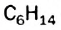
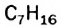
Явление изомерии — одна из причин разнообразия и многочисленности органических соединений.
Если молекула углеводорода имеет неразветвленное («нормальное») строение, то перед его названием записывают букву н и дефис. Например, соединение с формулой 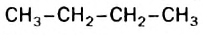
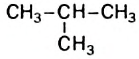
Свойства и применение алканов
Физические свойства: Этан, пропан и бутан в обычных условиях (при температуре 20 °С) являются газами, следующие двенадцать гомологов метана — жидкостями (они имеют характерный, «бензиновый» запах), а остальные — твердыми веществами. Температуры плавления и кипения алканов с увеличением числа атомов Карбона в молекулах возрастают.
Гомологи метана — бесцветные вещества. Поскольку их молекулы практически непо-лярны, эти соединения нерастворимы в воде (рис. 54), но хорошо растворяются (во многих случаях — неограниченно) в органических растворителях и друг в друге.
Рис. 54. Смесь гексана (верхний слой) с водой
Распространенность в природе: Небольшие количества этана, пропана и бутана содержатся в природном газе, попутном нефтяном газе (он находится вместе с нефтью в ее месторождениях), а также в газе, который выделяется в угольных шахтах. В состав нефти (рис. 55) входят преимущественно жидкие насыщенные углеводороды, а пчелиного воска и озокерита (горный воск) — твердые.
Рис. 55. Нефть — природный источник гомологов метана
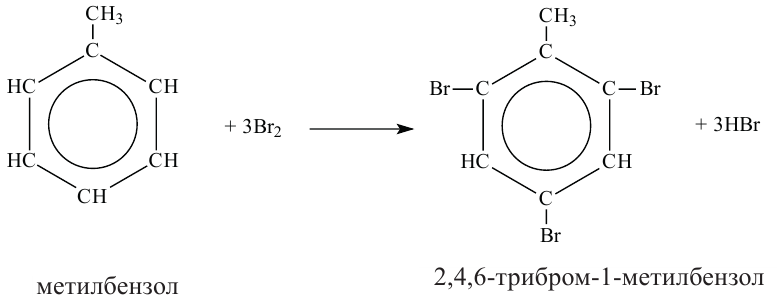
Реакции с галогенами: На свету или при нагревании насыщенные углеводороды реагируют с хлором и бромом. Это — реакции замещения.
Хлорирование этана начинается в соответствии с таким уравнением:
При дальнейшем взаимодействии веществ происходит замещение других атомов Гидрогена на атомы Хлора.
Реакции алканов со фтором сопровождаются разрывом связей 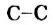
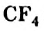
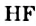
Реакции с кислородом: Все гомологи метана, как и другие углеводороды, при поджигании горят с образованием углекислого газа и водяного пара. С увеличением молекулярной массы углеводорода пламя становится ярче. Парафиновая свеча, в отличие от природного газа, горит ярко-желтым пламенем (рис. 56, а). Такой цвет обусловлен свечением раскаленных частиц сажи — одного из продуктов термического разложения углеводородов. Эти частицы быстро сгорают. Парафин — смесь твердых углеводородов с количеством атомов Карбона в молекулах от 18 до 35.
Если воздуха (кислорода) недостаточно, часть атомов Карбона окисляется не полностью, и образуется угарный газ или углерод. Такие условия можно создать, поместив в пламя свечи фарфоровую чашку. На ее поверхности появляется копоть — очень мелкие частицы сажи (рис. 56, б).
Рис. 56. Горение парафиновой свечи: а — в обычных условиях; б — при недостаточном доступе воздуха
Рис. 57 Баллон с пропан-бутановой смесью
Гомологи метана с количеством атомов Карбона в молекулах от 6 до 20 являются основными компонентами бензина и керосина.
Неполное сгорание автомобильного горючего, а также выделение из двигателя угарного газа приводят к существенному загрязнению воздуха в городах и на автомагистралях. Для уменьшения вредных выбросов к выхлопной трубе автомобиля присоединяют емкость с катализатором (рис. 58), который способствует превращению угарного газа и остатков горючего в углекислый газ и водяной пар.
Рис. 58. Насадка с катализатором в разрезе
Смеси жидких углеводородов — уайтспирит, петролейныи эфир — используют в качестве растворителей для лаков и красок. Разнообразное применение имеют вазелин (смесь жидких и твердых насыщенных углеводородов) и парафин.
Гомологи метана являются сырьем для производства многих важных органических соединений. Например, из бутана получают значительное количество уксусной кислоты.
Выводы:
Этилен
Вы знаете, что кроме насыщенных углеводородов существуют ненасыщенные углеводороды. В их молекулах атомы Карбона соединены не только простыми связями, но и кратными (двойными, тройными).
Простейшим углеводородом с двойной связью в молекуле является этилен. Его химическая формула — 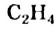
Другое название этого углеводорода — этен. Оно отличается от названия насыщенного углеводорода этана суффиксом ( -ен).
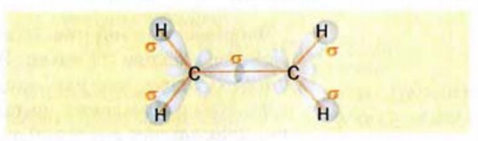
Строение молекулы: В соответствии с исследованиями ученых, все атомы молекулы этилена 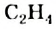
Рис. 59. Модели молекулы этилена: а — шаростержневая; б — масштабная
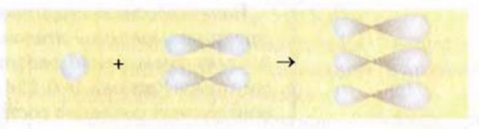
Как известно, атом Карбона образует кова-лентные связи за счет четырех неспаренных электронов 2-го энергетического уровня:
Этот атом соединен в молекуле этилена с другим атомом Карбона и двумя атомами Гидрогена. Он образует с ними три о-связи, в которых принимают участие s-электрон и два р-электрона. Орбитали, в которых находятся эти электроны, изменяют свою форму и становятся одинаковыми:
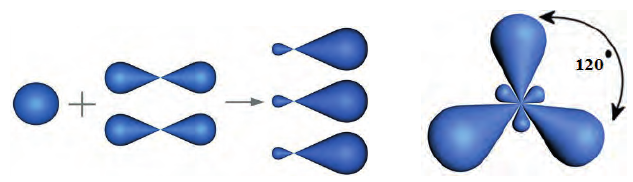
Оси новых орбиталей располагаются в одной плоскости, а углы между ними составляют по 120°:
Такие орбитали каждого атома Карбона перекрываются с аналогичной орбиталью другого атома Карбона и со сферическими орбиталями двух атомов Гидрогена:
Таким образом, между атомами Карбона в молекуле этилена существует двойная связь, которая состоит из 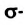
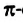
Наличие 
Химические свойства: Этилен химически активнее метана. Это обусловлено способностью двойной связи между атомами Карбона легко разрушаться и превращаться в простую связь.
Реакции присоединения (так в органической химии называют реакции соединения). Этилен взаимодействуете простыми веществами — водородом, галогенами, и сложными веществами — галогеноводородами, водой. Продуктами этих реакций являются насыщенные органические соединения.
С водородом этилен реагирует при нагревании и наличии катализатора. При этом двойная связь в молекуле 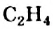
Реакции присоединения водорода к органическим соединениям называют реакциями гидрирования.
Взаимодействие этилена с галогенами сопровождается различными внешними эффектами. Реагируя со фтором, этилен воспламеняется, а смесь хлора с этиленом на свету взрывается. Этилен взаимодействует с бромом (рис. 60) и с его водным раствором — так называемой бромной водой (жидкость бурого цвета):
Обесцвечивание бромной воды при пропускании в нее этилена позволяет отличить этот газ от метана и других алканов, которые с растворенным бромом не реагируют.
Этилен также взаимодействует с галоген о водородами:
Присоединение этиленом воды (реакция гидратации) происходит в присутствии концентрированной сульфатной кислоты:
Рис. 60. Взаимодействие этилена с парами брома
Молекулы этилена могут соединяться друг с другом; при этом образуется известное вам вещество — полиэтилен. Эту реакцию, а также свойства ее продукта рассмотрим в следующем параграф.
Это интересно. Водный раствор 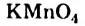
Получение этилена. В лаборатории этилен получают из этилового спирта:
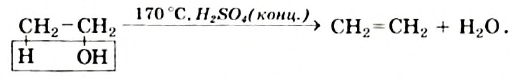
Реакцию отщепления воды от соединения называют реакцией дегидратации.
Применение: Этилен используют в большом количестве как сырье для производства полиэтилена, а также для получения этилового спирта, органических растворителей, других важных веществ. Добавление небольшого количества этилена в воздух теплиц ускоряет созревание овощей и фруктов.
Физиологическое действие: Продолжительное вдыхание воздуха, в котором содержится этилен, отрицательно влияет на нервную систему, приводит к нарушению кровообращения.
Выводы:
Полиэтилен
Полимеризация этилена: В определенных условиях молекулы этилена соединяются друг с другом вследствие разрушения двойных связей между атомами Карбона с превращением их в простые связи. Представим это такой схемой:
В квадратных скобках показаны молекулы этилена с разрушенными двойными связями.
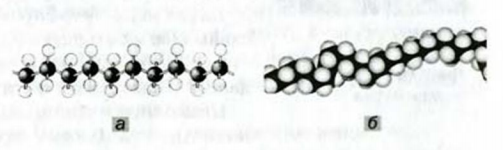
Взаимодействовать могут сотни и тысячи молекул этилена. Продуктом реакции является полиэтилен. Его очень длинные молекулы образованы соединенными друг с другом группами атомов 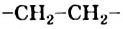
Рис. 61. Модели фрагментов молекулы полиэтилена: а — шаростержневая; б — масштабная
Реакцию соединения многих одинаковых молекул вследствие разрушения кратных связей называют реакцией полимеризации, исходное вещество — мономером, а продукт — полимером. Термины происходят от греческих слов poly — много, monos — один, единственный, meros — часть, доля.
Полимер — соединение, молекулы которого состоит из большого числа одинаковых групп атомов.
Сокращенная запись реакции полимеризации этилена:
В полиэтилене существуют молекулы различной длины, т. е. с разными значениями 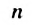
Свойства полиэтилена: Определим некоторые физические и химические свойства полиэтилена с помощью эксперимента.
Полиэтилен химически инертен; он не взаимодействует со щелочами, кислотами, не обесцвечивает раствор калий перманганата, а также бромную воду. Как и многие другие органические вещества, это соединение горит на воздухе.
Полиэтилен не растворяется в органических растворителях. Поэтому для их хранения используют полиэтиленовые емкости.
Изделия из полиэтилена морозоустойчивы, но не выдерживают нагревания выше температур 60—100 °С. При высокой температуре соединение разлагается с образованием этилена:
Применение полиэтилена: Полиэтилен является важнейшим полимерным материалом. Изделия из него мы постоянно используем в повседневной жизни. Это — пакеты, упаковочная пленка для пищевых продуктов, различные емкости, игрушки и т. п. (схема 3). Поскольку пленка из полиэтилена хорошо пропускает свет, ею покрывают теплицы для выращивания ранних овощей, цветов, тропических растений. Этот полимер используют в производстве промышленных емкостей, труб, конструкционных деталей, медицинского оборудования, а также как электроизоляционный материал, антикоррозионное покрытие.
Полиэтилен — нетоксичное вещество.
Выводы:
Молекулы этилена в определенных условиях могут соединяться друг с другом. Продуктом такого взаимодействия является полиэтилен. Превращение этилена в полиэтилен — пример реакции полимеризации. Эта реакция происходит за счет разрушения двойных связей между атомами Карбона.
Соединения, молекулы которых состоят из большого числа одинаковых групп атомов, называют полимерами.
Полиэтилен — один из важнейших полимеров. Он не растворяется в воде, химически инертен. Из полиэтилена производят пленку, емкости, различные изделия.
Тефлон
В последнее время существенно расширяется область применения полимера, который является производным полиэтилена; в его молекулах вместо атомов Гидрогена содержатся атомы Флуора. Этот полимер имеет формулу 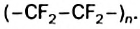
Тефлон внешне напоминает полиэтилен. Он не токсичен, имеет высокую химическую и термическую устойчивость, не поглощает воду, не горит, не разрушается концентрированными кислотами и их смесями, щелочами, окислителями, не растворяется и не набухает ни в одном из растворителей.
Тефлон является основой химически и термически устойчивых пластмасс. Его применяют в протезировании, для покрытия поверхности посуды, предназначенной для нагревания (рис. 63). Из тефлона изготовляют детали и фрагменты различного оборудования для химической промышленности, научных исследований, военной и космической техники.
Рис. 63. Посуда с тефлоновым покрытием
Пластмассы
Многие полимеры являются основой пластмасс — материалов, способных под влиянием температуры и давления приобретать определенную форму и сохранять ее.
Пластмассы, кроме полимеров, содержат различные добавки, которые улучшают их свойства, придают окраску, повышают устойчивость к химически агрессивным веществам и изменению внешних условий. Добавками служат измельченная древесина, мел. графит, бумага, различные волокна. Полимеры в таких пластмассах являются связующими компонентами. Некоторые добавки делают пластмассы эластичными. Если к мономеру добавить соединение, которое при нагревании разлагается с выделением газа, то после проведения реакции полимеризации получим материал, похожий на застывшую пену. Его называют пенопластом (рис. 64).
Ацетилен
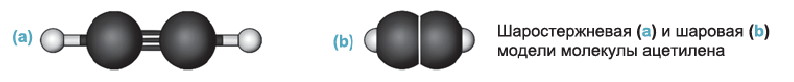
Рис. 65. Модели молекулы ацетилена: а — шаростержневая; б — масштабная
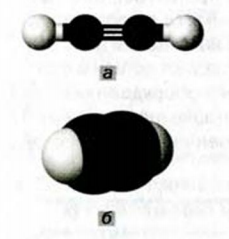
Простейшим ненасыщенным углеводородом с тройной связью в молекуле является ацетилен 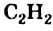
Этот углеводород имеет и другое название — этин. Оно отличается от названий углеводородов 
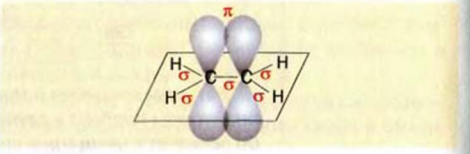
Строение молекулы: Модели молекулы ацетилена представлены на рисунке 65. В соответствии с ними, центры всех атомов в этой молекуле находятся на прямой линии.
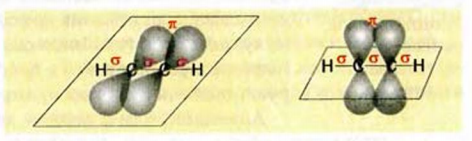
В молекуле ацетилена каждый атом Карбона соединен с двумя атомами — другим атомом Карбона и атомом Гидрогена. Поэтому из его четырех неспаренных электронов только два (s- и р-электрон) образуют 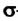

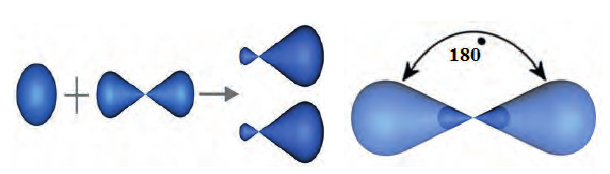
Их оси располагаются на одной линии (угол между ними составляет 180°):
Одна из изменившихся орбиталей каждого атома Карбона перекрывается с такой же орбиталью другого атома Карбона, а вторая — со сферической орбиталью атома Гидрогена. Центры всех атомов молекулы 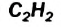
Оставшиеся два р-электрона каждого атома Карбона принимают участие в образовании двух 
Таким образом, в молекуле ацетилена образуется тройная связь. Она состоит из одной 
Наличие двух 
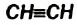
Это интересно: Ацетилен хранят и перевозят в баллонах, содержащих пористый наполнитель, пропитанный раствором этого газа в ацетоне.
Химические свойства: Ацетилен, будучи ненасыщенным углеводородом, вступает в реакции присоединения с галогенами, водородом, некоторыми сложными веществами.
Реакции присоединения: Ввиду наличия в молекуле ацетилена тройной связи реакции присоединения происходят в две стадии. Сначала молекула ацетилена присоединяет одну молекулу реагента (тройная связь между атомами Карбона превращается в двойную), затем — вторую (двойная связь превращается в простую).
Ацетилен, как и этилен, обесцвечивает бромную воду:
Аналогично ацетилен взаимодействует при низкой температуре с хлором. В обычных условиях смесь этих газов взрывается, появляется пламя и образуется черный дым, состоящий из мелких частиц сажи:
Взаимодействие ацетилена с водородом, как и с галогенами, проходит в две стадии:
Ацетилен также присоединяет галогеноводороды. Первая стадия одной из реакций:
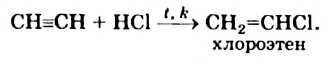
Пламя ацетилена очень яркое (рис. 66); в нем содержится небольшое количество раскаленных частиц углерода. Появление этого простого вещества среди продуктов реакции обусловлено тем, что некоторые атомы Карбона не успевают полностью окислиться, т. е. «перейти» в молекулы 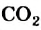
Рис. 66. Горение ацетилена, образующегося при реакции кальций карбида 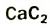
Если кислорода недостаточно, пламя становится коптящим вследствие образования заметного количества сажи:
При горении ацетилена в чистом кислороде температура достигает почти 3000 °С. Это используют для сварки и резки металлов.
Работая с ацетиленом, необходимо помнить, что его смеси с воздухом и кислородом взрывоопасны. Ацетилен, как и этилен, окисляется калий перманганатом 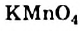
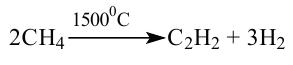
Получение: В промышленности ацетилен получают термическим разложением природного газа (метана):
Для того чтобы ацетилен не успел разложиться на простые вещества — углерод и водород, смесь продуктов реакции быстро охлаждают.
Другой способ получения ацетилена используют в лаборатории, а также для технических нужд. Он основан на реакции кальций карбида 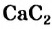
Поскольку для производства этого соединения Кальция нужно создать очень высокую температуру
ацетилен, полученный из кальций карбида, является довольно дорогим.
Рис 67. Резка металла с помощью ацетиленовой горелки
Применение: Больше всего ацетилена расходуется на производство этилового спирта, уксусной кислоты, полимеров, органических растворителей. Этот газ используют для сварки и резки металлов. Ацетилен и кислород подводят в специальную горелку, а пламя направляют на металл (рис. 67).
Физиологическое действие: Чистый ацетилен является слаботоксичным веществом. Значительно большую опасность для здоровья представляют примеси в техническом ацетилене.
Выводы:
Соотношение объемов газов в химических реакциях
Рассмотрим некоторые реакции, которые происходят с участием газов.
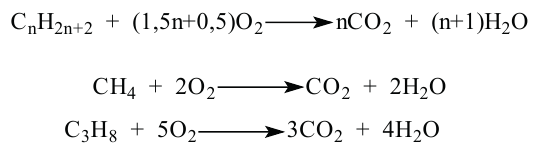
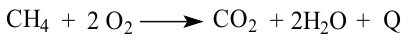
При сгорании метана
каждая его молекула взаимодействует с двумя молекулами кислорода. Из закона Авогадро следует, что определенный объем метана должен реагировать с вдвое большим объемом кислорода (например, 1 л 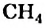
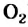
Метан при высокой температуре разлагается на ацетилен и водород
В соответствии с химическим уравнением, из каждых двух молекул метана образуется одна молекула ацетилена и три молекулы водорода. Отсюда соотношение объемов этих газов должно быть таким:
Анализируя результаты опытов с газами, французский ученый Ж. Гей-Люссак в 1808 г. сформулировал закон объемных соотношений:
объемы газов, вступающих в реакцию и образующихся в результате реакции, соотносятся как небольшие целые числа.
Впоследствии выяснилось, что эти числа являются соответствующими коэффициента ми а химических уравнениях.
Закон Гей-Люссака распространяется на все вещества, существующие в газообразном состоянии, — органические и неорганические.
Обращаем ваше внимание на реакции между газами, в которых образуется вода. Это вещество, например, является одним из продуктов горения любого углеводорода. При образовании водяного пара закон объемных соотношений газов распространяется и на него. Если же происходит конденсация пара, то объем вещества уменьшается приблизительно в тысячу раз. В этом случае закон Гей-Люссака но отношению к воде не применим (как и к другим жидким и твердым веществам).
Решение задач с использованием закона объемных соотношений
Задача:
Какой объем водорода необходим для полного превращения 0,8 л ацетилена в этан?
Дано:
Решение:
1. Составляем уравнение реакции:
2. Рассчитываем объем водорода, который вствупит в реакцию.
В соответствии с химическим уравнением и законом Гей-Люссака каждый объем ацителена реагирует с вдвое большим объемом водорода.
1 л ацетилена реагирует с 2 л водорода,
Отсюда
Ответ:
Задача:
Смешали 100 мл ацетилена и 400 мл кислорода. Смесь газов подожгли. Останется ли после реакции один из реагентов? В случае утвердительного ответа вычислить объем остатка этого вещества, считая, что температура и давление до и после реакции были одинаковыми.
Дано:
Решение:
1. Составляем уравнение реакции:
2. В соответствии с законом Гей-Люссака сооотношение реагирующих газов должно быть таким:
По условию задачи газы взяты в ином соотношении:
Отсюда следует, что кислород был в избытке, и часть его осталась после реакции.
3. Определяем, какой объем кислорода прореагирует со 100 мл ацетилена.
По закону объемных соотношений
с каждым 2 мл 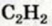
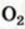
со 100 мл 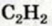
Ответ:
Задача:
Найти формулу газообразного углеводорода, если при полном сгорании 100 мл этого соединения образуется 300 мл углекислого газа и 400 мл водяного пара (объемы соответствуют одинаковым условиям).
Дано:
Решение:
1. Записываем схему химической реакции:
2. Находим соотношение объемов углеводорода, углекислого газа и водяного пара по условию задачи:
Числа 1, 3 и 4 являются соответствующими коэффициентами в химическом уравнении. Записываем их (естественно, кроме единицы) перед формулами веществ
Выводы:
Объемы газов, вступающих в реакцию и образующихся в результате реакции, соотносятся как небольшие целые числа (закон объемных соотношений газов Гей-Люссака). Эти числа являются соответствующими коэффициентами в химическом уравнении.
Справочный материал по углеводородам
Изучение органических соединений начнем с класса углеводородов, которые образуются только из атомов углерода и водорода и представлены огромным количеством веществ.
Углеводороды образованы из следующих классов:
Углеводород Общая формула
Алканы
Циклоалканы
Алкены
Алкадиены 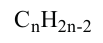
Алкины 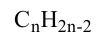
Арены
Углеводороды, в составе которых все атомы углерода соединены друг с другом посредством исключительно 
Общая формула алканов и их гомологический ряд
Соединения, входящие в один и тот же класс и схожие по свойствам, а также отличающиеся друг от друга 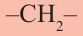
Гомологический ряд алканов:
Формула Название
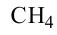
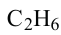
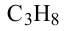
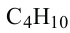
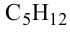
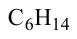
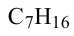
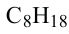
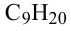
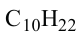
Формулы радикалов и их названия
Формула Название
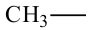
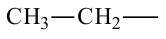
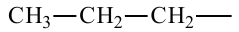
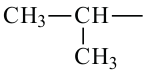
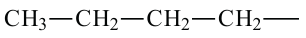
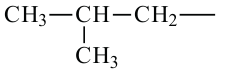
При отщеплении одного атома водорода из молекулы насыщенного углеводорода образуется соответствующий радикал. Общая формула радикалов 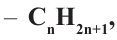
1) Тривиальная (историческая, эмпирическая, случайная)
Номенклатура
Название алканов по международной номенклатуре
Систематическая номенклатура: В 1892 году в Женеве в рамках Международного конгресса химиков была принята новая номенклатура. Согласно Женевской номенклатуре в веществах нумеруется главная цепь, перед названием радикала указывается номер атома углерода в главной цепи, с которым связан данный радикал.
Согласно систематической номенклатуре насыщенные углеводороды называются следующим образом:
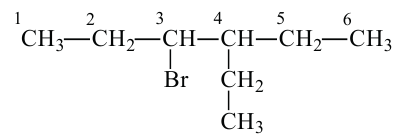
1. В молекуле углеводорода в качестве главной цепи выбирается самая длинная и разветвленная углеродная цепь.
2. Углероды данной цепи нумеруются с того конца, к которому ближе разветвление.
4. Если главная цепь имеет различные радикалы, последовательность их названия определяется начальной буквой радикала в алфавитном порядке. После указания всех заместителей в цепи, идет название основной цепи в соответствии с количеством атомов углерода в ней.
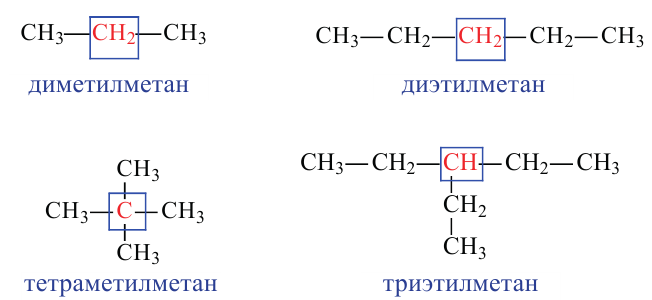
Обратите внимание на название следующих веществ по систематической номенклатуре!
В случаях, когда радикалы находятся в одинаковой отдаленности от обоих концов цепи, нумерация начинается с того ее конца, в котором число углеродов в составе радикала наименьшее:
Данное вещество образовано из 5 первичных, 1 вторичного, 1 третичного и 1 четвертичного атома углерода.
Название галогенпроизводных алканов
Согласно международной (систематической) номенклатуре, галогенпроизводные алканов называются следующим образом:
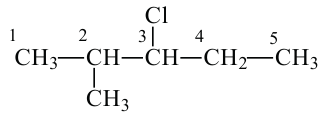
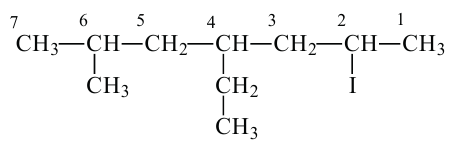
Изомерия: Вещества с одинаковой общей формулой, но отличающиеся строением (физическими и химическими свойствами) называются изомерами.
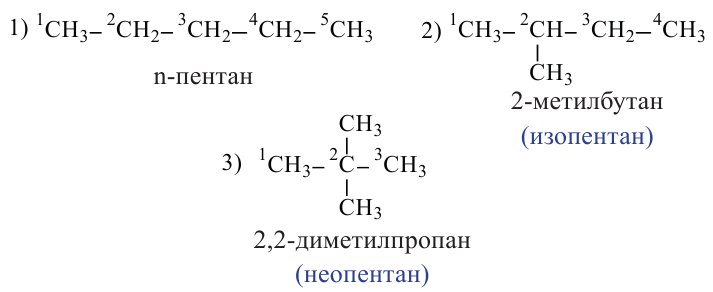
У насыщенных углеводородов изомерия начинается с бутана.
Углеводороды с неразветвленной углеродной цепью называются нормальными 
Пентан имеет 3 изомера:
Получение алканов и их физические свойства
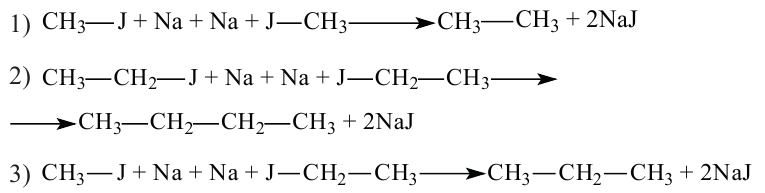
Получение: Предельные углеводороды можно получить воздействием натрия на галоидалкилы по методу Вьюрца.
В результате взаимодействия метилйодида и этилйодида с металлическим натрием можно получить 3 вида соединений: этан, бутан, пропан. Реакция протекает следующим образом:
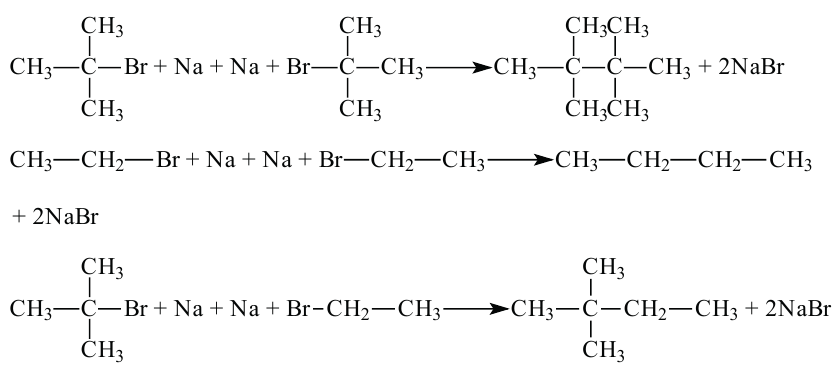
В следующем примере, как и в предыдущем, из 2-метил-2-бромпропана и этилбромида можно получить 3 вида веществ: 2,2,3,3-тетраметилбутан, бутан и 2,2-диметилбутан.
1. В результате гидролиза карбида алюминия:
2. В результате взаимодействия ацетата натрия с гидроксидом натрия.
Если вместо ацетата натрия использовать соль другой карбоновой кислоты, то образуется другой алкан. Например, из пропионата натрия образуется этан.
Химические свойства алканов
Алканы, в отличие от других углеводородов, проявляют низкую химическую активность и в обычных условиях они не вступают в реакции. В присутствии катализаторов или под действием температуры и света они вступают в реакции замещения.
Горение: Углеводороды горят при высокой температуре и образуют 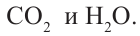
Крекинг: При высокой температуре у насыщенных углеводородов происходит разрыв углеродных цепей, в результате этого образуется смесь алканов и алкенов с меньшим числом атомов углерода. Этот процесс называется термическим крекингом.
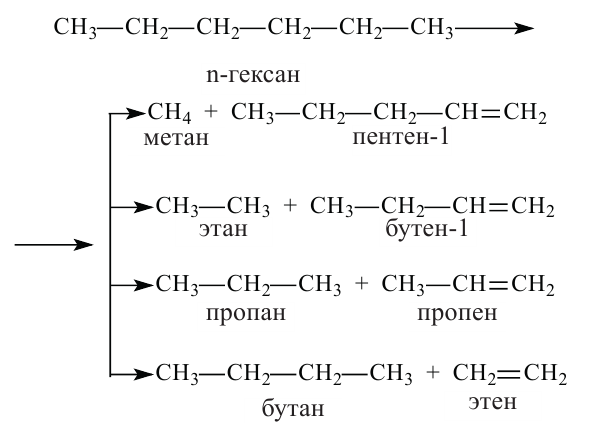
Если крекинг проводить в присутствии катализаторов, то процесс называют каталитическим крекингом. При этом образуются углеводороды с разветвленной цепью.
У разветвленных углеводородов, в основном, сначала замещаются хлором атомы водорода у третичного атома углерода, затем у вторичного и в конце у первичного углерода:
Дегидрирование: Эти реакции используют для получения из алканов соответствующих ненасыщенных углеводородов:
Циклоалканы и номенклатура циклоалканов, их изомерия и получение
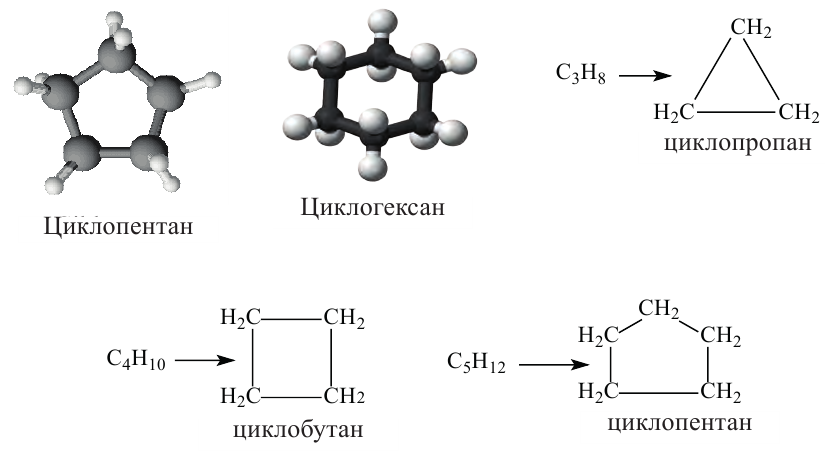
Циклоалканы отличаются от соответствующих алканов недостатком двух атомов водорода в своем составе. Именно за счет отщепления этих атомов замыкается цепь, что можно схематически изобразить следующим образом:
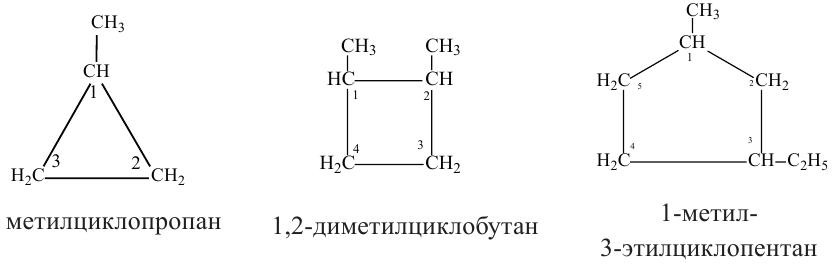
Номенклатура и изомерия: Название циклоалканов по систематической номенклатуре образуется добавлением приставки «цикло» к названию соответствующих насыщенных углеводородов.
Формула алкана Название алкана Название циклоалкана Формула циклоалкан
При названии циклоалканов по систематической номенклатуре следуют нижеприведенным правилам:
Изомерия: Явление изомерии у циклоалканов обусловлено числом атомов углерода в кольце и расположением радикалов в боковой цепи. Изомерия у циклоалканов начинается с циклобутана.
Получение: 1. В лаборатории циклоалканы получают воздействием металлов на дигалогенпроизводные насыщенных углеводородов.
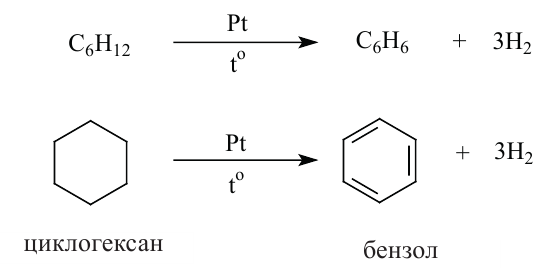
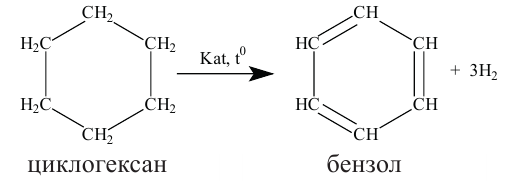
2. Гидрогенизацией бензола и его гомологов получают циклогексан и его производные.
Физические и химические свойства циклоалканов
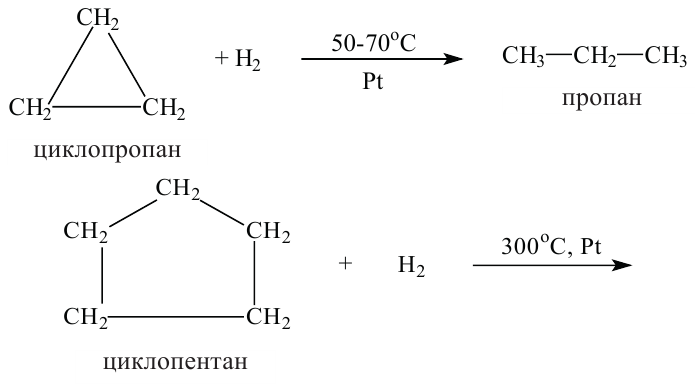
Химические свойства: У циклоалканов, как и у алканов, все связи насыщены, но в отличие от алканов они вступают в реакцию присоединения. Это объясняется разрывом связи между атомами углерода в цикле.
Представители с малыми циклами (циклопропан и циклобутан) по сравнению с соединениями с большими цикла (циклопентан и циклогексан) легче вступают в реакцию присоединения. Причиной тому является неустойчивость структуры малых циклов. Например, реакция гидрогенизации (присоединения водорода) у разных циклоалканов протекает при разной температуре:
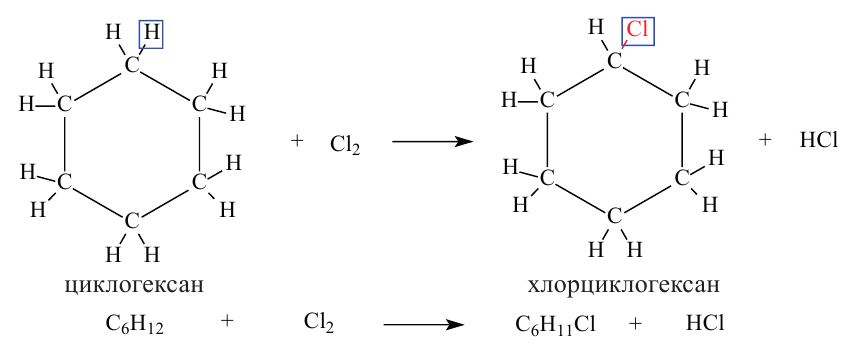
Для соединений большого цикла в основном характерны реакции замещения. Этим свойством они схожи с алканами. Например, реакция цикл ore ксана с хлором протекает следующим образом:
Н.Д. Зелинский дегидрогенизацией циклогексана получил бензол.
Алкены и их номенклатура
Углеводороды с открытой цепью, в составе которых содержится одна 
Номенклатура: Согласно систематической номенклатуре, для обозначения алкенов вместо последней буквы «ан» соответствующего алкана добавляется суффиксы «ен» или «илен».
Например:
Для обозначения алкенов, согласно систематической номенклатуре, сначала выбирается основная цепь. Двойная связь должна быть в составе основной цепи. Атомы углерода в основной цепи нумеруются с того конца, к которому ближе двойная связь. Как и у алканов, после нумерации основной цепи, радикалы в боковых цепях называются по алфавиту. В конце указывается название основной цепи и расположение двойной связи в ней.
Например:
Согласно рациональной номенклатуре, алкены рассматриваются как производные этилена, то есть за основу берут этилен.
Например:
Наименование галогенпроизводных алкенов схоже с наименованением алканов. Только с названием галогена указывается номер углерода в основной цепи, к которому присоединен атом галогена. А также указывают в алфавитном порядке углеродные радикалы в боковой цепи. Например:
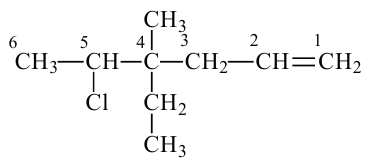
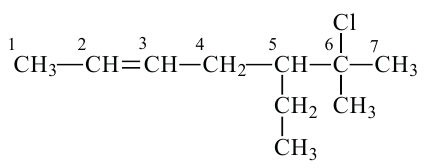
Изомерия алкенов и их получение
Изомерия: У алкенов существует 3 вида изомерии.
1. Как и у предельных углеводородов, у алкенов существует изомерия цепи. Например:
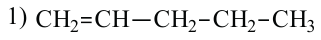
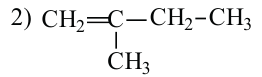
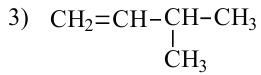
2. У алкенов встречается изомерия по положению двойной связи:
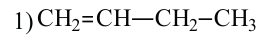
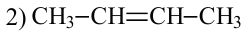
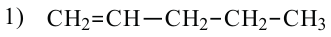
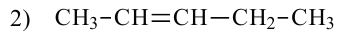
У этиленовых углеводородов возможна также пространственная изомерия.
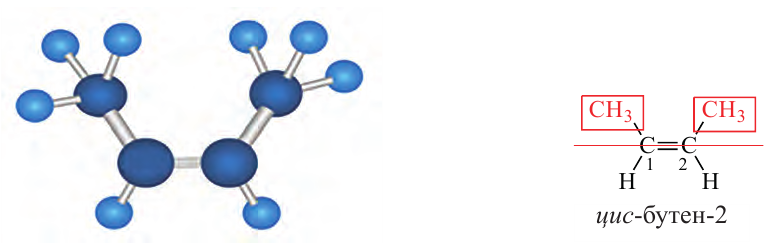
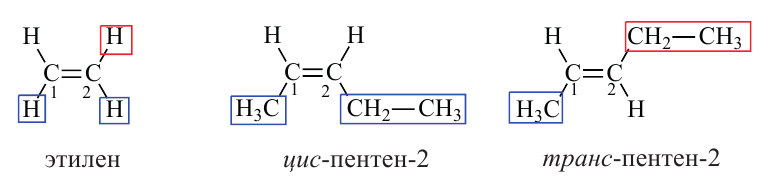
Пространственная изомерия:
Цис-бутен-2 и транс-бутен-2 отличаются по своим физическим свойствам. Поэтому они являются разными веществами.
Если рассмотреть пентен-2 как производное этилена, где у первого атома углерода есть метальный, а у второго углерода этильный заместитель, можем вывести следующие изомеры.
Таким образом, изомер в котором оба заместителя, или незамещенные водороды располагаются в одной и той же стороне, называется цис-изо-мером. Если оба водорода, или заместителя располагаются в различных сторонах, данный изомер называется транс-изомером.
Если у этилена замещены три или четыре водорода, удобнее использовать вместо цис- и транс- изомеров 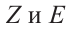
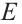
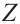
Для такого названия требуется определить самый тяжелый (по молекулярной массе) заместитель каждого углерода в этилене. Если тяжелые заместители обеих углеродов расположены в одной стороне двойной связи, изомер считается 
Методы получения:
1. В лабораторных условиях этилен получают при нагревании этилового спирта (в присутствии серной кислоты):
2.Этиленовые углеводороды можно получить при дегидрировании алканов (в присутствии катализатора, при высокой температуре):
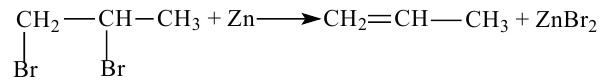
3. Этиленовые углеводороды можно получить при взаимодействии дигалогенпронзводных алканов с металлами:
4. Алкены можно получить воздействием спиртового раствора гидроксида калия на моногалогенпроизводные алканов:
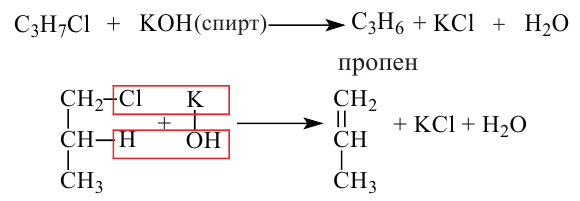
Задача с решением №1
При дегидратации неизвестного спирта было получено 5,6 г алкена и 3,6 г воды. Найдите название алкена. Решение задачи:
Напишем уравнение реакции:
Вода и алкен образуется в одинаковых количествах. Следовательно, найдём количество воды.
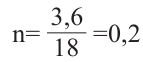
Теперь найдём молекулярную массу алкена.
Исходя из общей формулы, находим состав алкена.
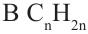
Ответ:
Химические свойства: Химические свойства этилена и его гомологов в основном определяются наличием в их молекулах двойной связи. Они легко вступают в реакцию за счет разрыва двойной связи. По этому для алкенов характерны реакции присоединения.
1. Реакция гидрогенизации. Алкены при высокой температуре и в присутствии катализаторов вступают в реакцию гидрогенизации за счет разрыва двойной связи:
2. Реакция галогенирования. Также за счет разрыва двойной связи алкены вступают в реакцию галогенирования. Например, этилен обесцвечивает бромную воду. Продуктом реакции является дибромпроизводное алкана:
3. Этилен и его гомологи присоединяют также галогеноводороды:
Алкадиены. Получение и свойства алкадиенов
Углеводороды с открытой цепью, в молекулах которых содержатся две двойные связи, называются алкадиенами. Количество атомов водорода на 4 меньше, чем у соответствующих алканов, так как в составе их молекул имеются две двойные связи. Поэтому общая формула алкадиенов
В углеводородах этиленового ряда на два атома водорода меньше, чем у соответствующих алканов, потому что в молекулах алкенов содержится одна 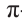
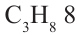
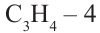
Номенклатура: Согласно систематической номенклатуре для обозначения диеновых углеводородов вместо последней буквы «н» соответствующего насыщенного углеводорода добавляется аффикс «диен», а также указываются атомы углерода с двойными связями. Для названия углеводородов диенового ряда:
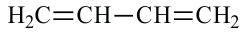
Здесь указываются цифры 1 и 3, потому что двойные связи следуют за 1 и 3 атомами углерода. Теперь обратим внимание на название следующей молекулы.
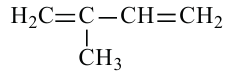
В данном случае нумерация начинается с того конца, к которому ближе разветвление основной цепи, потому как двойные связи одинаково расположены на обоих концах молекулы.
Изомерия: Для алкадиенов характерна изомерия углеродной цепи и изомерия по положению двойных связей.
Получение:
1. С. В. Лебедев синтезировал бутадиен-1,3 из этилового спирта в присутствии катализатора:
2. Путем дегидрирования бутана при высокой температуре и в присутствии катализатора получают бутадиен-1,3:
Физические свойства:
Химические свойства:
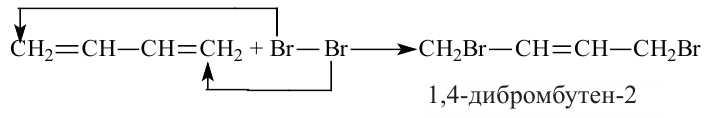
Алкадиены, как и алкены, вступают в реакцию присоединения. При воздействии бромом на бутадиен-1,3 происходит присоединение по положению 1,2 или 1,4.
присоединение по положению 1,4
присоединение по положению 1,2
При наличии достаточного количества брома образуется 1,2,3,4-тетрабромбутан:
Общую формулу реакции горения алкадиенов можно выразить следующим образом:
Алкины. Получение и свойства алкинов
Непредельные углеводороды, в молекулах которых содержится одна тройная связь, называются алкинами. Алкинов также называют углеводородами ацетиленового ряда. Общая формула алкинов 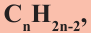
Номенклатура: Согласно рациональной номенклатуре названия углеводородов ацетиленового ряда производится добавлением слова ацетилен к названию радикала.
Согласно систематической номенклатуре названия алкинов образуются путём замены суффикса -ан у алканов на суффикс -ин.
Эмпирическая Структурная Рациональная Международная
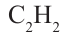
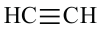
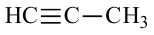
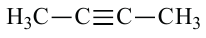
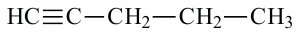
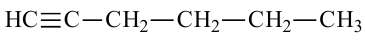
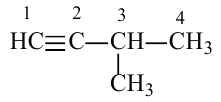
Изомерия: У углеводородов ацетиленового ряда наблюдается изомерия, связанная с разветвлением цепи и расположением тройной связи. Например, можем написать два алкина с общей формулой
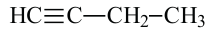
Так как общая формула алкинов и алкадиенов одинакова, то есть 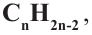
Получение:
1. В промышленности и в лаборатории ацетилен получают гидролизом карбида кальция.
2. Ацетилен также можно получить при пиролизе метана:
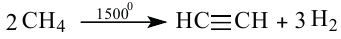
Химические свойства:
1. Реакция гидратации. М.Г. Кучеров, воздействуя на ацетилен водой в присутствии катализаторов, получил уксусный альдегид.
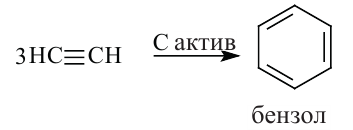
2. Н.Д. Зелинский получил бензол, пропустив ацетилен через нагретый активированный уголь.
3. Алканы, как и все углеводороды, горят. Продуктами горения являются углекислый газ и вода.
Применение: Ацетилен широко используется в качестве первичного сырья в органическом синтезе. При горении ацетилена в кислороде температура достигает до 3000°С. Это используют для резки и сварки металлов.
Задача с решением №2
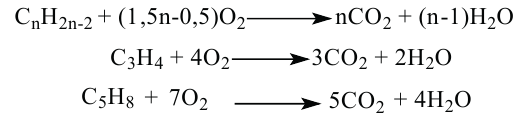
Для горения 10 л неизвестного алкина израсходовали 70 л кислорода. Определите неизвестный алкин и все его изомеры.
Известно, что общая реакция горения алкинов следующая:
Значит, для горения одного объёма алкина расходуют 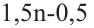
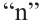
для горения 1 л алкина———израсходовано 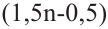
для горения 10 л———израсходовано 70 л
Значит, в составе алкина имеется 5 атомов углерода, т.е. это пентин. Общее количество изомеров у пентина 3.
Ответ: пентин, 3 изомера.
Ароматические углеводороды. Получение и свойства
Первым представителем гомологического ряда ароматических углеводородов является бензол 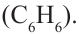
Современные физические методы исследования доказали, что бензол имеет циклическое строение и все углероды располагаются в одной поверхности.
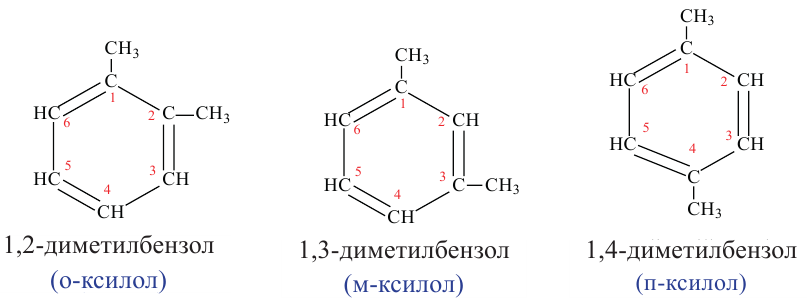
Номенклатура и изомерия: Если заменить один или несколько водородов в бензольном кольце на углеводородные радикалы, то получатся гомологи бензола.
Если в молекуле бензола атомы водорода замещены несколькими радикалами, то образуются орто-, мета- и пара-производные бензола. Для наименования таких веществ атомы углерода в структурных формулах нумеруют, а обозначения орто-, мета- и пара- пишут сокращенно.
Если отщепить один атом водорода из молекулы бензола, то образуется фенильный 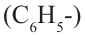
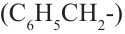
Получение:
1. Бензол можно получить при дегидрогенизации циклогексана в присутствии катализатора и при высокой температуре.
Таким же способом можно получить гомологи бензола.
2. Тримеризацией ацетилена получают бензол.
Химические свойства: Бензольное ядро довольно устойчивое и в нормальных условиях не реагирует с большинством других веществ. Однако, если создать нужные условия, бензол может вступать в реакции замещения.
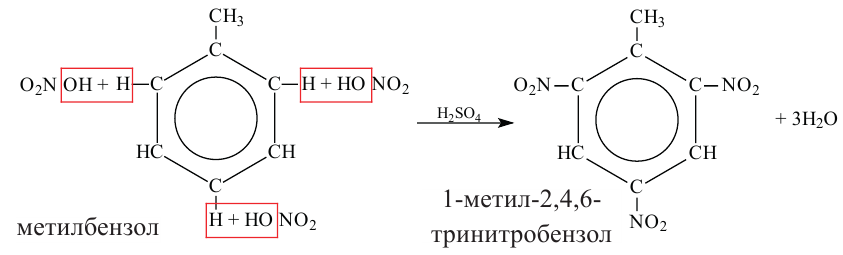
1. В присутствии катализатора 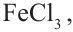
2. Если подействовать на бензол азотной кислотой в присутствии концентированной серной кислоты, то образуется нитробензол. (Реакция протекает при нагревании)
Гомологи бензола вступают в такую реакцию легче, чем бензол:
В бензольном кольце электронная плотность распределена равномерно. Но когда к бензолу присоединяются алкильные радикалы, они смещают электронную плотность в сторону бензольного кольца. В результате в положениях 2,4,6 электронная плотность увеличивается, и атомы водорода становятся подвижными и легко подвергаются замещению.
Реакции окисления:
Бензол довольно устойчив к реакциям окисления. Но его гомологи, в отличие от него, легко окисляются. При участии сильных окислителей, как 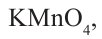
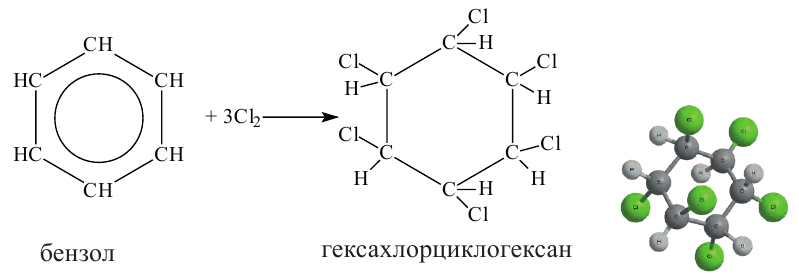
Реакции присоединения:
При воздействии солнечных лучей, бензол вступает в реакции присоединения с молекулами хлора.
При гидрировании бензол образует циклогексан.
Гибридизация атома углерода в органических соединениях
Теорию гибридизации предложил Л.Полинг в 1931 году.
В органических соединениях атомы углерода гибридизуются по трем типам: это 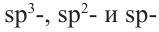
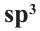
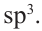
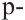
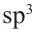
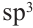
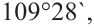
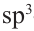
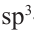
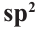
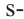
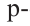
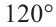
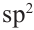
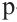
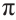
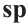
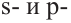
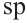
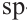
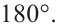
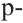
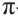
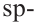
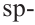
Природные источники углеводородов. Нефть и продукты ее переработки
Важными природными источниками углеводородов являются нефть, природный газ, попутные нефтяные газы и каменный уголь.
Нефть состоит из газообразных, жидких и твердых углеводородов. Газообразные углеводороды выходят из скважин как газ или попутные газы. Если основу нефти составляют жидкие углеводороды, нефть называется парафинового основания. Если нефть богата твердыми углеводородами, она считается асфальтового основания.
Некоторые учёные предполагают, что нефть образовалась из-за воздействия воды на карбиды (углеродные соединения металлов), а другие считают нефть продуктом разложения растений и организмов, которые остались под землей.
Плотность нефти меньше, чем плотность воды. Нефть практически не растворяется в воде. У нее нет постоянной температуры кипения, так как нефть представляет собой смесь различных углеводородов.
В промышленности из нефти получают ракетное топливо, топливо для дизельных двигателей и для двигателей внутреннего сгорания, смазочные масла, парафинное масло, т.е. вазелин и другие продукты.
Для отделения составных частей нефти пользуются различными методами. Самым важным методом является фракционная перегонка нефти. Во фракционной перегонке составные части нефти поэтапно отделяются в зависимости от своей температуры кипения. Во время перегонки первыми отделяются газообразные углеводороды. Различают три основные фракции в процессе перегонки нефти:
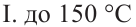
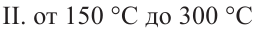
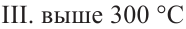
Каждая фракция подвергается повторной перегонке и разделяется на более мелкие фракции. Основные из них приведены ниже.
I. Газолиновая фракция, или фракция бензинов. Данная фракция состоит из углеводородов, в составе которых содержится от 5 до 9 углеродов. Из неё получают следующие продукты:
2. Фракция среднего бензина в зависимости от области применения подразделяется на авиационый, автомобильный бензин и др. В технике продукты данной фракции служат как топливо двигателей внутреннего сгорания.
3. Тяжелый бензин или лигроин. Продукты этой фракции служат топливом для дизельных двигателей.
II. Керосинная фракция. Данная фракция состоит из углеводородов, которые содержат от 9 до 16 атомов углерода. Керосиновая фракция после хорошей очистки применяется как тракторное топливо и горючее для хозяйственных нужд.
III. Фракция мазута. Данная фракция содержит углеводороды, в составе которых содержится от 16 атомов углерода и выше. Чтобы мазут в процессе перегонки можно было разделять на фракции, его, очевидно, необходимо нагреть не до 
После полной перегонки мазутной фракции во фракционной печи остаётся гудрон. Из него изготавливается асфальт.
При прямой перегонке нефти образуется бензин, но при этом выход реакции будет небольшим. Для повышения количества получаемого бензина из нефти, более тяжелые фракции подвергаются к крекингу и получается дополнительный бензин:
Крекинг нефти повышает количество получаемого бензина. Само слово „крекинг» взято от английского и означает — разложение. При протекании крекинга, углеводороды с большой молекулярной массой расщепляются на более мелкие углеводороды. Но помимо расщепления протекают и другие побочные процессы такие как дегидрогенизация, циклизация, изомеризация, полимеризация.
Нефть подвергается к крекингу двумя способами: термический и каталитический крекинг. Термический крекинг проводится при высокой температуре и давлении. При этом высокомолекулярные углеводороды расщепляются на низкомолекулярные и ненасыщенные углеводороды. Такие углеводороды 
Природные источники углеводородов. Природный газ и каменный уголь
Попутные газы, которые выделяются во время добывания нефти, также считаются частью природного газа. Попутные газы содержат меньше метана, но в их составе содержание этана, пропана и бутана выше, чем у обычного природного газа. Побочные газы как сульфид водорода, азот, инертные газы, углекислый газ и вода не исключение для попутных газов, и входят в их состав.
Попутные газы располагаются выше, чем нефтяные залежи, или из-за высокого подземного давления могут растворяться в самой нефти.
Характеристика попутных нефтяных газов:
Природный газ известен тем, что считается оптимальным горючим, так как горит полностью и образует большое количество теплоты.
В настоящее время природный газ становится начальным сырьём для синтеза различных органических соединений. При нагревании метана, основную составную часть природного газа, до 1500° С образуются ацетилен и водород.
Разработаны множество способов переработки природного газа. Целью переработки газов является преобразование насыщенных углеводородов на ненасыщенные, т.к. именно из ненасыщенных углеводородов можно получить синтетические полимеры как каучук, пластмасса. Наряду с этим, проведение реакций окисления дает возможность получить кислоты, спирты и другие органические вещества.
Каменный уголь: Помимо применения в качестве топлива, каменный уголь применяется в большом количестве в металлургии для получения кокса. Кокс образует нужную температуру, в которой железо плавится и выделяется из железосодержащих руд.
При сухой перегонке каменного угля, которая также называется коксованием, улетучиваются легкие углеводороды и образуется рыхлая субстанция, состоящая из углерода и пепла. Когда полученная субстанция охлаждается, образуются такие газообразные продукты, как каменноугольная смола, аммиачная вода, коксовый газ.
При сухой перегонке каменного угля образуется каменноугольная смола. Эта смола состоит, в основном, из ароматических и гетероциклических соединений. Органические соединения в составе смолы выделяются на разных фракциях, которые различаются по температуре:
Аммиачная вода состоит из аммиака, хлорида аммония и углекислого газа, растворенных в воде. Она применяется для получения азотных удобрений.
Коксовый газ состоит из бензола, толуола, ксилола, фенола, аммиака, сульфида водорода и других веществ. После очистки от аммиака и сульфида водорода образуется ценная смесь углеводородов, которая состоит из бензола и других важных соединений.
Задача с решением №3
Для сжигания метана в составе природного газа потребовался кислород объемом 67,2 л (н.у.) Определите массу (г) углекислого газа, который образуется в данной реакции.
Сначала напишем реакцию горения метана.
Как видим, для сжигания одного моля метана требуется 2 моля кислорода, при этом образуется 1 моль углекислого газа. Это значит от двух молей кислорода выделяется один моль углекислого газа. Для начала определим количество кислорода из данного объема.
Если расходуются 2 моля кислорода образуется 1 моль углекислого газа. Если расходуются 3 моля кислорода, то сколько молей углекислого газа может образоваться?
В конце определим массу полученного углекислого газа.
Ответ: 66 г
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.