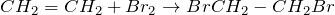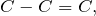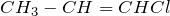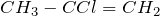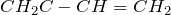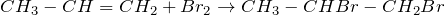Строение, изомерия и гомологический ряд алкенов
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
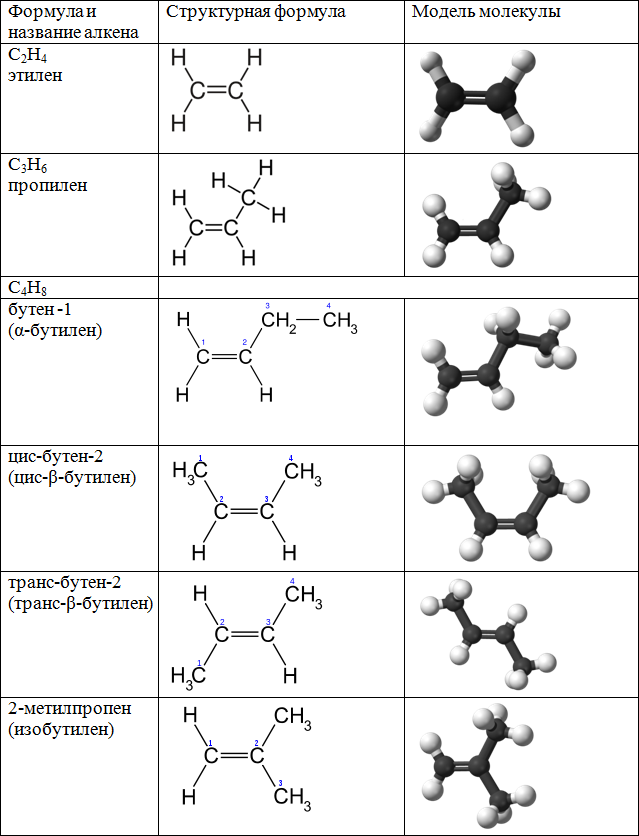
Гомологический ряд алкенов
Все алкены имеют некоторые общие или похожие физические и химические свойства. Схожие по строению алкены, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкены образуют гомологический ряд.
Самый первый представитель гомологического ряда алкенов – этен (этилен) C2H4, или СH2=СH2.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
| Название алкена | Формула алкена |
| Этилен (этен) | C2H4 |
| Пропилен (пропен) | C3H6 |
| Бутилен (бутен) | C4H8 |
| Пентен | C5H10 |
| Гексен | C6H12 |
| Гептен | C7H14 |
| Октен | C8H16 |
| Нонен | C9H18 |
Общая формула гомологического ряда алкенов CnH2n.
Первые четыре члена гомологического ряда алкенов – газы, начиная с C5 – жидкости.
Алкены легче воды, не растворимы в воде и не смешиваются с ней.
Строение алкенов
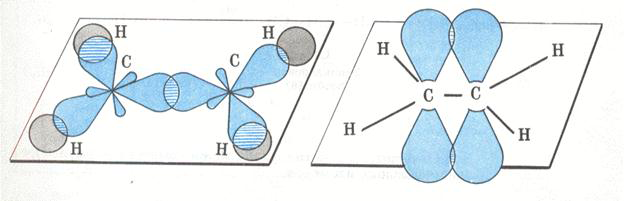
Рассмотрим особенности строения алкенов на примере этилена.
В молекуле этилена присутствуют химические связи C–H и С=С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp 2 :

При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120 о друг к другу:
Изображение с сайта orgchem.ru
Это соответствует плоско-треугольному строению молекулы.
| Например, молекуле этилена C2H4 соответствует плоское строение. |
Изображение с сайта orgchem.ru
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
Изображение с сайта orgchem.ru
Изомерия алкенов
Для алкенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Изомеры с различным углеродным скелетом и с формулой С4Н8 — бутен-1 и метилпропен |
| Бутен-1 | Метилпропен |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкены являются межклассовыми изомерами с циклоалканами. Общая формула и алкенов, и циклоалканов — CnH2n.
| Например. Межклассовые изомеры с общей формулой С3Н6 — пропилен и циклопропан |
| Пропилен | Циклопропан |
 |  |
Изомеры с различным положением двойной связи отличаются положением двойной связи в углеродном скелете.
| Например. Изомеры положения двойной связи, которые соответствуют формуле С4Н8 — бутен-1 и бутен-2 |
| Бутен-1 | Бутен-2 |
 |  |
Пространственная изомерия
Для алкенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у алкенов.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
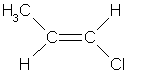
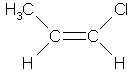
| Например. Для бутена-2 характерна цис- и транс-изомерия. В цис-изомере м етильные радикалы CH3 располагаются по одну сторону от плоскости двойной связи, в транс-изомере — по разные стороны. |
| цис-Бутен-2 | транс-Бутен-2 | ||||||||
 Цис-транс-изомерия не характерна для тех алкенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Формула алкеновОбщая формула алкенов: CnH2n (n Молекулярные и структурные формулы алкеновПервые представители гомологического ряда алкенов: Атомы углерода, участвующие в образовании двойной связи находятся в состоянии sp Длина двойной связи С=С (0,133нм) меньше длины одинарной связи (0,154 нм). Энергия двойной связи меньше удвоенного значения энергии одинарной связи, поскольку энергия Изомеры алкеновВсе алкены кроме этилена имеют изомеры. Для алкенов характерна изомерия углеродного скелета, изомерия положения двойной связи, межклассовая и пространственная изомерии. Межклассовым изомером пропена (C3H6) является циклопропан. Начиная с бутена (C4H8) появляется изомерия по положению двойной связи (бутен-1 и бутен-2), изомерия углеродного скелета (метилпропен или изобутилен), а также пространственная изомерия (цис-бутен-2 и транс-бутен-2). В цис- изомерах заместители расположены по одну сторону, а в транс- изомерах – по разные стороны от двойной связи. Химические свойства и химическая активность алкенов определяются наличием в их молекулах двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения: гидрогалогенирование, гидратация, галогенирование, гидрирование, полимеризация. Качественная реакция на двойную связь – обесцвечивание бромной воды: Примеры решения задач по теме «формула алкенов»
поскольку изомерия углеродного скелета и положения двойной связи при таком количестве атомов углерода невозможна. Структурная изомерия в данной молекуле возможна только за счет изменения положения атома хлора относительно двойной связи:
| |||||||||
| Ответ | Условию задачи удовлетворяют 4 изомера | ||||||||
| Задание | Смесь изомерных углеводородов (газов с плотностью по водороду равной 21) объемом 11,2 л (н.у.) вступила в реакцию с бромной водой. В результате было получено 40,4 г соответствующего дибромпроизводного. Какое строение имеют эти углеводороды? Определите их объемное содержание в смеси (в %). |
| Решение | Общая формула углеводородов CхHу. |
Рассчитаем молярную массу углеводородов:
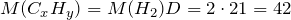
Следовательно, формула углеводородов – С3Н6. Такую формулу имеют только два вещества – пропен и циклопропан.
С бромной водой реагирует только пропен:
Рассчитаем количество вещества дибромпроизводного:
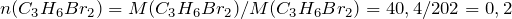
По уравнению реакции:
n(пропена) 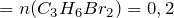
Суммарное количество углеводородов в смеси равно:
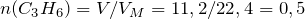
n(циклопропана) 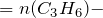
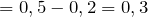
Рассчитаем объемные доли газов в смеси:
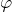
Алкены
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкенов.
Гомологический ряд алкенов
Все алкены имеют некоторые общие или похожие физические и химические свойства. Схожие по строению алкены, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкены образуют гомологический ряд.
Самый первый представитель гомологического ряда алкенов – этен (этилен) C2H4, или СH2=СH2.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
| Название алкена | Формула алкена |
| Этилен (этен) | C2H4 |
| Пропилен (пропен) | C3H6 |
| Бутилен (бутен) | C4H8 |
| Пентен | C5H10 |
| Гексен | C6H12 |
| Гептен | C7H14 |
| Октен | C8H16 |
| Нонен | C9H18 |
Общая формула гомологического ряда алкенов CnH2n.
Первые четыре члена гомологического ряда алкенов – газы, начиная с C5 – жидкости.
Алкены легче воды, не растворимы в воде и не смешиваются с ней.
Строение алкенов
Рассмотрим особенности строения алкенов на примере этилена.
В молекуле этилена присутствуют химические связи C–H и С=С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp 2 :

При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120 о друг к другу:
Изображение с сайта orgchem.ru
Это соответствует плоско-треугольному строению молекулы.
| Например, молекуле этилена C2H4 соответствует плоское строение. |
Изображение с сайта orgchem.ru
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
Изображение с сайта orgchem.ru
Изомерия алкенов
Для алкенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Изомеры с различным углеродным скелетом и с формулой С4Н8 — бутен-1 и метилпропен |
| Бутен-1 | Метилпропен |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкены являются межклассовыми изомерами с циклоалканами. Общая формула и алкенов, и циклоалканов — CnH2n.
| Например. Межклассовые изомеры с общей формулой С3Н6 — пропилен и циклопропан |
| Пропилен | Циклопропан |
 |  |
Изомеры с различным положением двойной связи отличаются положением двойной связи в углеродном скелете.
| Например. Изомеры положения двойной связи, которые соответствуют формуле С4Н8 — бутен-1 и бутен-2 |
| Бутен-1 | Бутен-2 |
 |  |
Пространственная изомерия
Для алкенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у алкенов.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
| Например. Для бутена-2 характерна цис- и транс-изомерия. В цис-изомере м етильные радикалы CH3 располагаются по одну сторону от плоскости двойной связи, в транс-изомере — по разные стороны. |
| цис-Бутен-2 | транс-Бутен-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Цис-транс-изомерия не характерна для тех алкенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Номенклатура алкенов
При этом правила составления названий (номенклатура) для алкенов в целом такие же, как и для алканов, но дополняются некоторыми пунктами: 1. Углеродная цепь, в составе которой есть двойная связь, считается главной. 2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода при двойной связи получили наименьший номер. Нумерацию следует начинать с более близкого к двойной связи конца цепи. 3. В конце молекулы вместо суффикса АН добавляют суффикс ЕН и указывают наименьший номер атома углерода при двойной связи в углеродной цепи. 4. Для простейших алкенов применяются также исторически сложившиеся (тривиальные) названия:
Радикалы, содержащие двойную связь, также носят тривиальные названия:
Химические свойства алкеновАлкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов. Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
Можно примерно оценить энергию π-связи в составе двойной связи С=С: Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам. Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение). 1. Реакции присоединенияДля алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена. 1.1. ГидрированиеАлкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
1.2. Галогенирование алкеновПрисоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму. 1.3. Гидрогалогенирование алкеновАлкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
1.4. ГидратацияГидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Гидратация алкенов также протекает по ионному (электрофильному) механизму. Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
1.5. ПолимеризацияПолимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера). nM → Mn (M – это молекула мономера)
2. Окисление алкеновРеакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода). В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое. 2.1. Каталитическое окислениеКаталитическое окисление протекает под действием катализатора.
2.2. Мягкое окислениеМягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается. В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи. При этом образуются двухатомные спирты (диолы).
2.2. Жесткое окислениеПри жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом. Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2. Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота: При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон: При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления. 2.3. Горение алкеновАлкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды. В общем виде уравнение сгорания алкенов выглядит так:
3. Замещение в боковой цепиАлкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы. При взаимодействии алкенов с хлором или бромом при нагревании до 500 о С или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
4. Изомеризация алкеновПри нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Получение алкенов1. Дегидрирование алкановПри дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, образуются двойные и тройные связи.
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
2. Крекинг алкановКрекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью. Крекинг бывает термический и каталитический. Термический крекинг протекает при сильном нагревании без доступа воздуха. При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия). 3. Дегидрогалогенирование галогеналкановГалогеналканы взаимодействуют с щелочами в спиртовом растворе. При этом происходит дегидрогалогенирование – отщепление (элиминирование) атомов водорода и галогена от галогеналкана.
При отщеплении галогена и водорода от некоторых галогеналканов могут образоваться различные органические продукты. В таком случае выполняется правило Зайцева.
4. Дегидратация спиртовПри нагревании спиртов (выше 140 о С) в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота) или катализаторов (оксид алюминия) протекает дегидратация. Дегидратация — это отщепление молекул воды. При дегидратации спиртов образуются алкены.
Дегидратация более сложных молекул также протекает по правилу Зайцева.
5. Дегалогенирование дигалогеналкановДигалогеналканы, в молекулах которых два атома галогена расположены у соседних атомов углерода, реагируют с активными металлами с образованием алкенов. Как правило, для отщепления используют двухвалентные активные металлы — цинк или магний.
6. Гидрирование алкиновГидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов. При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
7. Гидрирование алкадиеновГидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением. При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2): Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
При полном гидрировании дивинила образуется бутан: Теперь вы знаете какие однокоренные слова подходят к слову Как написать структурную формулу алкенов, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову "Как написать структурную формулу алкенов", предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||






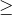 2)
2)
 -гибридизации. Три
-гибридизации. Три  -связи, образованные гибридными орбиталям и, расположены в одной плоскости под углом 120° друг к другу. Дополнительная
-связи, образованные гибридными орбиталям и, расположены в одной плоскости под углом 120° друг к другу. Дополнительная  -связь образуется путем бокового перекрывания негибридных р-орбиталей:
-связь образуется путем бокового перекрывания негибридных р-орбиталей: