Формула оксидов.
Классификация оксидов.
По классификации оксидов, солеобразующими оксидами являются те оксиды, которые могут взаимодействовать с кислотами либо основаниями с возможностью появления соответствующей соли и воды. Солеобразующими оксидами называют:
Основные оксиды, зачастую образующиеся из металлов со степенью окисления +1, +2. Могут реагировать с кислотами, с кислотными оксидами, с амфотерными оксидами, с водой (только оксиды щелочных и щелочно-земельных металлов). Элемент основного оксида становится катионом в образующейся соли. Na2O, CaO, MgO, CuO.
Примечание: металл менее активный, чем алюминий.
Амфотерные оксиды, образуют металлы со степенью окисления от +3 до +5 (к амфотерным оксидам относятся также BeO, ZnO, PbO, SnO). Реагируют с кислотами, щелочами, кислотными и основными оксидами.
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства: ZnO + 2HCl → ZnCl2 + H2O
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
Несолеобразующие оксиды не вступают в реакцию ни с кислотами, ни с основаниями, а значит, солей не образуют. N2O, NO, CO, SiO.
В соответствии с номенклатурой ИЮПАК, названия оксидов складываются из слова оксид и названия второго химического элемента (с меньшей электроотрицательностью) в родительном падеже:
Если элемент может образовывать несколько оксидов, то в их названиях следует указать степень окисления элемента:
Можно использовать латинские приставки для обозначения числа атомов элементов, которые входят в молекулу оксида:
Часто используются также тривиальные названия некоторых оксидов:
Как написать формулу оксидов для соответствующим им гидроксидов?
Оксиды – соединения атомов двух элементов, один из которых кислород в степени окисления –2.
В оксидах атомы кислорода связаны только с атомами другого элемента и не связаны друг с другом. Соединения, содержащие в своем составе непосредственно связанные друг с другом атомы кислорода (–О–О–), называют пероксидами.
Fe3O4 FeO•Fe2O3, Mn3O4 MnO•Mn2O3, Pb2O3 PbO•PbO2.
По химическим свойствам оксиды делятся на солеобразующие (образуют соли при взаимодействии с кислотами и/или щелочами) и несолеобразующие (не образуют солей, безразличны к кислотам и щелочам; к ним относятся СO, NO, N2O, SiO, S2O).
Некоторые оксиды с водой не взаимодействуют, их гидроксиды можно получить косвенным путем.
Оксид и гидроксид соответствуют друг другу, если содержат один и тот же элемент с одной и той же степенью окисления атома.
Солеобразующие оксиды разделяют на основные, кислотные и амфотерные в зависимости от типа соответствующего гидроксида. Kислотно-основные свойства родственных оксидов и гидроксидов (Na2O и NaOH, SO3 и H2SO4) cовпадают.
Основными называют оксиды, которым соответствуют гидроксиды – основания.
Kислотными называют оксиды, которым соответствуют гидроксиды – кислоты.
Амфотерными называют оксиды, которым соответствуют амфотерные гидроксиды.
Неметаллы образуют только кислотные и несолеобразующие оксиды; металлы образуют все основные, все амфотерные и некоторые кислотные оксиды. Многие металлы побочных подгрупп, имеющие в соединениях переменную с. о. атомов, могут образовывать несколько оксидов и гидроксидов, характер которых зависит от с. о. атома элемента. С ростом степени окисления атома элемента его электроотрицательность растет. Соответственно растут неметаллические свойства элемента, а также кислотные свойства его оксида и гидроксида.
Как написать формулы оксидов соответствующих гидроксидам
Порядок составления формул оксидов
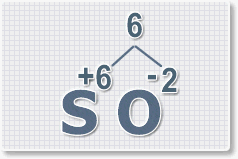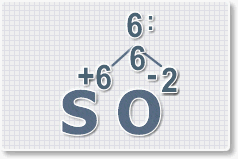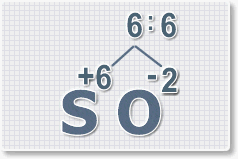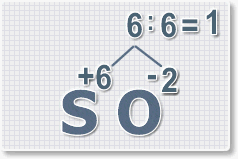
Формулы оксидов можно составлять по правилу креста:
Таблица.1 Степени окисления некоторых элементов
С неметаллами кислород образует оксид, если только этот неметалл менее электроотрицательный, чем сам кислород см. таблицу электроотрицательности.
Составим формулу оксида натрия :
Правило наименьшего общего кратного это способ наиболее универсальный для составления формул. Как им пользоваться рассмотрим на примере.
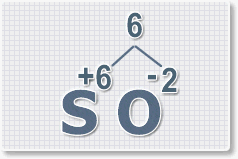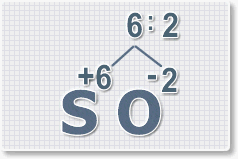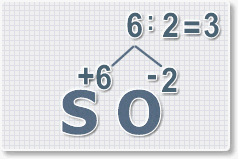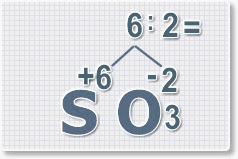
6 : 2 = 3 это индекс для кислорода
В результате получим формулу оксида серы (VI):
Как написать формулы оксидов, соответствующих гидроксидам
Гидроксиды – это сложные вещества, к которым относятся кислоты и основания. Название состоит из двух частей – «гидро» (вода) и оксид. Если оксид кислотный, в результате его взаимодействия с водой получится гидроксид – кислота. Если же оксид основный (не основной, как иногда ошибочно называют), то и гидроксид будет представлять собой основание.
H2SO4, серная кислота. Отнимите 2 атома водорода и 1 атом кислорода – получитеSO3 или оксид серы (VI).
H2SO3, сернистая кислота. По аналогии с предыдущим примером получается SO2 или оксид серы (IV).
H2CO3, угольная кислота. Образуется CO2 или оксид углерода (IV).
H2SiO3, кремниевая кислота. Следовательно, получится SiO2 или оксид кремния.
Ca(OH)2, гидроксид кальция. Вычтите молекулу воды и останется CaO или оксид кальция.
В некоторых формулах гидроксидов имеется нечетное количество атомов водорода, а потому требуется удвоение. Кроме этого, удвоению подвергаются и остальные элементы, входящие в состав гидроксида, после чего, по аналогии, вычитаются все образовавшиеся молекулы воды.
NaOH, гидроксид натрия. Удвойте количество атомов каждого элемента и получите Na2O2H2. Вычтите молекулу водыи останется Na2O или оксид натрия.
Al(OH)3, гидроксид алюминия. Удвойте количество атомов – Al2O6H6. Вычтите три образовавшиеся молекулы воды и получится Al2O3, оксид алюминия.
Как написать формулы оксидов, соответствующих гидроксидам
Гидроксиды – это трудные вещества, к которым относятся кислоты и основания. Наименование состоит из 2-х частей – «гидро» (вода) и оксид. Если оксид кислотный, в итоге его взаимодействия с водой получится гидроксид – кислота. Если же оксид основный (не стержневой, как изредка ложно называют), то и гидроксид будет представлять собой основание.
Инструкция
1. Для того дабы верно писать формулы, которые соответствуют гидроксидам – кислотам и основаниям, нужно иметь представление об оксидах. Оксиды – это трудные вещества, состоящие из 2-х элементов, одним из которых является кислород. Гидроксиды в своем составе имеют еще и атомы водорода. Формулы оксидов дюже легко написать, применяя упрощенную схему. Для этого довольно от соответствующего гидроксида «вычесть» все молекулы воды, которые входят в состав гидроксида. Если комбинированный частью кислоты либо основания является одна молекула воды, то необходимо уменьшить число атомов водорода на 2, а атомов кислорода на 1. Если же в состав гидроксида входят две молекулы воды, то и число атомов водорода и кислорода необходимо будет уменьшить на 4 и 2 соответственно.
2. H2SO4, серная кислота. Отнимите 2 атома водорода и 1 атом кислорода – получите SO3 либо оксид серы (VI).H2SO3, сернистая кислота. По аналогии с предыдущим примером получается SO2 либо оксид серы (IV).H2CO3, угольная кислота. Образуется CO2 либо оксид углерода (IV).H2SiO3, кремниевая кислота. Следственно, получится SiO2 либо оксид кремния.Ca(OH)2, гидроксид кальция. Вычтите молекулу воды и останется CaO либо оксид кальция.
3. В некоторых формулах гидроксидов имеется нечетное число атомов водорода, а потому требуется удвоение. Помимо этого, удвоению подвергаются и остальные элементы, входящие в состав гидроксида, позже чего, по аналогии, вычитаются все образовавшиеся молекулы воды.NaOH, гидроксид натрия. Удвойте число атомов всякого элемента и получите Na2O2H2. Вычтите молекулу воды и останется Na2O либо оксид натрия.Al(OH)3, гидроксид алюминия. Удвойте число атомов – Al2O6H6. Вычтите три образовавшиеся молекулы воды и получится Al2O3, оксид алюминия.
4. HNO3, азотная кислота. Удвойте число всякого элемента – получите H2N2O6. Вычтите из нее одну молекулу воды и получится N2O5 – оксид азота (V).HNO2, азотистая кислота. Произведите удвоение числа всего элемента – получите H2N2O4. Вычтите из нее одну молекулу воды и получится N2O3 – оксид азота (III).H3PO4, ортофосфорная кислота. Удвойте число всего элемента – получите H6P2O8. Вычтите из нее три молекулы воды и получится P2O5 – оксид фосфора (V). HMnO4, марганцовая кислота. Исполните удвоение числа атомов и получите H2Mn2O8. Вычтите молекулу воды (2 атома водорода и 1 атом кислорода), в итоге будет Mn2O7 – оксид марганца (VII).
Совет 2: Как получить оксид кальция
Оксид кальция – это обыкновенная негашеная известь. Но, невзирая на столь нехитрую природу, это вещество крайне обширно применяется в хозяйственной деятельности. От строительства, в качестве основы для известкового цемента, до кулинарии, в качестве пищевой добавки E-529, оксид кальция находит использование. И в индустриальных и в домашних условиях дозволено получить оксид кальция из карбоната кальция реакцией термического разложения.
Вам понадобится
Инструкция
5. Дождитесь полного прохождения реакции термического распада. В ходе реакции верхние слои вещества в тигле могут дрянно прогреваться. Их дозволено несколько раз перемешать железный лопаткой.
Видео по теме
Обратите внимание!
Будьте осмотрительны при работе с газовой горелкой и нагретым тиглем. При прохождении реакции тигель будет нагрет до температуры выше 1200 градусов Цельсия.
Полезный совет
Взамен попыток собственноручного производства крупных чисел оксида кальция (скажем, для дальнейшего приобретения известкового цемента), класснее приобрести готовый продукт на специализированных торговых площадках.
Совет 3: Как получить гидроксид алюминия
Гидроксиды алюминия могут существовать в разных кристаллических формах — бимита, байерита, гидраргиллита, диаспора и некоторых других. Все они отличаются друг от друг расположением ионов алюминия и кислорода, разны и методы их приобретения.

Гидроксиды алюминия в виде тонкого порошкаСуществует способ приобретения гидроксидов алюминия в виде тонкого порошка. Прекурсор алюминия перемешивают с веществом, которое используется в качестве затравочного материала для образования кристаллов гидроксида. После этого смесь прокаливают в атмосфере, содержащей хлористый водород. Данный метод неудобен из-за необходимости фильтрации, при этом для приобретения мелкодисперсного порошка необходимо проводить размол и экструдирование. Приобретение гидроксида из металлического алюминияУдобнее получать гидроксиды при взаимодействии металлического алюминия с водой, впрочем реакция замедляется из-за образования оксидной пленки на поверхности металла. Для того дабы этого избежать, применяют разные добавки. Для активизации процесса взаимодействия алюминия, а также его соединений с водородом использую установку, которая включает в себя реактор, мешалку, сепаратор, теплообменник и фильтр для распределения суспензии. Для образования гидроксидов нужно добавлять вещества, которые содействуют взаимодействию реагентов, скажем, органические амины в каталитических числах. При этом нет вероятности получить чистый гидроксид.Приобретение в форме бемитаИногда гидроксид алюминия получают в форме бемита. Для этого применяют установку с реактором и мешалкой, в которой есть отверстие для ввода порошкообразного алюминия и воды, также нужен отстойник и конденсатор для приема парогаза. Реакцию проводят в автоклаве, в нее заблаговременно загружают воду и мелкодисперсные частицы алюминия, позже чего смесь нагревают до 250-370оС. После этого при той же температуре смесь начинают перемешивать под давлением, довольным для того, дабы вода оставалась в жидкой фазе. Перемешивание прекращают, когда каждый алюминий вступил в реакцию, автоклав охлаждают, позже этого отделяют полученный гидроксид алюминия. Улучшенный процессДля приобретения гидроксида алюминия высокой чистоты берут крепкий, а не порошкообразный алюминий, скажем, в виде слитков. Их кладут в нагретую до 70оС воду, перемешивают в течение 20 минут, после этого вводят твердое вещество, образующее щелочь. В качестве такого вещества дозволено применять гидроксид натрия. Смесь нагревают до температуры кипения, позже чего ее понижают до 75-80оС и продолжают все перемешивать в течение часа. Температуру снижают до комнатной, а смесь фильтруют, получая гидроксид алюминия высокой чистоты.