Данная страница не существует!
Если эта ошибка будет повторяться, обратитесь, пожалуйста, в службу поддержки.
Разные разности
…на Луне найдены холодные ловушки углекислого газа, сосредоточенные вокруг южного полюса Луны…
…«пиксели» слоя черного фосфора толщиной в три атома могут быть в 20 раз меньше, чем у жидкокристаллических дисплеев, но при этом будут реагировать на входные данные в миллион раз быстрее…
…в анализах проб из Японского моря был найден и описан новый вид голожаберных моллюсков Eubranchusmalakhovi sp.n., который назвали в честь заведующего кафедрой зоологии беспозвоночных МГУ, академика РАН В.В. Малахова …
Международная группа зоологов решила обучить телят гигиене. Для этого они вознаграждали каждого теленка после посещения туалета, и те вскоре привыкли справлять нужду в отведенном для этого месте.
Профессор Тодд Шмидт из Корнеллского университета задумал совмещение интересов энергетиков и аграриев : предложил запустить на солнечные поля овец.
…возможно создание легкой и гибкой голографической линзы диаметром более десяти метров, которую можно свернуть для запуска и развернуть в космосе; она преобразует видимый и инфракрасный свет звезд либо в изображение, либо в спектр…
…стандартный медный наконечник зонда атомного силового микроскопа разорвал связь железо—углерод с силой притяжения 150 пиконьютонов…
…сильные землетрясения помогают деревьям расти, загоняя дополнительную воду в почву, окружающую их корни; эти мимолетные всплески роста оставляют следы в клетках древесины, которые также могут быть использованы для датировки древних землетрясений…
Как пишется йод в химии прописью
(молярная масса)
(первый электрон)
Содержание
Название и обозначение
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰο-ειδής (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом, например, «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
В современной химической номенклатуре используется наименование йод. Такое же положение существует в некоторых других языках, например, в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента J был заменен на I.
История
Йод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
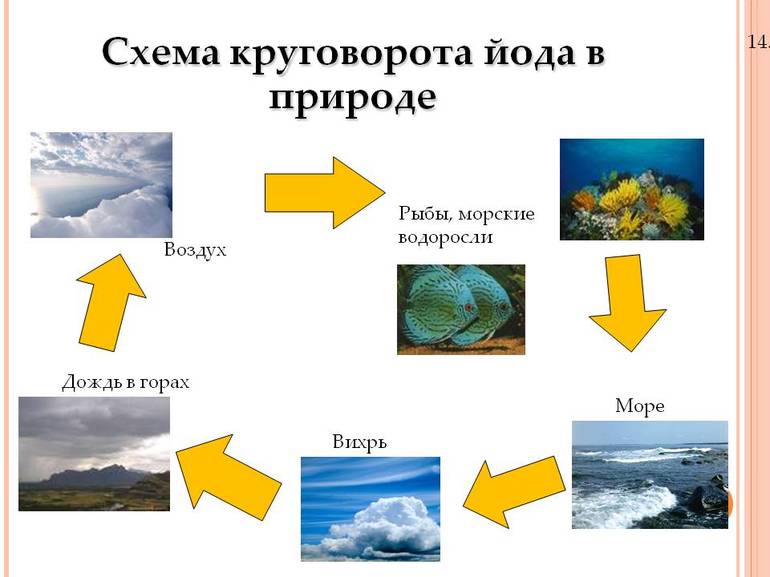
Нахождение в природе
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство йода из такого сырья.
Физические свойства
Йод при обычных условиях — твёрдое вещество, чёрно-серые или тёмно-фиолетовые кристаллы со слабым металлическим блеском и специфическим запахом.
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например, в бензоле — в отличие от бурого раствора в полярном этиловом спирте. Слабо растворяется в воде ( 0,28 г/л ), лучше растворяется в водных растворах йодидов щелочных металлов с образованием трийодидов (например трийодида калия KI3).
При нагревании при атмосферном давлении йод сублимирует (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении при атмосферном давлении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей.
Жидкий йод можно получить, нагревая его под давлением.
Изотопы
Известны 37 изотопов йода с массовыми числами от 108 до 144. Из них только 127 I является стабильным, период полураспада остальных изотопов йода составляет от 103 мкс до 1,57⋅10 7 лет; отдельные изотопы используются в терапевтических и диагностических целях.
Химические свойства
Йод относится к группе галогенов.
Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4).
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром.
Последняя реакция также используется в аналитической химии для определения йода.
Нитрид трийода в сухом кристаллическом состоянии разлагается с выделением фиолетовых паров йода, что демонстрируется как эффектная химическая реакция.
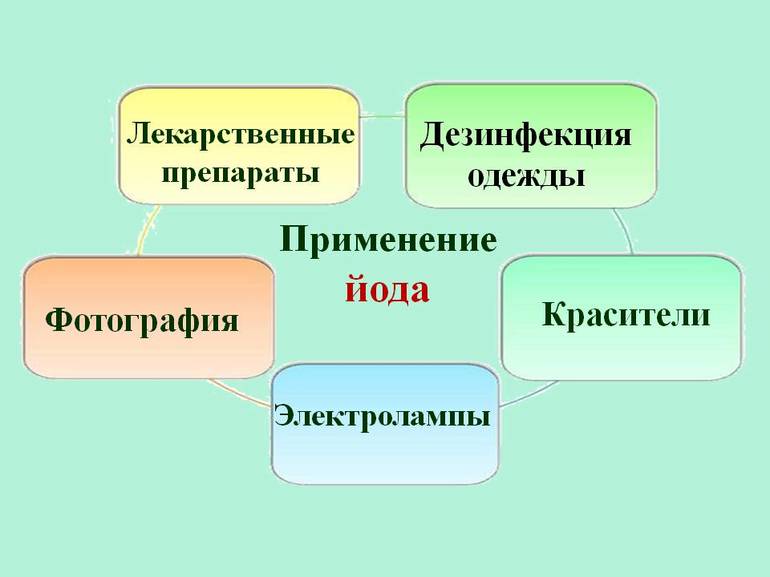
Применение
В медицине
5-процентный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. Продукты присоединения йода к крахмалу, другим ВМС (т. н. «Синий йод» — Йодинол, Йокс, Бетадин и др.) являются более мягкими антисептиками.
При большом количестве внутримышечных инъекций, на их месте пациенту делается йодная сетка, — йодом рисуется сетка на площади, в которую делаются инъекции (напр., на ягодицах). Это нужно для того, чтобы быстро рассасывались «шишки», образовавшиеся в местах внутримышечных инъекций.
Широко рекламируется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в целом мало обосновано и нередко сопровождается различными рекламными заявлениями.
В качестве антисептика применяется всё реже и реже, наряду со спиртовым раствором йода используется зелёнка, фукорцин, пиоктанин, растворы перекиси водорода и др.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
В криминалистике
В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
В технике: рафинирование металлов
Источники света
Йод используется в источниках света:
Производство аккумуляторов
Йод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Лазерный термоядерный синтез
Некоторые йодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах йода (исследования в области лазерного термоядерного синтеза).
Радиоэлектронная промышленность ]
В последние годы резко повысился спрос на йод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления йода
Мировое потребление йода в 2005 году составило 25,8 тыс. тонн
Биологическая роль
Йод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, ламинария, фукус и другие) накапливают до 1 % йода. Богаты йодом водные растения семейства рясковых. Йод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
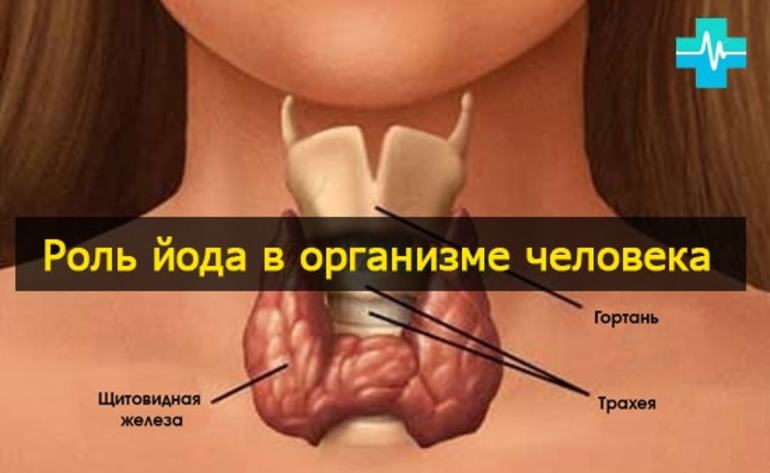
Йод и щитовидная железа
У животных и человека йод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трийодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
Отсутствие или недостаток йода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом йода, с профилактической целью добавляют йодид калия, йодид натрия или йодат калия (йодированная соль).
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток йода в пище обычно легко переносится организмом, однако в отдельных случаях в людях с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы.
Токсичность

ПДК йода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
Радиоактивный йод-131 (радиойод), являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный йод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным йодом являются атомные станции и фармакологическое производство. В то же время это свойство радиойода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний (см. выше).
История открытия
Йод был открыт в 1811 году французским химиком Бернаром Куртуа (1777—1838). Одна из первых его работ в начале 1800-х годов состояла в том, чтобы помочь своему отцу в изготовлении соединений натрия и калия (нитрат калия, KNO3) из морских водорослей.
Куртуа и его отец собирали водоросли на побережьях Нормандии и Бретани во Франции. Затем они жгли их и смачивали пепел водорослей в воде, чтобы растворить соединения натрия и калия. Однажды в 1811 году Бернар добавил серную кислоту и увидел фиолетовые пары, которые конденсировались, образуя кристаллы с металлическим блеском. Куртуа догадался, что это был новый элемент, который он назвал в честь его цвета (на греческом языке слово «иодес» означает «фиолетовый»).
Куртуа дал небольшое количество этого вещества Шарлю-Бернару Десормесу и Николя Клеману, которые провели систематическое расследование. В ноябре 1813 года они выставили йод в Императорском институте в Париже. То, что это действительно новый элемент, было доказано Джозефом Гей-Люссаком и подтверждено Хамфри Дэви, который отправил отчёт в Королевское учреждение в Лондоне, где ошибочно предположили, что он был первооткрывателем, и это убеждение сохранялось более 50 лет.
Основная информация
Йод является важным элементом, необходимым для жизни. Он наиболее известен своей ролью в выработке гормонов щитовидной железы у людей, а также у всех позвоночных. Дефицит йода может привести к серьёзным проблемам со здоровьем, включая зоб (увеличение щитовидной железы), умственную отсталость и кретинизм.
В качестве чистого элемента он представляет собой блестящий пурпурно-чёрный неметалл, твёрдый при стандартных условиях. Он легко переходит из твёрдого в газообразное состояние, минуя жидкую форму, и выделяет пурпурный пар. Хотя это технически неметалл, он обладает некоторыми металлическими качествами. Основными характеристиками элемента являются:
Физические свойства
Йод является одним из самых ярких и красивых элементов. Как твёрдое вещество, это тяжёлый, серовато-черный, металлический материал. Среди его основных физических свойств можно выделить:
Химические свойства
Как и другие галогены, йод является активным элементом. Однако он менее активен, чем три галогена, стоящие над ним в периодической таблице. Основные химические свойства йода:
Наличие в природе
Йода не очень много в земной коре. По оценкам, его количество составляет от 0,3 до 0,5 частей на миллион. Он находится в нижней трети элементов, с точки зрения изобилия. Но, тем не менее, он более распространён, чем кадмий, серебро, ртуть и золото. Его содержание в морской воде ещё меньше — около 0,0003 частей на миллион.
Этот элемент, как правило, концентрируется в земной коре лишь в нескольких местах, когда-то покрытых океанами. За миллионы лет океаны испарились и оставили химические соединения, которые были растворены в них и сегодня существуют под землёй, как соляные копи.
Существует возможность собирать этот элемент из морской воды, солоноватой воды, рассола или морских водорослей. Морская вода имеет разные названия, в зависимости от количества растворенных в ней твёрдых веществ. Водоросли являются популярным источником йода, так как поглощают элементы из морской воды. Со временем они начинают иметь гораздо более высокую концентрацию йода, чем морская вода. Морскую водоросль собирают, сушат и сжигают для сбора вещества. Процесс мало чем отличается от того, который использовал Куртуа в 1811 году.
Изотопы элемента
Известен только один природный изотоп элемента — йод-127. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Примерно 30 радиоактивных изотопов йода были изготовлены искусственно. Это такие изотопы, которые распадаются на части и выделяют некоторую форму радиации. Они образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Применение изотопов
Ряд изотопов йода имеет коммерческое использование. В медицинских целях они вводятся в организм пациента через рот, а затем проходят через тело в кровотоке. Когда они путешествуют, то излучают радиацию. Это излучение обнаруживается с помощью рентгеновской плёнки. Медицинский специалист может сказать, насколько хорошо организм функционирует, наблюдая диаграмму направленности. Изотопы йода используются и в следующих целях:
Наиболее распространённым изотопом является йод-131. При попадании в организм он имеет тенденцию поступать непосредственно в щитовидную железу, а затем используется для выработки гормонов щитовидной железы.
Получение и нахождение
Этот элемент коммерчески производится из йодсодержащих рассолов. Природные рассолы или рассолы, извлечённые из нефтяных скважин, содержащие до 150 мг на литр (0,02 унции на галлон), обнаружены в Яве, Калифорнии и северной Италии. В число ведущих мировых производителей входят Чили, Япония, Китай, Россия и Азербайджан.
Примеси, такие как глина, песок и масло, удаляются фильтрацией, а раствор пропускается через поток диоксида серы, а затем через несколько контейнеров, в которых содержатся пучки медной проволоки. Образующийся йодид меди удаляют фильтрацией, промывают водой, сушат и тонко измельчают. Продукт нагревают с карбонатом калия, получая йодид калия, который затем окисляют до свободного элемента дихроматом и серной кислотой.
Использование и применение
Около 2/3 всего йода и его соединений используется в системах санитарии или в производстве различных антисептиков и лекарств. Вещество также используется для изготовления красителей, фотоплёнки и специального мыла. Он применяется в некоторых отраслях промышленности в качестве катализатора — вещества, используемого для ускорения или замедления химической реакции. Он не претерпевает никаких изменений во время реакции.
Элемент может оказывать как благоприятное, так и неблагоприятное воздействие на живые организмы. Он имеет тенденцию убивать бактерии и другие болезнетворные организмы. Это свойство вещества вызывает его использование в системах санитарии и в качестве антисептика — химического вещества, останавливающего рост микробов.
Настойка йода всегда была одним из самых популярных антисептических препаратов Её наносили на порезы и раны, чтобы предотвратить заражение. Сегодня она часто заменяется другими антисептиками.
Одной из причин того, что сегодня настойка используется реже, является то, что она также может вызвать проблемы. В более высоких дозах йод может раздражать или сжигать кожу. Он также может быть довольно ядовитым, если принимать его внутрь, поэтому важно использовать его согласно инструкции.
Другими важными областями применения йода являются:
Биологическая роль
Йод является важным элементом для людей, которым требуется суточное его потребление в количестве около 0,1 мг. Максимальная безопасная для здоровья доза единовременного потребления — 0.5 г (500 мкг). Тело человека содержит до 20 миллиграмм этого элемента, главным образом в щитовидной железе, которая помогает регулировать рост и температуру тела.
Обычно люди получают достаточно йода из пищи, которую они едят. Дефицит же этого микроэлемента может вызвать опухоль щитовидной железы (известный, как зоб). Зоб вызывает большой комок в шее, поскольку щитовидная железа выходит из-под контроля. (Он может вырасти до размера виноградного плода.) Зоб пытается производить гормоны щитовидной железы, но он не получает достаточного количества йода из рациона человека, поэтому продолжает расширяться, пытаясь сделать свою работу.
Недостаток йода может вызвать и другие проблемы. Например, гормоны щитовидной железы необходимы для нормального развития мозга у нерожденного ребёнка и продолжения этого развития после рождения. Люди, которые не включают в свой рацион достаточного количества микроэлемента, не развиваются нормально.
Сегодня эксперты говорят, что низкий уровень йода является основной причиной умственной отсталости, глухоты, мутизма (неспособности говорить) и паралича. К менее серьёзным проблемам относятся сонливость, неуклюжесть и неспособность к обучению.
Количество йода в организме человека очень мало. Для определения его количества вес человека делится на 2 500 000. Полученное число и есть вес элемента в организме. Для нормальных людей эта сумма примерно равна размеру головки булавки, но эта крошечная точка может иметь большое значение для здоровья.
Низкий уровень микроэлемента может быть легко исправлен. Сегодня в большинстве развитых стран компании, производящие поваренную соль, добавляют небольшое количество йодида калия (KI) в соль, которая обозначается «йодированная соль». Люди, которые её используют, получают необходимое количество для нормальной работы щитовидной железы.
Но те, кто живет в развивающихся странах, могут не получать йодированной соли. Всемирная организация здравоохранения (ВОЗ) пытается найти способы обеспечения микроэлементом этих людей. По оценкам ВОЗ, 1,5 млрд человек живут в районах с низким уровнем йода. До 20 млн из этих людей могут иметь психические расстройства из-за его недостатка. ВОЗ начала программу по обеспечению будущего поколения в таких регионах этим микроэлементом, необходимым для нормального развития и функционирования.
Глоссарий. Химия
Ио́д (тривиальное (общеупотребительное) название — йод; от др.-греч. ἰώδης — «фиалковый (фиолетовый)») — элемент 17-й группы перйодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), пятого перйода, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество йод (CAS-номер: 7553-56-2) при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I2).
История
йод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент. Название и обозначение Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰώδης, ιώο-ειδης (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом, например «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века. В современной химической номенклатуре используется наименование йод. Такое же положение существует в некоторых других языках, например в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента J был заменен на I.
Физические свойства
йод при обычных условиях — твердое чёрно-серое вещество с металлическим блеском и специфическим запахом. Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. йод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей.