Марганец (Mn, Manganum)
История марганца
Первооткрывателями марганца принято считать шведских химиков К. Шееле и Ю. Гана, первый из которых в 1774 году обнаружил неизвестный металл в широко используемой железной руде, называемой в древности чёрной магнезией, второй же путём нагревания смеси пиролюзита (основного минерала марганца) с углём получил металлический марганец ( calorizator). Название новый металл получил от немецкого Manganerz, т.е. марганцевая руда.
Общая характеристика марганца
Марганец является элементом побочной подгруппы VII группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 25 и атомную массу 54,9380. Принятое обозначение – Mn (от латинского Manganum).
Нахождение в природе
Марганец достаточно распространён, входит во вторую десятку элементов по распространённости. В земной коре встречается чаще всего совместно с железными рудами, но имеются и месторождения именно марганца, например в Грузии и России.
Физические и химические свойства
Марганец является тяжёлым серебристо-белым металлом, так называемым чёрным металлом. При нагревании имеет свойство разлагать воду, вытесняя водород. В обычном состоянии поглощает водород.
Суточная потребность в марганце
Для взрослого здорового человека суточная потребность в марганце составляет 5-10 мг.
Продукты питания богатые марганцем
Марганец попадает в организм человека с пищей, поэтому в обязательном порядке необходимо ежедневно съедать один или несколько продуктов из следующего списка:
Полезные свойства марганца и его влияние на организм
Функции марганца в организме человека:
Взаимодействие с другими
Марганец помогает активизировать ферменты, необходимые для правильного использования организмом биотина, витаминов B1 и С. Взаимодействие марганца с медью и цинком является признанным антиоксидантным средством. Большие дозы кальция и фосфора будут задерживать всасывание марганца.
Применение марганца в жизни
Наибольшее применение марганец нашёл в металлургии, также при производстве реостатов, гальванических элементов. Соединения марганца используют как термоэлектрический материал.
Признаки нехватки марганца
При режиме питания, утяжелённом большим количеством углеводов, в организме происходит перерасход марганца, что проявляется следующими симптомами: анемия, снижение прочности костей, задержка роста, а также атрофия яичников у женщин и яичек у мужчин.
Признаки избытка марганца
Излишек марганца также неполезен организму, его проявлениями могут служить сонливость, боли в мышцах, потеря аппетита и изменения в формировании костей – так называемый «марганцевый» рахит.
Марганец (Mn)
Соединения марганца:
Пиролюзит(минерал марганца) был известен людям еще с древних времен, он использовался нашими предками для осветления стекла, получаемого варкой. До 1774 г. пиролюзит считали разновидностью магнитного железняка. И только в 1774 г. швед К. Шееле догадался, что в пиролюзите присутствует неизвестный тогдашней науке металл, после чего Ю. Ган получил металлический марганец, нагревая пиролюзит в печке с углем. Свое название «марганец» получил в начале 19 века (от немецкого Manganerz — марганцевая руда).
Марганец занимает 14-е место среди всех химических элементов по распространенности в земной коре. Больше всего марганца содержится в основных породах. Самостоятельные месторождения марганца крайне редки, чаще этот металл сопутствует железу во многих его рудах. Достаточно много марганца содержится в железо-марганцевых конкрециях, расположенных в донной части Мирового океана.
Минералы, богатые марганцем:
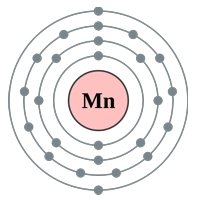
Рис. Строение атома марганца.
Физические свойства марганца:
Известны 4 модификации марганца: α-форма; β-форма; γ-форма; δ-форма.
До 710°C устойчивой является α-форма, которая при дальнейшем нагревании последовательно через все модификации переходит к δ-форме (1137°C).
Химические свойства марганца
Применение и получение марганца
Биологическая роль марганца:
Марганец входит в десятку «металлов жизни», необходимых для нормальной жизнедеятельности животных и растительных клеток.
В теле взрослого человека содержится порядка 12 мг марганца, который участвует в образовании белковых комплексов, а также входит в состав некоторых нуклеиновых кислот, аминокислот, ферментов (аргиназы и холинэстеразы).
Марганец наряду с магнием участвует в активации гидролиза АТФ, обеспечивая тем самым энергетическую жизнедеятельность живой клетки.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Марганец: сплавы, свойства, распространение
Марганец – химический элемент с атомной массой 54,9380 и атомным номером 25, серебристо-белого оттенка, с большой массой, в природе существует в виде стабильного изотопа 35 Мn. Первые упоминания о металле записал древнеримский ученый Плиний, называл его «черным камнем». В те времена марганец использовался в качестве осветлителя стекла, во время процесса варки в расплав добавлялся пиролюзит марганца МnО2.
В Грузии издавна пиролюзит марганца использовался как присадка во время получения железа, назывался черной магнезией и считался одной из разновидностей магнетита (магнитного железняка). Лишь в 1774 году шведским ученым Шееле было доказано, что это соединение неизвестного науке металла, а через несколько лет Ю. Ган во время нагревания смеси угля и пиролюзита получил первый марганец, загрязненный атомами углерода.
Природное распространение марганца
В регионах с сухим климатом преобладает щелочная окислительная среда, что ограничивает подвижность металла. В культурных растениях ощущается недостаток марганца, сельхозпроизводство не может обходиться без использования специальных комплексных микродобавок. В реках химический элемент малораспространен, но суммарный вынос может достигать больших величин. Особенно много марганца имеется в прибрежных зонах в виде естественных осадков. На дне океанов встречаются большие залежи металла, которые образовались в давние геологические периоды, когда дно было сушей.
Химические свойства марганца
Марганец относится к категории активных металлов, при повышенных температурах активно вступает в реакции с неметаллами: азотом, кислородом, серой, фосфором и другими. В результате образуются разновалентные окислы марганца. При комнатной температуре марганец химический элемент малоактивен, при растворении в кислотах образует двухвалентные соли. При нагреве в вакууме до высоких температур химический элемент способен испаряться даже из устойчивых сплавов. Соединения марганца во многом схожи с соединениями железа, кобальта и никеля, находящихся в такой же степени окисления.
Наблюдается большое сходство марганца с хромом, подгруппа металла также имеет повышенную устойчивость при высших степенях окисления при увеличении порядкового номера элемента. Перенаты являются менее сильными окислителями, чем перманганаты.
Исходя из состава соединений марганца (II) допускается образование металла с более высокими степенями окисления, такие превращения могут происходить как в растворах, так и в расплавах солей.
Стабилизация степеней окисления марганца Существование большого числа степеней окисления у марганца химического элемента объясняется тем, что в переходных элементах во время образования связей с d-орбиталями их энергетические уровни расщепляются при тетраэдрическом, октаэдрическом и квадратном размещении лигандов. Ниже приводится таблица известных в настоящее время степеней окисления некоторых металлов в первом переходном периоде.
Обращают на себя внимание низкие степени окисления, которые встречаются в большом ряде комплексов. В таблице есть перечень соединений, в которых лигандами являются химически нейтральные молекулы CO, NO и другие.
За счет комплексообразования стабилизируются высокие степени окисления марганца, самыми подходящими для этого лигандами является кислород и фтор. Если принимать во внимание, что стабилизирующее координационное число равняется шести, то максимальная стабилизация равняется пяти. Если марганец химический элемент образует оксокомплексы, то могут стабилизироваться более высокие степени окисления.
Фторо- и оксокомплексы
Стабилизация марганца в низших степенях окисления
Теория мягких и жестких кислот и оснований дает возможность объяснить стабилизацию разных степеней окисления металлов за счет комплексообразования при воздействии с лигандами. Элементы мягкого типа успешно стабилизируют невысокие степени окисления металла, а жесткие положительно стабилизируют высокие степени окисления.
Теория полностью объясняет связи металл-металл, формально эти связи рассматриваются как кислотно-основное взаимное воздействие.
Сплавы марганца Активные химические свойства марганца позволяют ему образовывать сплавы со многими металлами, при этом большое количество металлов может растворяться в отдельных модификациях марганца и стабилизировать его. Медь, железо, кобальт, никель и некоторые другие металлы способны стабилизировать γ-модификацию, алюминий и серебро способны расширять β- и σ-области магния в двойных сплавах. Эти характеристики играют важную роль металлургии. Марганец химический элемент позволяет получать сплавы и высокими значениями пластичности, они поддаются штамповке, ковке и прокату.
В химических соединениях валентность марганца изменяется в пределах 2–7, увеличение степени окисления становится причиной возрастания окислительных и кислотных характеристик марганца. Все соединения Mn(+2) относятся к восстановителям. Оксид марганца имеет восстановительные свойства, серо-зеленого цвета, в воде и щелочах не растворяется, зато отлично растворяется в кислотах. Гидроксид марганца Mn(OH)3 в воде не растворяется, по цвету белое вещество. Образование Mn(+4) может быть и окислителем (а), и восстановителем (б).
Эта реакция используется при необходимости получения в лабораторных условиях хлора.
Марганец – химический элемент, который можно получать и галогенным процессом за счет хлорирования руды и дальнейшим восстановлением образовавшихся галогенидов. Такая технология обеспечивает промышленность марганцем с количеством посторонних технологических примесей не более 0,1%. Более загрязненный металл получают при протекании алюмотермической реакции:
Или электротермией. Для удаления вредных выбросов в производственных цехах монтируется мощная принудительная вентиляция: воздуховоды из ПВХ, вентиляторы центробежного принципа действия. Кратность обмена воздуха регламентируется нормативными положениями и должна обеспечивать безопасное пребывание людей в рабочих зонах.
Использование марганца Главный потребитель марганца – черная металлургия. Широкое использование металл имеет и в фармацевтической промышленности. На одну тонну выплавляемой стали необходимо 8–9 килограмм, перед введением в сплав марганца химического элемента его предварительно сплавляют с железом для получения ферромарганца. В сплаве доля марганца химического элемента составляет до 80%, углерода до 7%, остальное количество занимает железо и различные технологические примеси. За счет использования добавок значительно повышаются физико-механические характеристики сталей, выплавляемых в доменных печах. Технология пригодна и для использования добавок в современных электрических сталелитейных печах. За счет добавок высокоуглеродистого ферромарганца происходит раскисление и десульфарация стали. При добавке средне- и малоуглеродистых ферромарганцев металлургия получает легированные стали.
Низколегированная сталь имеет в составе 0,9–1,6% марганца, высоколегированная до 15%. Высокими показателями физической прочности и антикоррозионной устойчивости обладает сталь с содержанием 15% марганца и 14% хрома. Металл износоустойчив, может работать в жестких температурных условиях, не боится прямого контакта с агрессивными химическими соединениями. Такие высокие характеристики позволяют использовать сталь для изготовления наиболее ответственных конструкций и промышленных агрегатов, работающих в сложных условиях.
Марганец – химический элемент, применяемый и во время выплавки сплавов на безжелезной основе. Во время производства высокооборотных лопаток промышленных турбин используется сплав меди с марганцем, для пропеллеров применяются бронзы с содержанием марганца. Кроме этих сплавов, марганец как химический элемент присутствует в алюминиевых и магниевых. Он намного улучшает эксплуатационные характеристики цветных сплавов, делает их хорошо деформируемыми, не боящимися коррозионных процессов и износостойкими.
Легированные стали являются основным материалом для тяжелой промышленности, незаменимы во время производства различных типов вооружений. Широко применяются в кораблестроении и самолетостроении. Наличие стратегического запаса марганца – условие высокой обороноспособности любого государства. В связи с этим добыча металла ежегодно увеличивается. Кроме того, марганец – химический элемент, применяемый во время производства стекла, в сельском хозяйстве, полиграфии и т. д.
Марганец в флоре и фауне
В живой природе марганец – химический элемент, играющий важную роль в развитии. Он влияет на характеристики роста, состав крови, интенсивность процесса фотосинтеза. В растениях его количество составляет десятитысячные доли процента, а в животных стотысячные доли процента. Но даже такое незначительное содержание оказывает заметное влияние на большинство их функций. Он активирует воздействие ферментов, влияет на функцию инсулина, минеральный и кроветворный обмен. Недостаток марганца становится причиной появления различных болезней как острых, так и хронических.
Марганец – химический элемент, широко используемый в медицине. Недостаток марганца понижает физическую выносливость, становится причиной некоторых видов анемий, нарушает обменные процессы в костных тканях. Широко известны дезинфицирующие характеристики марганца, его растворы используются во время обработки некрозных тканей.
Недостаточное количество марганца в пище животных становится причиной снижения ежесуточного привеса. Для растений такая ситуация становится причиной пятнистости, ожогов, хлорозов и других заболеваний. При обнаружении признаков отравления назначается специальная медикаментозная терапия. Сильное отравление может становиться причиной появления синдрома марганцевого паркинсонизма – трудноизлечимой болезни, оказывающей негативное влияние на центральную нервную систему человека.
Суточная потребность марганца составляет до 8 мг, главное количество человек получает с пищей. При этом рацион должен быть сбалансированным по всем питательным веществам. При увеличенной нагрузке и недостаточном количестве солнечного света доза марганца корректируется на основании общего анализа крови. Значительное количество марганца содержится в грибах, водяных орехах, ряске, моллюсках и ракообразных. Содержание марганца в них может достигать нескольких десятых процента.
Марганец, свойства атома, химические и физические свойства
Марганец, свойства атома, химические и физические свойства.
54,938045(5) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2
Марганец — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 25. Расположен в 7-й группе (по старой классификации — побочной подгруппе седьмой группы), четвертом периоде периодической системы.
Физические свойства марганца
Атом и молекула марганца. Формула марганца. Строение атома марганца:
Марганец – металл. Относится к группе переходных металлов. Относится к чёрным металлам.
Марганец обозначается символом Mn.
Как простое вещество марганец при нормальных условиях представляет собой твёрдый, тяжёлый, хрупкий металл серебристо-белого цвета.
Молекула марганца одноатомна.
Химическая формула марганца Mn.
Строение атома марганца. Атом марганца состоит из положительно заряженного ядра (+25), вокруг которого по четырем оболочкам движутся 25 электронов. При этом 23 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку марганец расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома марганца на 3d-орбитали находится пять неспаренных электронов. На внешнем энергетическом уровне атома марганца – на s-орбитали находится два спаренных электрона. В свою очередь ядро атома марганца состоит из 25 протонов и 30 нейтронов.
Радиус атома марганца (вычисленный) составляет 161 пм.
Атомная масса атома марганца составляет 54,938045(5) а. е. м.
Изотопы и модификации марганца:
Свойства марганца (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Марганец |
| 102 | Прежнее название | |
| 103 | Латинское название | Manganum |
| 104 | Английское название | Manganese |
| 105 | Символ | Mn |
| 106 | Атомный номер (номер в таблице) | 25 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, чёрный металл |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1774 г., Юхан Готлиб Ган (получен в чистом виде), Швеция, 1774 г. |
| 110 | Год открытия | 1774 г. |
| 111 | Внешний вид и пр. | Твёрдый, тяжёлый, хрупкий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 4 аллотропные модификации марганца: – α-марганец с искажённой кубической объёмно-центрированной кристаллической решёткой, – β-марганец с искажённой кубической объёмно-центрированной кристаллической решёткой, – γ-марганец с кубической гранецентрированной кристаллической решёткой, |
| 204 | Радиус атома (вычисленный) | 161 пм |
| 205 | Эмпирический радиус атома* | 140 пм |
| 206 | Ковалентный радиус* | 139 пм – low-spin, 161 пм – high-spin |
| 207 | Радиус иона (кристаллический) | Mn 2+ low spin 5,95 г/см 3 (при температуре плавления 1246 °C и иных стандартных условиях , состояние вещества – жидкость) |
| 402 | Температура плавления* | 1246 °C (1519 K, 2275 °F) |
| 403 | Температура кипения* | 2061 °C (2334 K, 3742 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 12,91 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 221 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,479 Дж/г·K (при 25 °C) – α-марганец |
| 410 | Молярная теплоёмкость* | 26,32 Дж/(K·моль) |
| 411 | Молярный объём | 7,35449 см³/моль |
| 412 | Теплопроводность | 7,81 Вт/(м·К) (при стандартных условиях ), 6,87 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-марганец |
| 512 | Структура решётки | Искажённая кубическая объёмно-центрированная |
| 513 | Параметры решётки | 8,890 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 400 K |
| 516 | Название пространственной группы симметрии | I_ 43m |
| 517 | Номер пространственной группы симметрии | 217 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-96-5 |
205* Эмпирический радиус атома марганца согласно [1] и [3] составляет 127 пм.
206* Ковалентный радиус марганца согласно [1] составляет 139±5 пм (low-spin) и 161±8 пм (high-spin), согласно [3] составляет 117 пм.
402* Температура плавления марганца согласно [3] и [4] составляет 1243,85 °C (1517 K, 2270,93 °F) и 1245 °C (1518,15 K, 2273 °F) соответственно.
403* Температура кипения марганца [3] и [4] составляет 1961,85 °C (2235 K, 3563,33 °F) и 2080 °C (2353,15 K, 3776 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) марганца согласно [3] и [4] составляет 13,4 кДж/моль и 12 кДж/моль (α-марганец) соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) α-марганца согласно [4] составляет 227 кДж/моль.
410* Молярная теплоемкость марганца согласно [3] составляет 26,3 Дж/(K·моль).



















