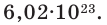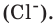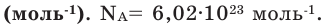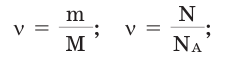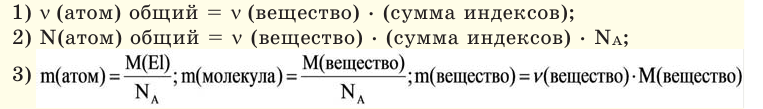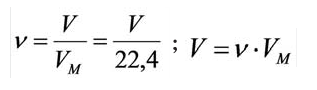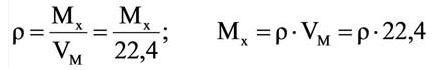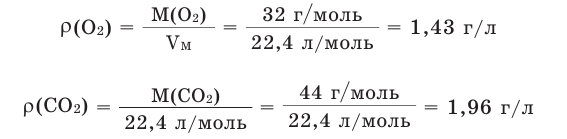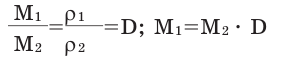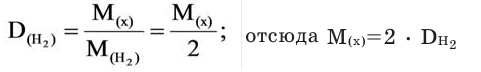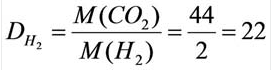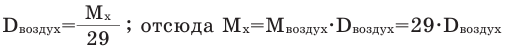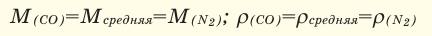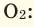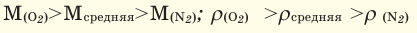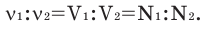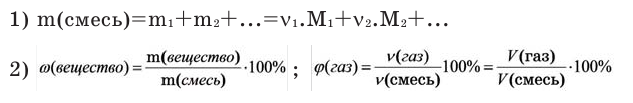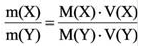Урок 5. Моль и молярная масса
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·10 23 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·10 23 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12 C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·10 23 ).
Молярная масса вещества
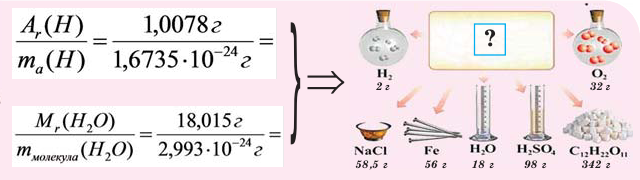
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
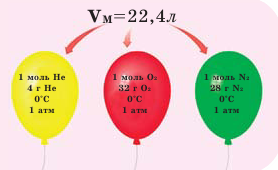
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·10 23 ; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·10 23 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·10 23 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·10 23 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·10 23 молекул/моль, что равно 2,99·10 26 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 


Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
Закон Авогадро и молярный объём газов
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 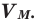
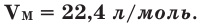
Здесь 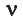
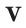
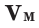
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 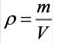
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 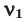
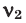
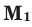
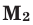

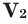
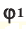
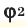
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 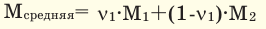
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 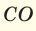
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 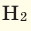
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
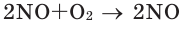
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Молярная масса
Моля́рная ма́сса вещества — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности. [1]
Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов.
Например, молярная масса воды (H2O) есть MH2O = 2 MH +MO = 2·1+16 = 18 (г/моль).
Стоит отметить, что, например, молярная масса кислорода как элемента = 16 (г/моль), а в газообразном состоянии (O2) = 32 (г/моль).
Молярная масса некоторых веществ
| Вещество | г/моль |
|---|---|
| Азот | 28 |
| Аргон | 40 |
| Водород | 2 |
| Водяные пары | 18 |
| Гелий | 4 |
| Воздух | 29 |
| Кислород | 32 |
| Литий | 6 |
| Неон | 20 |
| Серебро | 108 |
| Молибден | 96 |
| Углекислый газ | 44 |
Примечания
Полезное
Смотреть что такое «Молярная масса» в других словарях:
молярная масса — molio masė statusas T sritis fizika atitikmenys: angl. molar mass vok. molare Masse, f; Molmasse, f rus. мольная масса, f; молярная масса, f pranc. masse molaire, f … Fizikos terminų žodynas
молярная масса — molio masė statusas T sritis Standartizacija ir metrologija apibrėžtis Medžiagos dalelių, kurių skaičius lygus Avogadro konstantai, masė, t. y. masė m, padalyta iš medžiagos kiekio n: M = m/n. atitikmenys: angl. molar mass vok. molare Masse, f;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
молярная масса — molinė masė statusas T sritis chemija apibrėžtis Vieno medžiagos molio masė. atitikmenys: angl. molar mass rus. молярная масса … Chemijos terminų aiškinamasis žodynas
молярная масса — molio masė statusas T sritis Energetika apibrėžtis Medžiagos dalelių, kurių skaičius lygus Avogadro konstantai, masė, t. y. medžiagos masė, padalyta iš medžiagos kiekio. atitikmenys: angl. molar mass vok. molare Masse, f; Molmasse, f rus.… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
МОЛЯРНАЯ МАССА — физ. величина, равная отношению массы к кол ву в ва. Единица М. м. (в СИ) кг/моль. М = m/n, где М М. м. в кг/моль, m масса в ва в кг, п кол во в ва в молях. Числовое значение М. м., выраж. в кг/моль, равно относит. молекулярной массе, делённой на … Большой энциклопедический политехнический словарь
Молярная масса эквивалента — Величина Мэквх, численно равная произведению молярной массы вещества х на фактор эквивалентности и рассчитываемая по формуле Мэквх = Мх × fэквх, где Мх молярная масса вещества х, г; fэквх фактор эквивалентности. Примечание. Величина Мэквх… … Словарь-справочник терминов нормативно-технической документации
Молярная концентрация эквивалента — Величина Сэквх, численно равная частному от деления массовой концентрации вещества х на молярную массу его эквивалента и рассчитываемая по формуле где Стх массовая концентрация вещества х, г; Мэквх молярная масса эквивалента вещества х, г.… … Словарь-справочник терминов нормативно-технической документации
МОЛЯРНАЯ MАCCA — физ. величина, равная отношению массы газа (или др. тела) к количеству вещества, которое в нём содержится; обозначается буквой Μ; М = m/n. где т масса вещества, n количество вещества. Числовое значение М в тысячу раз меньше относительной… … Большая политехническая энциклопедия
Молярная концентрация — Концентрация величина, характеризующая количественный состав раствора. Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л) … Википедия
Как пишется молярная масса в химии
Моль, молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12 С:
Таким образом, 1 моль вещества содержит 6,02 • 10 23 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню). Например, в образце вещества содержится 12,04 • 10 23 молекул. Следовательно, количество вещества в этом образце составляет:
где N – число частиц данного вещества;
NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана CH4 определяется следующим образом:
M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02 • 10 23 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе:
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример 
Решение
Молярная масса метана M(CH4) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда:
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
Вычисление ν используется практически в каждой расчетной задаче.
Образцы решения задач
Задача №1. Вычислите массу (г) магния, взятого количеством вещества 0, 5 моль?
M (Mg ) = Ar ( Mg ) = 24 г/моль (из периодической системы)
m ( Mg ) = 24 г/моль · 0,5 моль = 12 г
Задача №2. Вычислите массу (г) 12,04 · 10 23 молекул оксида цинка Zn О ?
n (Zn O )= 12,04 * 10 23 молекул
следовательно, формула для расчёта
M(ZnO) = Ar(Zn) + Ar(O) = 65 + 16 = 81 г / моль
m = 81 г/моль · (12,04 * 10 23 /6.02 · 10 23 1/моль) = 162 г
Задания для закрепления
Заполните таблицу (округляя числа до целых )