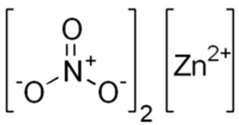Нитрат цинка
| Нитрат цинка | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
| Химическая формула | Zn(NO3)2 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные кристаллы |
| Молярная масса | 189,40 г/моль |
| Химические свойства | |
| Растворимость в воде | 128 25 ; 1250 73 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7779-88-6 |
| Рег. номер PubChem | 24518 |
| SMILES | [N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Zn+2] |
| Регистрационный номер EC | 231-943-8 |
| RTECS | ZH4772000 |
| Номер ООН | 1514 |
Нитрат цинка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Содержание
Получение
Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
Применение
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Нитрат цинка» в других словарях:
Нитрат аммония — Нитрат аммония … Википедия
Нитрат калия — Нитрат калия … Википедия
Нитрат алюминия — Нитрат алюминия … Википедия
Нитрат кальция — Нитрат кальция … Википедия
Нитрат железа(III) — Нитрат железа(III) … Википедия
Нитрат меди(II) — Нитрат меди(II) … Википедия
Нитрат рубидия — Общие Систематическое наименование Нитрат рубидия Традиционные названия Азотнокислый рубидий Химическая формула RbNO3 Физические свойства Состояние … Википедия
Нитрат цезия — Общие Систематическое наименование Нитрат цезия Традиционные названия Азотнокислый цезий Химическая формула CsNO3 Физические свойства Состояние ( … Википедия
Нитрат натрия — Нитрат натрия … Википедия
Нитрат бария — Нитрат бария … Википедия
Формула нитрата цинка
Определение и формула нитрата цинка
Рис. 1. Нитрат цинка. Внешний вид.
Химическая формула нитрата цинка
Химическая формула нитрата цинка Zn(NO3)2. Она показывает, что в составе молекулы этого вещества находится один атом цинка (Ar = 65 а.е.м.), два атома азота (Ar = 14 а.е.м.) и шесть атомов кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу нитрата цинка:
Mr(Zn(NO3)2) = 65 + 2×14 + 6×16 = 65 + 28 + 96 = 189.
Структурная (графическая) формула нитрата цинка
Структурная (графическая) формула нитрата цинка является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
Ионная формула
Нитрат цинка является электролитом, т.е. в водном растворе диссоциирует на ионы согласно следующему уравнению:
Примеры решения задач
| Задание | При полном сгорании некоторого количества углеводорода образовалось 14,08 г оксида углерода (IV) и 3,6 г воды. Найдите молекулярную формулу вещества, если относительная плотность его паров по водороду равна 39. |
| Решение | Составим схему реакции сгорания аминокислоты обозначив количество атомов углерода, водорода, кислорода и азота за «x», «у», «z» и «k» соответственно: |
Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м.
Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m(C) = [14,8 / 44]×12 = 4,04 г;
m(H) = 2×3,6 / 18 ×1= 0,4 г.
Определим химическую формулу углеводорода:
Значит его простейшая формула CH, а молярная масса 13 г/моль [M(CH) = Ar(C) + Ar(H) = 12 + 1 =13 / моль].
Значение молярной массы органического вещества можно определить при помощи его плотности по водороду:
Msubstance = 2 × 39 = 78 г/моль.
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Msubstance / M(CH) = 78 / 13 = 6.
Значит индексы атомов углерода и водорода должны быть в 6 раз выше, т.е. формула вещества будет иметь вид C6H6.Это бензол.
| Задание | При полном сгорании на воздухе 7,4 г кислородсодержащего органического соединения образовалось 6,72 л (н.у.) углекислого газа и 5,4 мл воды. Выведите формулу этого соединения. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно: |
Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м.
Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m(C) = [6,72 / 22,4]×12 = 3,6 г;
m(H) = [2×5,4 ×1 / 18 ×1 (г/мл)] = 0,6 г.
Определим химическую формулу соединения:
x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O);
x:y:z= 0,3 : 0,6 : 0,2 = 1,5: 3 : 1 = 3 : 6 : 2.
Значит простейшая формула соединения C3H6O2 и молярная масса 64 г/моль
Нитрат цинка: состав, свойства, получение, применение.
Содержание:
Он служит ускорителем реакций органической химии и позволяет получать композитные полимеры с электропроводящими свойствами. Он используется для формирования слоев материалов, используемых в электронике.
Он входит в состав некоторых жидких удобрений и некоторых гербицидов с медленным высвобождением. Помогает в получении сложных оксидов, улучшая их плотность и электропроводность.
Он был успешно протестирован при получении структур, которые служат основой для регенерации и роста костной ткани, улучшают этот процесс и являются эффективным антибактериальным средством.
Хотя он негорючий, он может ускорить горение таких веществ, как уголь или органические материалы. Он раздражает кожу, глаза и слизистые оболочки и очень токсичен для водных организмов.
Состав
Номенклатура
Свойства
Физическое состояние
Бесцветное или белое кристаллическое твердое вещество.
Молекулярный вес
Температура плавления
Точка кипения
Плотность
Растворимость
Растворим в воде: 120 г / 100 г H2Или при 25 ° С. Растворим в спирте.
pH
Его водные растворы кислые. 5% раствор имеет pH примерно 5.
Химические свойства
Будучи нитратом, это соединение является сильным окислителем. Реагирует бурно с углеродом, медью, сульфидами металлов, органическими веществами, фосфором и серой. Если его распылить на раскаленный уголь, он взорвется.
С другой стороны, он гигроскопичен и впитывает воду из окружающей среды. При нагревании образует оксид цинка, диоксид азота и кислород:
В щелочных растворах, таких как NaOH, цинк в этом соединении образует гидроксид и другие сложные формы:
Получение
Его можно получить обработкой цинка или оксида цинка разбавленной азотной кислотой. В этой реакции образуется газообразный водород.
Приложения
В катализе реакций
Он используется в качестве катализатора для получения других химических соединений, таких как смолы и полимеры. Это кислотный катализатор.
В композитных полимерах
Полиметилметакрилат и Zn (NO3)2 со свойствами электропроводности, которые делают их подходящими кандидатами для использования в суперконденсаторах и высокоскоростных компьютерах.
В оксидных цементах
С помощью водных растворов нитрата цинка и порошка оксида цинка получают материалы, которые относятся к классу цементов, образующихся в результате кислотно-щелочной реакции.
Они обладают разумной устойчивостью к растворению в разбавленных кислотах и щелочах, развивая сопротивление сжатию, сравнимое с сопротивлением других цементов, таких как оксихлориды цинка.
Это свойство увеличивается по мере того, как ZnO / Zn (NO3)2, а как концентрация Zn (NO3)2 в растворе. Полученные цементы полностью аморфны, то есть не имеют кристаллов.
В покрытиях из оксида цинка и наноматериалах
Zn (НЕТ3)2 Он используется для электролитического осаждения очень тонких слоев оксида цинка (ZnO) на различные подложки. Наноструктуры из этого оксида также изготавливаются на поверхностях.
ZnO представляет собой материал, представляющий большой интерес из-за множества применений в области оптоэлектроники, он также обладает полупроводниковыми свойствами и используется в датчиках и преобразователях.
В гербицидах
Нитрат цинка использовался в сочетании с некоторыми органическими соединениями для замедления скорости высвобождения определенных гербицидов в воду. Медленный выпуск этих продуктов позволяет им оставаться доступными в течение более длительного времени и требует меньшего количества приложений.
В производстве анодов
Испытанные материалы представляют собой сложные оксиды стронция, иридия, железа и титана. Присутствие цинка значительно увеличивает их электропроводность.
Другие приложения
Используется при получении лекарств. Он действует как протрава при нанесении чернил и красителей. Служит латексным коагулянтом. Это источник цинка и азота в жидких удобрениях.
Возможное использование в инженерии костной ткани
Этот состав использовался в качестве добавки при разработке каркасов или каркасов для регенерации костных волокон, поскольку он позволяет улучшить механическое сопротивление этих структур.
Было обнаружено, что цинкосодержащий каркас не токсичен для клеток-остеопрогениторов, поддерживает активность остеобластов, клеток, образующих кость, и улучшает их адгезию и пролиферацию.
Он способствует образованию апатита, минерала, образующего кости, а также обладает антибактериальным действием.
Риски
Это материал с потенциальной опасностью пожара и взрыва.
При воздействии сильной жары выделяются токсичные газы оксидов азота. А если выдерживать длительное время, она может взорваться.
Он раздражает кожу, может вызвать серьезное повреждение глаз, раздражение дыхательных путей, токсичен при проглатывании и вызывает повреждение пищеварительного тракта.
Очень токсично для водных организмов с долгосрочными последствиями.
Ссылки
Что такое делитель напряжения? (с примерами)
Нитрат цинка
| Нитрат цинка | |
|---|---|
 | |
| Систематическое наименование | Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
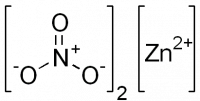
| Хим. формула | Zn(NO3)2 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 189,40 г/моль |
| Растворимость | |
| • в воде | 128 25 ; 1250 73 г/100 мл |
| ГОСТ | ГОСТ 5106-77 |
| Рег. номер CAS | 7779-88-6 |
| PubChem | 24518 |
| Рег. номер EINECS | 231-943-8 |
| SMILES | |
| RTECS | ZH4772000 |
| Номер ООН | 1514 |
| ChemSpider | 22926 и 57426206 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат цинка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Содержание
Получение
Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
С аммиаком образует аддукты с общей формулой Zn(NO3)2•n NH3.
Соли цинка
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
ZnS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr