Угольная кислота
реальные: 1) 3,60;
2) 10,33
кажущаяся [1] : 6,37
Содержание
Физические свойства
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 129 пм.
Химические свойства
Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:

В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:

Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции

Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:

Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе 
Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:




При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:

Получение
Угольная кислота образуется при растворении в воде диоксида углерода:
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:

Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы 
Органические производные
Некоторые представители подобных соединений перечислены в таблице.
| Класс соединений | Пример соединения |
|---|---|
| Сложные эфиры | поликарбонаты |
| Хлорангидриды | фосген |
| Амиды | мочевина |
| Нитрилы | циановая кислота |
| Ангидриды | пироугольная кислота |
См. также
Примечания
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | — | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
 Оксиды углерода Оксиды углерода | ||
|---|---|---|
| Оксиды | CO2 · CO |  |
| Экзотические оксиды | Карбонилы металлов · Угольная кислота · Гидрокарбонаты · Карбонаты · Дикарбонаты · Трикарбонаты | |
Полезное
Смотреть что такое «Угольная кислота» в других словарях:
УГОЛЬНАЯ КИСЛОТА — Н2СО3, очень слабая и непрочная двухосновная кислота. Образуется при растворении диоксида углерода в воде. Дает соли карбонаты и гидрокарбонаты … Большой Энциклопедический словарь
УГОЛЬНАЯ КИСЛОТА — (H2CO3) очень слабая и непрочная двухосновная кислота, образующаяся при растворении в воде диоксида углерода (углекислого газа) CO2. Дает 2 ряда солей: карбонаты и бикарбонаты (гидрокарбонаты). В природе широко распространены нормальные карбонаты … Российская энциклопедия по охране труда
Угольная кислота — УГОЛЬНАЯ КИСЛОТА, H2CO3, образуется при растворении углерода диоксида в воде. Важнейшие производные карбонаты, мочевина (карбамид). … Иллюстрированный энциклопедический словарь
угольная кислота — Н2СО3, очень слабая и непрочная двухосновная кислота. Образуется при растворении диоксида углерода в воде. Даёт соли карбонаты и гидрокарбонаты. * * * УГОЛЬНАЯ КИСЛОТА УГОЛЬНАЯ КИСЛОТА, Н2СО3, очень слабая и непрочная двухосновная кислота.… … Энциклопедический словарь
Угольная кислота — H2CO3, слабая двухосновная кислота, при нормальных условиях существующая только в разбавленных водных растворах. У. к. образуется при растворении в воде двуокиси углерода: 2, при нормальных условиях не превышает 1% от содержания CO2.… … Большая советская энциклопедия
УГОЛЬНАЯ КИСЛОТА — Н2СО3, очень слабая и непрочная двухосновная кислота. Образуется при растворении диоксида углерода в воде. Даёт соли карбонаты и гидрокарбонаты … Естествознание. Энциклопедический словарь
Угольная кислота — (медико санит.) см. Углерод … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
УГОЛЬНАЯ КИСЛОТА — H2CO3, образуется при растворении CO2 в воде. Проявляет св ва слабой к ты. Равновесие CO2+H2O H2CO3 смещено влево, поэтому меньшая часть CO2 находится в р ре в виде H2CO3. Для У. к. константы диссоциации K1=4,27 … Химическая энциклопедия
УГОЛЬНАЯ КИСЛОТА — Н2СО3 очень слабая к та, существующая только в водном р ре. У. к. образуется при растворении углерода диоксида в воде (H2О + CO2 H2CO3). Как двухосновная к та У. к. даёт 2 ряда солей: средние карбонаты и кислые гидрокарбонаты … Большой энциклопедический политехнический словарь
УГОЛЬНАЯ КИСЛОТА, H2CO3 — УГОЛЬНАЯ КИСЛОТА, H2CO3, образуется при растворении углерода диоксида в воде. Важнейшие производные карбонаты, мочевина (карбамид) … Современная энциклопедия
Физические и химические свойства
Угольная кислота способна существовать в равновесии с диоксидом углерода в водных растворах. Однако при изменении условий, в частности, температуры, этот карбонатный класс склонен распадаться, одновременно происходит окисление гидроксида. Также встречается безводная форма, которая представляет собой небольшие бесцветные кристаллы, образующиеся при температурах ниже минус 30 градусов. При ее нагревании происходит диссоциация угольной кислоты, при которой твёрдая форма полностью разлагается.
Соляный ангидрид свое название получил из-за формулы угольной кислоты, в которой содержится СО2. Газ может подвергаться обратному гидролизу, создавая устойчивую кислую среду. В растворах, содержащих эти элементы, возникает равновесная сложная система, которая сохраняет свою химическую формулу и физические свойства. При повышении температуры стабильность и равновесие такого раствора нарушается, а кислота начинает разлагаться. Полностью этот процесс завершается при кипячении водного раствора.
Угольная кислота, графическая формула которой выглядит как H2CO3, имеет нейтральную реакцию, образуя кислые и средние соли, в том числе гидрокарбонаты и карбонаты. На сегодняшний день это вещество отлично изучено, химикам известна степень, молярное уравнение, масса, константа и степень валентности. Такие соединения получили широкое распространение в пищевой промышленности, их используют в качестве консервантов и раскислителей, а также в бытовой химии для изготовления различных чистящих и моющих средств.
Способы получения
Также в последние годы популярностью стала пользоваться технология производства солей путем взаимодействия гидрокарбонатов и карбонатов с еще более сильными кислотами. При этом лучшая часть полученных соединений разлагается на диоксид углерода и воду. Преимуществом такой технологии является простота используемого оборудования, не требуется одновременно охлаждать растворы и повышать давление CO2, но при этом отмечается большое количество отходов. Недостатком этой технологии является то, что требуется утилизировать углеродный диоксид, который превращается в пар.
Используемые сегодня высокотехнологичные установки позволяют получать чистую кислоту угольную, в особенности при применении технологии с экстремально низкими температурами. В последующем необходимо лишь обеспечить правильное хранение кристаллов, которые при температурах выше минус 30 градусов начинают растворяться, быстро теряя все свои свойства. Также возможно производство и последующее хранение различных солей на основе этого соединения, которые сохраняют свою форму и параметры даже при положительных температурах и доступе воздуха.
Особенности применения
Угольная кислота и её соли сегодня активно используются в различных сферах жизнедеятельности человека. Они применяются в медицине, строительстве и кулинарии. Без этих микроэлементов невозможно было бы получение и возникновение следующих составов и материалов:
Также из кислоты угольной получают углекислый газ, который требуется для изготовления газированной воды. Свойства этих соединений изменять показатели давления в зависимости от содержания ионов и кислотности позволяют на их основе выпускать хладагенты для морозильников и солнечных генераторов.
Такие кислоты и соли широко используются в пищевой промышленности, они полностью безопасны для организма человека. Из нее делаются разнообразные консерванты, которые не ухудшают свойства продуктов питания, существенно продлевая их срок хранения. Это соединение используется в качестве антиокислителя, его добавляют в кофе, чай и сыры. С открытием этой кислоты появилась возможность изготавливать разнообразные шипучие напитки, в том числе минералку, Coca- Cola и даже шампанское.
В последние годы широкое распространение получила литиевая соль, которую изготавливают из этой кислоты. Она применяется для производства керамических изделий, также ее добавляют в топливо для реактивных двигателей. Сегодня это химическое соединение активно применяется в стекловарении. На его основе выполняют специальные добавки, которые повышают прочность и эксплуатационные характеристики конечного материала. Силикатное стекло, в которое была добавлена литиевая соль, отличается не только прочностью, но и великолепными показателями проницаемости светового потока.
Кислоту угольную активно используют пожарные бригады, что позволяет им эффективно бороться с огнём. В жидком виде такие соединения содержат в специальных емкостях, после чего под высоким давлением направляют в распылители, смешивая со специальными химикатами, образующими густую пену. Это позволяет не только бороться с открытым пламенем, но и быстро тушить горящую нефть и различные нефтепродукты.
Использование в сельском хозяйстве
Кислота угольная сегодня широко используется в сельском хозяйстве для производства различных качественных минеральных удобрений. Это экологически чистые компоненты, которые применяются для подкормки различных овощных, фруктовых и плодовых культур, позволяя существенно повысить показатели урожайности.
На основе кислоты угольной выполняются следующие минеральные удобрения:
Наибольшее распространение сегодня получила мочевина или как она стала сегодня называться карбамид. Это простое в использовании эффективное удобрение, которое отличается универсальностью. С одинаковым успехом его можно вносить под плодовые деревья, фрукты и овощи, различные декоративные растения.
Несомненным преимуществом таких удобрений на основе угольной кислоты является доступная стоимость минеральных составов, их простота использования, эффективность и полная экологичность.
Средняя стоимость
На сегодняшний день в России имеется несколько крупных производителей кислоты угольной, которые изготавливают как соли, так и чистые вещества. В среднем стоимость одного килограмма такого соединения составляет 3−4 тысячи рублей.
Также востребован мел, который изготавливают с использованием этой кислоты, он применяется в кормовых и технических целях. За одну тонну мела обычно просят 1200 рублей.
В редких случаях используется так называемый угольный снег, то есть кристаллы твердой формы этой кислоты. Они имеют крайне высокую стоимость, доходящую до 10000 рублей за килограмм и более. При этом необходимо обеспечить соответствующие условия хранения, в том числе поддержание температуры на уровне минус 30−35 градусов, что предупреждает его разложение. Это соединение применяется в химической промышленности, а также при производстве разнообразных продуктов питания.
Формула угольной кислоты
Определение и формула угольной кислоты
Угольная кислота в свободном виде не выделена. Она существует в разбавленном растворе при комнатной температуре в виде гидрата состава CO2×H2O, который также частично изомеризуется в H2CO3 (молекулы H2CO3 обнаружены также в газовой фазе).
Химическая формула угольной кислоты
Химическая формула угольной кислоты – H2CO3. Она показывает, что в составе молекулы этого сложного вещества находится два атома водорода (Ar = 1 а.е.м.), один атом углерода (Ar = 12 а.е.м.)и три атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу перманганата калия:
Mr(H2CO3) = 2×1 + 12 + 3×16 = 2 + 12 + 48 = 62
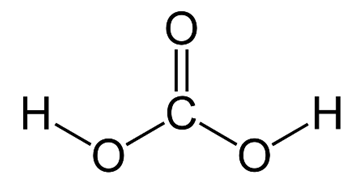
Структурная (графическая) формула угольной кислоты
Более наглядной является структурная (графическая) формула угольной кислоты. Она показывает то, как связаны атомы между собой внутри молекулы. Структурная формула угольной кислоты имеет вид:
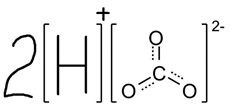
Угольная кислота способна диссоциировать на ионы в водном растворе согласно следующему уравнению:
В этой связи для угольной кислоты также можно указать и ионную формулу:
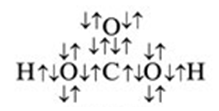
Электронные формулы
Электронные формулы, показывающие распределение электронов в атоме по энергетическим подуровням принято изображать только для отдельных химических элементов, однако для угольной кислоты можно представить и такую формулу (рис. 1.).
Рис. 1. Электронная формула угольной кислоты.
Примеры решения задач
| Задание | Установите массовую формулу вещества, содержащего 40,0% кальция, 12,0% углерода и 48,0% кислорода. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%
Обозначим количество моль элементов, входящих в состав соединения за «х» (кальций), «у» (углерод) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(Ca)/Ar(Ca) : ω(C)/Ar(C) : ω(O)/Ar(O);
x:y:z= 40,0/40 : 12,0/12 : 48,0/16;
Значит формула соединения кальция, углерода и кислорода будет иметь вид CaCO3. Это карбонат кальция.
| Задание | Установите массовую формулу вещества, содержащего 26,5% калия, 35,4% хрома и 38,1% кислорода. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%
Обозначим количество моль элементов, входящих в состав соединения за «х» (калий), «у» (хром) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(K)/Ar(K) : ω(Cr)/Ar(Cr) : ω(O)/Ar(O);
x:y:z= 26,5/39 : 35,4/52 : 38,1/16;
x:y:z= 0,7 : 0,7:2,4 = 1 : 1: 4
Значит формула соединения калия, хрома и кислорода будет иметь вид KCrO4. Это хромат калия.