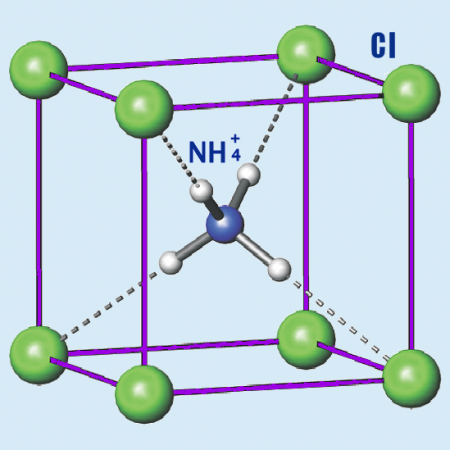
Хлористый аммоний
Хлористый аммоний
| Хлорид аммония | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорид аммония |
| Химическая формула | NH4Cl |
| Отн. молек. масса | 53,49 а. е. м. |
| Молярная масса | 53,49 г/моль |
| Физические свойства | |
| Плотность вещества | 1,527 г/см³ |
| Состояние (ст. усл.) | бесцветные кубические кристаллы |
| Термические свойства | |
| Температура плавления | возгонка при 337,6 °C |
| Энтальпия (ст. усл.) | -314,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде | (при 20 °С) 37,2 г/100 мл |
| Классификация | |
| номер CAS | [12125-02-9] |
Содержание
Свойства
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Получение
В промышленности хлорид аммония получают пропусканием оксида углерода (IV) через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают эффектной реакцией соляной кислоты с раствором аммиака. Эту реакцию проводят в приборе для получения растворимых веществ в твёрдом виде (ПРВ), так как хлорид аммония возгоняется при повышении температуры и не может быть отделён от раствора выпариванием.
Применение
Примечание
Не следует путать нашатырь (хлорид аммония) с нашатырным спиртом — гидроксидом аммония.
Полезное
Смотреть что такое «Хлористый аммоний» в других словарях:
Хлористый аммоний — или нашатырь см. Аммоний. Хлористый аммоний (сальмиак) минерал правильной системы. Кристаллы редки, обыкновенно, в виде коры, в натечных формах, в виде землистого налета. Спайность по (111) несовершенная, излом раковистый, мягок, твердость 1,5 2 … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ХЛОРИСТЫЙ АММОНИЙ — нашатырь, азотное удобрение второстепенного значения. Получается как побочный продукт при производстве роды. Содержит 24 25% азота. Более применим на черноземных почвах. Содержащийся в X. а. хлор понижает крахмалистость картофеля, ухудшает… … Сельскохозяйственный словарь-справочник
хлористый аммоний — хлорид аммония … Cловарь химических синонимов I
Хлористый аммоний (нашатырь) — см. Аммоний … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Хлористый аммоний (сальмиак) — минерал правильной системы. Кристаллы редки, обыкновенно, в виде коры, в натечных формах, в виде землистого налета. Спайность по (111) несовершенная, излом раковистый, мягок, твердость 1,5 2. Удельный вес 1,5 1,6. Бесцветен или же окрашен в… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Аммоний аммониум — Аммоний соединение 1 атома азота с 4 атомами водорода NH 4, с несомненностью до сих пор еще не полученное в свободном состоянии; существование его, однако, необходимо принять, так как есть множество тел, строение которых требует допущения… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Аммоний, аммониум — Аммоний соединение 1 атома азота с 4 атомами водорода NH4, с несомненностью до сих пор еще не полученное в свободном состоянии; существование его, однако, необходимо принять, так как есть множество тел, строение которых требует допущения… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
АММОНИЙ — АММОНИЙ, аммония, мн. нет, муж. (см. аммониак). 1. Соединение азота и водорода, не встречающееся в свободном состоянии, а лишь как составная часть сложных соединений, напр. в нашатыре (хлористый аммоний) и др. (хим.). 2. То же, что углекислый… … Толковый словарь Ушакова
АММОНИЙ — АММОНИЙ, NH4, хим. радикал, не получающийся в свободном состоянии. Впервые Ампер (1817 г.) и затем Берцелиус указали, что соединение аммиака с водой следует рассматривать как водную окись металлоподоб ного соединения, как «сложный… … Большая медицинская энциклопедия
аммоний хлористый — amonio chloridas statusas T sritis chemija formulė NH₄Cl atitikmenys: angl. ammoniac; ammonium chloride; salmiac rus. аммоний хлористый; аммония хлорид … Chemijos terminų aiškinamasis žodynas
Хлорид аммония
| Хлорид аммония | |
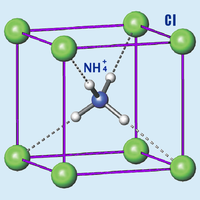 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорид аммония |
| Химическая формула | NH4Cl |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные кубические кристаллы |
| Отн. молек. масса | 53,49 а. е. м. |
| Молярная масса | 53,49 г/моль |
| Плотность | 1,527 г/см³ |
| Термические свойства | |
| Температура плавления | возгонка при 337,6 °C |
| Энтальпия образования (ст. усл.) | -314,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде | (при 20 °C) 37,2 г/100 мл |
| Классификация | |
| Рег. номер CAS | [12125-02-9] |
Хлорид аммония (хлористый аммоний, техническое название — нашатырь) NH4Cl — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Содержание
Свойства
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NH4Cl.
Иногда используют реакцию взаимодействия аммиака с хлором:
Применение
Примечание
Не следует путать нашатырь (хлорид аммония) с нашатырным спиртом — раствором аммиака в воде.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Хлорид аммония» в других словарях:
хлорид аммония — хлористый аммоний … Cловарь химических синонимов I
АММОНИЯ ХЛОРИД — (NH4Cl), аммониевая соль соляной кислоты. В прошлом его называли нашатырем. Хлорид аммония твердое тело белого цвета, отличается летучестью, высокой растворимостью; его получают путем реакции между аммиаком и хлоридом водорода. Применяется в… … Научно-технический энциклопедический словарь
АММОНИЯ СОЛИ — хим. соед., содержащие однозарядный катион аммония NН+4, напр. хлорид аммония NH4Cl, нитрат аммония NH4NН3 … Естествознание. Энциклопедический словарь
АММОНИЯ ХЛОРИД — Ammonii chloridum. Синонимы: аммоний хлористый, нашатырь, амохлор, ацидамон и др. Свойства. Белый кристаллический, слегка гигроскопический порошок, без запаха, холодящий, солоноватый на вкус; улетучивается при накаливании (NH4CL). Легко раствори … Отечественные ветеринарные препараты
Хлорид бериллия — Общие Систематическое наименование Хлорид бериллия Химическая формула BeСl2 Эмпирическая формула BeСl2 Физические свойства Состояние ( … Википедия
Хлорид магния — Хлорид магния … Википедия
Хлорид хрома(III) — Хлорид хрома(III) … Википедия
Хлорид хрома(IV) — Общие Систематическое наименование Хлорид хрома(IV) Традиционные названия Хлористый хром Химическая формула CrCl4 Физические свойства Состояние … Википедия
Хлорид аммония
наименование
Хлорид аммония (хлористый аммоний; техническое название — нашатырь; NH4Cl) — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Содержание
Физические свойства
Бесцветные или белые кубические кристаллы. Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Химические свойства
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NaCl.
Иногда используют реакцию взаимодействия аммиака с хлором:
Реакция взаимодействия аммиака и соляной кислоты:
Аммония Хлорид
Химическое название
Химические свойства
Химическая формула Хлорида Аммония: NH4Cl. Соединение также называют хлористым аммонием, нашатырем, это аммонийная соль соляной кислоты. Представляет собой белый мелкий кристаллический гигроскопический порошок, без специфического запаха, соленого привкуса. Порошок при нагревании улетучивается. Средство хорошо растворяется в горячей и холодной воде, растворимо в этаноле. Молярная масса средства = 53,5 грамм на моль.
Вещество вступает в реакцию с щелочами. Реагирует с нитритом натрия при температуре выше 100 градусов с образованием азота, воды и хлорида натрия. Разложение Хлорида Аммония происходит при пропускании через него электрического тока, в результате образуется хлористый азот. Гидролиз химического соединения происходит по катиону, в кислой среде. Молекулярное уравнение: NH4Cl + H2O ↔ NH4OH +HCl.
Качественная реакция на Хлорид Аммония. При нагревании вещество с щелочью будет выделяться аммиак. Например, во время реакции с гидроксидом натрия выделится хлорид натрия, аммиак и вода.
В промышленных масштабах средство получают путем упаривания маточного раствора, который остается после отделения NaHCO3. В лаборатории вещество получают во время реакции аммиака с хлороводородом в присутствии хлорида натрия.
Фармакологическое действие
Фармакодинамика и фармакокинетика
После приема внутрь Аммония Хлорид быстро и достаточно легко всасывается через стенки кишечника и проникает в систему воротной вены. В тканях печени метаболизируется до мочевины, при этом образуются ионы водорода и Cl, которые создают кислую среду и нейтрализуются гидрокарбонатом натрия. Происходит подкисление мочи и форсируется диурез. Мочегонный эффект сопровождается интенсивным выведением ионов калия. Во время метаболизма вещества в легочной ткани образуются активные метаболиты, обладающие противомикробным и умеренным раздражающим действием.
Средство стимулирует работу желез слизистой оболочки дыхательных путей и выведение жидкого бронхиального секрета, активизирует работу ресничного эпителия и увеличивает сократимость бронхов. Диуретический эффект напрямую зависит от работы почек и их способности нейтрализовать ионы аммония, она накопления в интерстициальной жидкости ионов хлора и водорода.
Лекарство эффективно при лечении ПМС, болезни Меньера, в рамках комплексной терапии интоксикации фенциклидином.
Показания к применению
Противопоказания
Аммония Хлорид противопоказан к приему:
Побочные действия
Вещество способно раздражать слизистую оболочку желудка, вызывать рвоту и тошноту; при частом приеме могут развиться симптомы интоксикации аммиаком, сильное потоотделение, общая слабость и бледность, аритмия, подергивание мышцами, брадикардия, вплоть до комы.
Инструкция по применению (Способ и дозировка)
Аммония Хлорид назначают внутрь. В зависимости от показаний применяют различные дозировки и схемы терапии.
Передозировка
Лекарство может вызвать дезориентацию, тяжелый метаболический ацидоз, кому, головные боли и спутанность сознания. В качестве терапии вводят щелочные растворы, лактат или гидрокарбонат натрия.
Взаимодействие
Лекарство усиливает противомикробный эффект от приема метенамина.
Особые указания
Вещество рекомендуется принимать после еды.
При беременности и лактации
Средство противопоказано к приему беременными женщинами.
Препараты, в которых содержится (Аналоги)
Торговое название средства: Хлорид Аммония.
Отзывы
Отзывов о применении лекарства очень мало. Однако резко негативные отсутствуют. Да данный момент вещество назначают не часто. Его бывает сложно купить в аптечной сети.
Цена, где купить
Купить Аммония Хлорид для не медицинского применения можно оптом по цене приблизительно 30 рублей за кг.
Образование: Окончила Ровенский государственный базовый медицинский колледж по специальности «Фармация». Окончила Винницкий государственный медицинский университет им. М.И.Пирогова и интернатуру на его базе.
Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах.