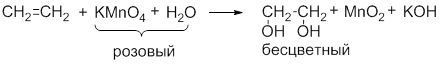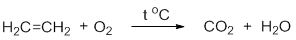Этилен (этен), получение, свойства, химические реакции
Этилен (этен), получение, свойства, химические реакции.
Этилен (этен), C2H4 – органическое вещество класса алкенов. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Этилен (этен), формула, газ, характеристики:
Химическая формула этилена C2H4, рациональная формула H2CCH2, структурная формула CH2=CH2. Изомеров не имеет.
Этилен – бесцветный газ, без вкуса, со слабым запахом. Легче воздуха.
Этилен является фитогормоном, т.е. низкомолекулярным органическим веществом, вырабатываемым растениями и имеющим регуляторные функции. Он образуется в тканях самого растения и выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов ), распускание бутонов (процесс цветения), старение и опадание листьев и цветков, участие в реакции растений на биотический и абиотический стресс, коммуникации между разными органами растений и между растениями в популяции.
Пожаро- и взрывоопасен.
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Этилен — самое производимое органическое соединение в мире.
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства этилена (этена):
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства этилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
Однако при нагревании этилена до температуры 300 o C разрыва двойной углерод-углеродной связи не происходит – реакция галогенирования протекает по механизму радикального замещения:
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется этанол.
Этилен легко окисляется. В зависимости от условий проведения реакции окисления этилена могут быть получены различные вещества: многоатомные спирты, эпоксиды или альдегиды.
В результате образуется эпоксид.
В результате образуется ацетальдегид.
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
Этилен в лабораторных условиях получается в результате следующих химических реакций:
Применение и использование этилена (этена):
Примечание: © Фото //www.pexels.com, //pixabay.com

как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена
напишите уравнение реакций этилен
Практическая работа № 3.



Практическая работа № 2.
Получение и свойства этена (этилена)
В пробирку поместите 2 мл концентрированной серной кислоты, 1 мл этилового спирта и несколько крупинок оксида алюминия (А1203) или маленький кусочек пемзы для равномерного кипения смеси при нагревании. Закройте пробирку пробкой с газоотводной трубкой и нагрейте пробирку в пламени горелки. Выделяющийся газ пропустите в отдельные пробирки с бромной водой и раствором перманганата калия. Убедитесь в том, что бромная вода и раствор перманганата калия быстро обесцвечиваются. Подожгите газ у конца газоотводной трубки. Отметьте цвет пламени.
1. Чем отличаются реакции горения этена и этана?
2. Как получают этен в лаборатории и промышленности? Напишите уравнения реакции.
3. Почему этен обесцвечивает растворы бромной воды и перманганата калия? Напишите уравнения соответствующих реакций.
1. При сжигании этана расходуется больше кислорода (как считая на вес, так и на моль).
горение этилена (этена):C2H4+ 3O2 → 2CO2 + 2H2O ;горение этана:2C2H6 + 7O2 → 4CO2 + 6H2O. Отличия в горении следующие: Этен горит ярко светящимся пламенем, а этан почти бесцветным. И причина светящегося пламени этена (в отличие от этана) – большая массовая доля углерода.
2. В промышленности-при переработке нефти.
В лаборатории— нагреванием этанола (этилового спирта) с серной кислотой.
В промышленности: 2СН4=(температура 100 град)=С2Н4+2Н2
В лаборатории: С2Н2+Н2=С2Н4
С2Н5ОН=(температура, конц серная кислота)=С2Н4+Н2О
С2Н4Cl2+Zn=ZnCl2+C2H4
C4H9Cl+KOH(Спирт.р-р)=KCl+H2O+C4H8
Свойства бензола.
Ход работы:В две пробирки налейте по 5—6 капель бензола. В одну из них добавьте 1—2 мл бромной воды, а в другую — 1—2 мл раствора перманганата калия. Встряхните обе пробирки. Отметьте наблюдения.
1. Почему растворы бромной воды и перманганата калия не обесцвечиваются при добавлении бензола?
2. Почему в пробирке с бромной водой при добавлении бензола желтая окраска перешла в верхний бензольный слой, а в пробирке с перманганатом калия окрашенным остался нижний водный слой?
1. Потому что бензол обладает весьма прочной энергетически выгодной структурой, и крайне неохотно вступает в химические реакции, в частности не реагирует с бромной водой и перманганатом калия.
2. Из бромной воды бром переходит в верхний слой бензола и окрашивает его. Растворимость брома в бензоле больше, чем растворимость брома в воде. При данных условиях бром не вступает в реакцию с бензолом. Во вторую пробирку с бензолом прильем раствор перманганата калия. Здесь мы также не замечаем протекания химической реакции. Бензол не дает реакций, характерных для непредельных углеводородов. Бензол не присоединяет бром и не окисляется раствором перманганата калия.
Практическая работа № 3.
Растворимость спиртов в воде
В отдельные пробирки прилейте по 1—2 мл этилового и изоамилового (изопентилового) спиртов. Добавьте к ним по 2—3 мл воды и взболтайте. Отметьте, что этиловый спирт полностью растворился в воде, а изоамиловый спирт отделяется при отстаивании в виде маслянистого слоя над водой.
1. В чем причина различного «поведения» спиртов в воде?
2. Почему изоамиловый спирт отслаивается над водой, а не наоборот?
3. Какие органические жидкие вещества при смешивании с водой будут отслаиваться над водой?
Получение глицерата меди
К полученному осадку добавьте по каплям глицерин. Взболтайте смесь. Отметьте превращение голубого осадка в раствор темно-синего цвета.

1. Какая реакция лежит в основе получения гидроксида меди(П)? Напишите уравнение этой реакции.
2. Почему при добавлении глицерина к осадку гидроксида меди(П) осадок растворяется? С чем связано интенсивное окрашивание раствора? Напишите уравнение реакции взаимодействия глицерина с гидроксидом меди(П).
3. Будут ли этиловый и изоамиловый спирты реагировать с гидроксидом меди(П)?
Окисление этилового спирта хромовой смесью
1. Почему цвет раствора меняется с оранжевого до синевато-зеленого? Напишите уравнение реакции окисления этилового спирта.
2. Можно ли заменить серную кислоту в данной реакции на соляную?
Практическая работа № 4. Альдегиды и кетоны
Реакция «серебряного зеркала»
В пробирку, содержащую 1 мл формалина (водный раствор формальдегида), прибавьте несколько капель аммиачного раствора оксида серебра. Пробирку слегка нагрейте на газовой горелке.
1. Что наблюдается в пробирке?
2. Почему поверхность стекла становится зеркальной?
3. Напишите уравнение реакции.
Окисление бензальдегида кислородом воздуха
Каплю бензальдегида поместите на часовое стекло и оставьте на воздухе. Через 15—30 мин отметьте образование белых кристаллов по краям капли.
Какое соединение образуется в результате взаимодействия бензальдегида с кислородом воздуха? Напишите уравнение реакции.
Получение ацетона из ацетата натрия
В сухую пробирку, снабженную газоотводной трубкой, поместите около 0,1 г безводного (прокаленного) ацетата натрия и закрепите ее в штативе горизонтально. Нижний конец газоотводной трубки опустите в пробирку с водой. Сначала наблюдается плавление ацетата натрия, затем вспучивание соли и выделение паров ацетона, который концентрируется в пробирке с водой. Через несколько секунд реакция прекращается. В пробирке с водой ощущается характерный запах ацетона. После того как пробирка с ацетатом натрия остынет, добавьте в нее 1 каплю концентрированной соляной кислоты. Отметьте наблюдаемое явление.
1. С помощью какой реакции вы получили ацетон? Запишите ее уравнение.
2. Что наблюдается при добавлении соляной кислоты в колбу с реакционной смесью? Какой газ выделяется? Напишите уравнение реакции.
Как получают этилен в промышленности в лаборатории напишите уравнение реакции
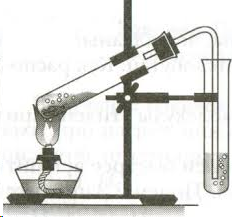
Получение этилена и опыты с ним
Реактивы: этанол, серная кислота, бромная вода, раствор перманганата калия, речной песок.
Оборудование: штатив, спиртовка, пробирка с газоотводной трубкой, штатив с пробирками, фильтровальная бумага или вата, спички.
Схема установки:
Проведение эксперимента
В пробирку налейте 3 мл этанола и осторожно добавьте и 9 мл серной кислоты. Затем добавьте немного сухого речного песка (на кончике чайной ложки). Песок обеспечит ровное кипение жидкости, без толчков и выбросов. Вставьте в пробирку пробку с изогнутой газоотводной трубкой. Приготовьте ещё две пробирки: в первую налейте 2-3 мл разбавленного раствора перманганата калия (розовый цвет), во вторую 2-3 мл раствора брома в воде (желто-коричневый цвет). Для получения этилена пробирку с этанолом и серной кислотой осторожно нагрейте в пламени спиртовки. Продолжая нагревание, опустите конец газоотводной трубки в пробирку с перманганатом калия (трубка должна находиться ниже уровня раствора). Пропускайте этилен до полного исчезновения розовой окраски. Смените пробирку и пропустите этилен через раствор бромной воды до полного обесцвечивания раствора брома. Уберите пробирку с обесцвеченным раствором. Протрите конец газоотводной трубки ватой или фильтровальной бумагой, поверните трубку вверх и подожгите выделяющийся газ. Обратите внимание на цвет пламени.
Реакция дегидратации этанола:
Обесцвечивание раствора Br2:
Исчезает окраска брома и образуется 1,2-дибромэтан.
Обесцвечивание водного раствора KMnO4 (без нагревания):
Исчезает окраска перманганата калия и образуется 1,2-этандиол (этиленгликоль).
Получение пропилена и опыты с ним
Пропилен получают аналогично этилену.
В пробирку помещают 3-4 мл изопропилового спирта и 9-12 мл серной кислоты. Осторожно нагревают. Выделяющийся газ пропускают через растворы бромной воды и перманганата калия, наблюдают исчезновение окраски растворов. Поджигают газ у конца газоотводной трубки.
Обесцвечивание раствора Br2:
Исчезает окраска брома и образуется 1,2-дибромпропан.
Обесцвечивание водного раствора KMnO4 (без нагревания):
Исчезает окраска перманганата калия и образуется 1,2-пропандиол (пропиленгликоль).
Как получают этилен в промышленности в лаборатории
Этилен (этен), получение, свойства, химические реакции
Этилен (этен), C2H4 – органическое вещество класса алкенов. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Этилен (этен), формула, газ, характеристики
Физические свойства этилена (этена)
Химические свойства этилена (этена)
Получение этилена (этена)
Химические реакции – уравнения получения этилена (этена)
Применение и использование этилена (этена)
Этилен (этен), формула, газ, характеристики:
Этилен (этен) – органическое вещество класса алкенов, состоящий из двух атомов углерода и четырех атомов водорода. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Химическая формула этилена C2H4, рациональная формула H2CCH2, структурная формула CH2=CH2. Изомеров не имеет.
Этилен – бесцветный газ, без вкуса, со слабым запахом. Легче воздуха.
Этилен является фитогормоном, т.е. низкомолекулярным органическим веществом, вырабатываемым растениями и имеющим регуляторные функции.
Он образуется в тканях самого растения и выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов), распускание бутонов (процесс цветения), старение и опадание листьев и цветков, участие в реакции растений на биотический и абиотический стресс, коммуникации между разными органами растений и между растениями в популяции.
Пожаро- и взрывоопасен.
Плохо растворяется в воде. Зато хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Этилен — самое производимое органическое соединение в мире.
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства этилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
CH2=CH2 + H2 → CH3-CH3 (kat = Ni, Pd, Pt, to).
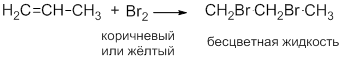
Однако при нагревании этилена до температуры 300 oC разрыва двойной углерод-углеродной связи не происходит – реакция галогенирования протекает по механизму радикального замещения:
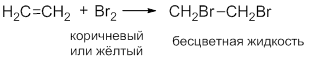
CH2=CH2 + Br2 → CH2=CH-Br + HBr (t = 300 oC).
CH2=CH2 + HBr → CH3-CH2Br.
CH2=CH2 + H2O → CH3-CH2ОН (H+, to).
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется этанол.
Этилен легко окисляется. В зависимости от условий проведения реакции окисления этилена могут быть получены различные вещества: многоатомные спирты, эпоксиды или альдегиды.
2CH2=CH2 + O2 → 2C2OH4 (kat = Ag, to).
В результате образуется эпоксид.
2CH2=CH2 + O2 → 2CH3-C(O)H (kat = PdCl2, CuCl, t = 200oС ).
В результате образуется ацетальдегид.
CH2=CH2 + 3O2 → 2CO2 + 2H2O.
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и вода.
nCH2=CH2 → (-CH2-CH2-)n (kat, to).
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
CH3-CH3 → CH2=CH2 + H2 (kat = Pt, Ni, Al2O3, Cr2O3, to = 400-600 °C).
Этилен в лабораторных условиях получается в результате следующих химических реакций:
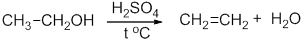
CH3-CH2-OH → CH2=CH2 + H2O (H2SO4 (conc), to = 170).
CH3-CH2-Br + NaOH → CH2=CH2 + NaBr + H2O (to);
Cl-CH2-CH2-Cl + Zn → CH2=CH2 + ZnCl2.
Cl-CH2-CH2-Cl + Mg → CH2=CH2 + MgCl2.
CH≡CH + H2 → CH2=CH2 (Pd, to).
CH3-CH2-Br + KOH → CH2 = CH2 + KBr + H2O.
Применение и использование этилена (этена):
– как сырье в химической промышленности для органического синтеза различных органических соединений: галогенпроизводных, спиртов (этанола, этиленгликоля), винилацетата, дихлорэтан, винилхлорида, окиси этилена, полиэтилена, стирола, уксусной кислоты, этилбензола, этиленгликоля и пр.,
– в производстве полимеров.
Примечание: Фото //www.pexels.com, //pixabay.com
карта сайта
как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена
напишите уравнение реакций этилен
Этилен: свойства и все характеристики
Представляет собой бесцветный горючий газ (строение молекулы показано на рис. 1), который обладает слабым запахом. Плохо растворяется в воде, но хорошо в диэтиловом эфире и углеводородах.
Рис. 1. Строение молекулы этилена.
Таблица 1. Физические свойства этилена.
| Молекулярная формула | CH2=CH2 (C2H4) |
| Молярная масса, г/моль | 28 |
| Плотность, г/см3 | 0,001178 |
| Температура плавления, oС | -169,2 |
| Температура кипения, oС | -103,7 |
Получение этилена
Способы получения этилена можно разделить на промышленные и лабораторные. В первом случае этен – это продуктдегидрирования этана, полученного при крекинге нефти.
В лабораторных условиях этилен можно получить при помощи дегидратации этанола (1), дегалогенированиямоно- и дигалогенпроизводных этана (2, 3) или при неполном гидрировании ацетилена (4):
CH3-CH2-OH→CH2=CH2 + H2O (H2SO4 (conc), to = 170) (1);
CH3-CH2-Br + NaOHalcohol→CH2=CH2 + NaBr + H2O (to) (2);
Cl-CH2-CH2-Cl + Zn(Mg) →CH2=CH2 + ZnCl2(MgCl2) (3);
CH≡CH + H2→CH2=CH2 (Pd, to) (4).
Химические свойства этилена
Этилен способен присоединять водород (гидрирование) (5), галогены (галогенирование) (6), галогеноводороды (гидрогалогенирование) (7) и воду (гидратация) (8):
CH2=CH2 + H2→ CH3-CH3 (kat = Pt) (5);
CH2=CH2 + Br2→BrCH-CHBr (6);
CH2=CH2 + H-Cl → H2C-CHCl (7);
CH2=CH2 + H-OH → CH3-CH2-OH (H+, to) (8).
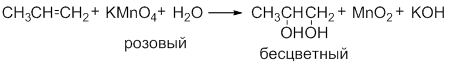
В зависимости от условий проведения реакции окисления этилена могут быть получены многоатомные спирты (9), эпоксиды (10) или альдегиды (11):
CH2=CH2 + 2KMnO4 + 2KOH → HO-CH2-CH2-OH + 2K2MnO4 (9);
2CH2=CH2 + O2 → 2C2OH4 (эпоксид) (kat = Ag,to) (10);
2CH2=CH2 + O2 → 2CH3-C(O)H (kat = PdCl2, CuCl) (11).
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и воды:
C2H4 + 2O2→ 2CO2 + 2H2O.
Этилен подвергается полимеризации:
Кроме этого, если проводить галогенирование этилена при температуре 400oС, то разрыва двойной связи происходить не будет, будет замещаться один атом водорода в углеводородном радикале:
CH2=CH2 + Cl2→ CH2=CH-Cl + HCl.
Применение этилена
Основное направление использование этилена — промышленный органический синтез таких соединений как галогенопроизводные, спирты (этанол, этиленгликоль), уксусный альдегид, уксусная кислота и др. Кроме этого данное соединение в производстве полимеров.
Примеры решения задач
Альтернативные методы получения этилена
А.И. Абсаттаров, Н.И. Зеленцова (ООО «ВНИИОС-наука»), Ю.А. Писаренко (МТУ).
в журнале Химическая техника №11/2016
В последнее время все чаще стал возникать вопрос о малотоннажных установках производства этилена.
Зачастую это связано с потребностью в обеспечении сырьем производств сопоплимеров. Большая удаленность потребителей и производств этилена друг от друга, сложности при транспортировке этилена все чаще заставляют большие компании задумываться об самостоятельных установках получения этилена.
Наличие вышеуказанных продуктов требует их дальнейшей переработки, реализации, или утилизации. Выделение этилена полимеризационной чистоты из такой смеси продуктов требует высоких эксплуатационных и капитальных затрат.
Для предприятий, нуждающихся исключительно в небольших количествах этилена и не имеющих потребности в побочных продуктах пиролиза (такие как производства полимеров/сополимеров) строительство установки пиролиза углеводородного сырья может быть крайне невыгодно по следующим причинам:
Спрос на этилен со стороны производств сополимеров гарантирует переработку этилена в более дорогие продукты. Переработка дешевого сырья в этилен и впоследствии в сополимеры в рамках одного промышленного комплекса позволит достичь наименьших значений себестоимости товарной продукции, и, следовательно, высокой прибыли от ее реализации.
Рис. 1. Способы получения и использования этилена в промышленности
В связи с вышеуказанными причинами все чаще в качестве способов малотоннажного производства этилена рассматриваются альтернативные методы получения этилена.
Среди таких методов: выделение этилена из отходящих газов каталитического крекинга (при наличии поблизости НПЗ, эксплуатирующего каталитический крекинг), окислительное дегидрирование этана, окислительная димеризация метана, получение этилена из низших спиртов – этанола и метанола (рис. 1).
ООО «ВНИИОС-наука» уже много лет работает в области промышленного производства этилена, пропилена и других продуктов нефтехимии.
Компания участвует в модернизациях и разработках технологий различных методов получения этилена: как основного способа получения этилена – пиролиза, так и альтернативных методов получения этилена, в том числе выделение этилена из отходящих газов каталитического крекинга, окислительное дегидрирование этана, окислительная димеризация метана, получение этилена из этанола. По данным процессам имеются патенты и готовые разработки.
Цели разработки альтернативных методов получения этилена
В данной статье более подробно остановимся на двух альтернативных методах получения этилена: окислительном дегидрировании этана и дегидратации биоэтанола. С учетом указанных недостатков пиролиза в условиях низкой производительности, требования к данным альтернативным процессам очевидны:
Окислительное дегидрирование этана
Реакция окислительного дегидрирования этана (ОДЭ) производится по следующей формуле:
C2H6 + 1/2O2 = C2H4 + H2O (1)
В качестве окислителя может применяться как концентрированный кислород, так и кислород в составе воздуха. Последние опыты по окислительному дегидрированию этана показали следующие результаты (в качестве окислителя применялся кислород с концентрацией 99,5 %):
С использованием полученных данных была разработана схема выделения этилена из контактного газа окислительного дегидрирования этана, основанная на абсорбционном методе извлечении этан-этиленовой фракции. Принципиальная схема получения этилена путем ОДЭ представлена на рис. 2.
Рис. 2. Технология получения этилена методом ОДЭ
Схема включает реакционный узел Р-1, узел водной отмывки К-1, стадию предварительного удаления СО2 путем аминовой хемосорбции К-2, компримирования М-1, осушку С-1, колонны абсорбции и десорбции ЭЭФ (соответственно К-3 и К-4), колонну выделения товарного этилена К-5.
Разработанная технология является достаточно гибкой, чтобы проводить окислительное дегидрирование как концентрированным кислородом, так и кислородом воздуха или какой-либо промежуточной смесью воздухкислород. Для любого случая в зависимости от применяемого окислителя в представленной технологии решена проблема образования взрывоопасных смесей кислород-углеводороды-монооксид углерода, что делает технологию простой и безопасной.
Кроме того, гибкость технологии позволяет использовать различные катализаторы окислительного дегидрирования этана, т.е. при появлении новых катализаторов, являющихся по тем или иным характеристикам лучше ныне существующих, их также можно применять в данной технологической схеме.
Благодаря разработанной технологии, а также применению абсорбционной технологии выделения ЭЭФ из контактного газа, исключающей использование хладагентов с температурой ниже минус 37 °С, удалось достичь приемлемых для промышленной установки показателей эксплуатационных параметров. При моделировании технологии были получены следующие результаты:
Расходный коэффициент по сырью, т этана/т этилена 1,29
Расход электроэнергии, МВт⋅ч/т этилена 0,60
Степень извлечения этилена, % 98,5
Моделирование технологии ОДЭ с применением концентрированного кислорода показало значительно более низкие эксплуатационные затраты по сравнению с пиролизом этана (в качестве примера: потребление электроэнергии составляет соответственно 0,6 и 1,0).
Кроме того, технология ОДЭ имеет значительно более простую схему выделения этилена: отсутствуют узлы каталитического удаления ацетилена, низкотемпературного (до минус 100 °С) удаления метана и водорода и другие. В связи с этим данный способ получения этилена претендует на получение высоких результатов при дальнейших более подробных оценках экономической целесообразности реализации данного проекта.
Дегидратация биоэтанола
Реакция дегидратации этанола производится по следующей формуле:
C2H5OH = C2H4 + H20 (2)
Последние опыты по окислительному дегидрированию этилена показали следующие результаты:
Таким образом, была разработана технология выделения этилена из реакционных газов, принципиальная схема технологии представлена на рис. 3.
Рис. 3. Принципиальная схема технологии выделения этилена из реакционных газов дегидратации биоэтанола
Схема включает узел конденсации реакционной воды Т-1, предварительную осушку С-1, узел удаления кислородсодержащих примесей А-1, компримирования М-1, колонну выделения товарного этилена К-1 и стадию доочистки этилена от остаточных примесей А-2.
Благодаря высокой селективности процесса, а также отсутствию стадии удаления «легких» компонентов, технология выделения этилена из реакционных газов дегидратации биоэтанола при моделировании показала весьма привлекательные коэффициенты эксплуатационных параметров. Например, потребление электроэнергии составило 0,35 МВт/т. этилена.
Учитывая простоту разделения газов дегидратации биоэтанола, низкий расходный коэффициент по сырью, а также низкие эксплуатационное параметры, можно сделать следующие выводы:
В РФ имеется большой потенциал для производства биоэтанола как для нужд нефтехимии, так и для использования в качестве присадок к жидкому топливу, однако из-за акцизной политики государства биоэтанол не может быть реализован как продукт, так как это повлечет за собой высокую себестоимость биоэтанола ввиду попадания под акциз (доля акциза достигает значений до 90 %).
Данный фактор затрудняет возможность использования биоэтанола в качестве сырья для получения этилена, так как требует реализацию такого процесса в рамках предприятия, также производящего биоэтанол, что влечет за собой дополнительные трудности, связанные с различной спецификой аграрных и нефтехимических производств.
Выводы
Разработанные технологии получения этилена позволяют достичь выгодных эксплуатационных параметров при достаточно простом конструктивном оформлении, являются гибкими и безопасными при эксплуатации.
ООО «ВНИИОС-наука» может провести работы как по описанным в статье процессам, так и по другим альтернативным методам получения этилена: выделение этилена из сухого газа, окислительная димеризация метана.
Проводится весь цикл работ по разработке и реализации технологии до этапа пуска установки.
Как отличить этиловый спирт от метилового в домашних условиях
В середине декабря 2020 года в Иркутской области произошло самое крупное в постсоветской истории отравление метилгидратом. Жертвами трагедии стали более 70 человек, а само событие произвело крупный международный резонанс. В связи со случившимся сильно возрос интерес к тому, как отличить метиловый спирт от этилового в обычных условиях.
Этиловый
Этиловый спирт представляет собой бесцветную прозрачную жидкость. Он обладает характерным слабым запахом и ярко выраженным жгучим вкусом,
Чистый этиловый спирт, который применяют в химической отрасли, отличается нейтральными реакциями. А вот тот этанол, который используется в пищевой промышленности, смешивается с дополнительными элементами и поэтому обладает слабой реакцией.
Этил с нормальным давлением закипает при нагревании до 78,3 градусов. Стоит отметить, что с повышением температуры жидкости её плотность уменьшается.
При приеме небольшого количества жидкости человек ощущает легкое опьянение, а вот при приеме большого количества этанола состояние организма сходно с наркозом.
Запах спирта также опасен для живого организма. Показатели допустимой нормы не должны превышать 1000мг/м3. Опасная токсическая концентрация – свыше 1600 мг\м3. Запах спирта в помещении ощущается при концентрации в 250 мг/м3.
Этанол соединяют с водой в любых пропорциях:
Этанол легко воспламеняется и горит светло-голубым пламенем. При распаде продукта выделяется углекислый газ и вода.
Получить этанол можно и в домашних условиях. Для этого используют специальный самогонный аппарат.
При длительном употреблении продуктов, содержащих спирт, возникает алкогольная зависимость
Поэтому употреблять спиртосодержащие напитки нужно с особой осторожностью
Что такое этанол и как получить его в домашних условиях рассказывается на видео:
Метиловый
Жидкость является представителем простейших одноатомных спиртов.
В различных источниках продукт именуют по-разному:
Метанол – это бесцветная жидкость, которая по запаху схожа с этиловым спиртом. При смешивании с водой может расширяться или сжиматься.
Жидкость зарекомендовала себя в качестве хорошего растворителя, поэтому ею нередко заменяют этиловый спирт.
Аромат у метила очень слабо выражен, ощутить его возможно только при “принюхивании”.
Этиловый спирт: можно ли пить, вред и последствия
Химическое название вещества – этанол, формула – С2Н5(ОН). В обычных условиях находится в жидком состоянии. Закипает при температуре 8 градусов, а замерзает при –114 градусах. Легко смешивается с водой, глицерином, некоторыми маслами, бензолом. Вещество летучее и огнеопасное, поэтому хранить его нужно в плотно закрытых емкостях вдали от источников возгорания.
Этанол хорошо растворяет другие вещества. Он способен коагулировать белок, поэтому легко убивает большинство патогенных микроорганизмов. Обладает психотропными свойствами. В высоких дозах очень токсичен.
В зависимости от содержащихся примесей этиловый спирт может быть ректифицированным или денатурированным. В первом случае вещество проходит специальную очистку и не имеет посторонних ингредиентов. Второй вид этанола содержит примеси, которые делают его непригодным для питья, но позволяют использовать в технических целях.
Средство применяется во многих отраслях:
В пищевой промышленности этанол применяется для изготовления алкогольных напитков. С этой целью используется специально очищенный пищевой спирт. Мизерные количества обнаруживаются в напитках, полученных брожением – кумысе, квасе, кефире и пр.
Оба вещества в обычных условиях выглядят как прозрачная бесцветная жидкость. Чтобы отличить метанол от этанола, можно провести несколько несложных тестов.
Наливают немного спирта в любую емкость и поджигают. Если нет подходящей посуды, смачивают в растворе ватную палочку и подносят к пламени. Этиловый спирт горит ярким синим огнем, а метиловый – зеленым.
Более простой и безопасный способ – проба с картофелем. Средний корнеплод чистят, моют и разрезают пополам. Кусочки овоща кладут в банку со спиртом на 3–5 часов. По истечении этого времени этанол не изменит своего цвета, а метанол приобретет розовую окраску.
В сосуд с жидкостью можно добавить немного пищевой соды. В смеси с этанолом порошок пожелтеет и выпадет в осадок. Метиловый спирт полностью растворяет соду. Кроме того, можно провести пробу с марганцовкой. Если несколько крупинок бросить в этиловый спирт, никаких изменений не произойдет. В соединении с метанолом перманганат калия будет пузыриться и шипеть.
Если есть промышленный термометр, можно измерить температуру кипения жидкостей. Для этанола она составит 80 градусов, а для метанола – 60 градусов.
Можно ли пить медицинский спирт?
Спирт, применяемый в медицинских целях, допускается употреблять внутрь в минимальных количествах. Его используют для создания лекарственных настоек. Однако если пить его в неразбавленном виде, вещество может сильно навредить здоровью. Этанол оказывает влияние на все органы и системы человека:
Препарат с концентрацией 96% для наружного применения оказывает раздражающее, вяжущее и дубящее действия. Этиловый спирт 70 % обладает выраженным антибактериальным эффектом.
Пить этанол 95–96% крепости в чистом виде опасно для здоровья. Максимально допустимая концентрация при употреблении внутрь – 40%.
Как безопасно пить: виды напитков
В мире насчитывается более 100 видов напитков, содержащих алкоголь. Все они различны по вкусу и крепости. Получать их можно с помощью брожения или дистилляции. В роли компонентов для приготовления выступают фрукты, ягоды или злаковые культуры.
По крепости все напитки делятся на 3 вида:
К категории слабых относятся напитки, крепость которых не превышает 8 процентов. В эту группу входят пиво, сидр, некоторые национальные напитки – перри, айсвайн, ханди и пр. В домашних условиях готовят брагу – она получается в результате брожения овощей или фруктов.
Слабоалкогольные напитки легко усваиваются организмом. В малых дозах пить их относительно безопасно. Однако чрезмерное количество может вызвать тяжелое отравление и похмельный синдром.
К напиткам средней крепости относятся те, которые содержат от 9 до 30 % этанола. В эту группу входят разные виды фруктовых и ягодных вин с добавлением специй – портвейн, мадера, херес, токай, вермут и пр. Оптимальная концентрация спирта в таких напитках – 20 %. Эти алкогольные продукты опасны для здоровья в больших количествах. В домашних условиях готовят вина, настойки, ликеры.
Крепкими считаются продукты с содержанием этанола от 30 до 80 %. К ним относятся водка, коньяк, ром, бренди, джин, текила и некоторые другие.
Российскими медиками были проведены исследования допустимой нормы алкоголя. Согласно полученным результатам, для мужчин безопасным количеством считаются 50 мл водки в сутки, или 250 мл вина, или 500 мл пива. Для женщин разрешенной мерой являются 30 мл водки, 150 мл вина или 330 мл пива. Разумеется, выпить эту дозу без вреда для здоровья можно не чаще 1–2 раз в неделю.
Вред и последствия
Употребление этилового спирта в больших количествах наносит вред организму:
Смертельной дозой чистого этанола считаются 300 мл. Данные рассчитаны для непьющего мужчины массой тела около 70 кг. Суррогатов алкоголя достаточно выпить гораздо меньше – всего 100–150 мл.
Таблица: Летальная доза разных видов спиртных напитков
| Вид напитка | Количество в мл, выпитое за 3–5 часов |
| пиво | 6000 мл |
| Вино 20 % крепости | 2300 мл |
| водка | 750 мл |
| текила | 545 мл |
| абсент | 430 мл |
Другие виды спиртосодержащих препаратов
В аптеках продаются и другие виды медицинского спирта. Они предназначены для наружного применения. Многих потребителей интересует, можно ли пить спиртное на основе этих препаратов. Последствия зависят от того, какое вещество добавлено к этанолу. Наиболее распространены следующие виды медицинских спиртов:
5 Технологий пищевой промышленности будущего, которые применяются уже сегодня | Портал о системах видеонаблюдения и безопасности
Технология преобразила практически все, что нас окружает, но когда речь заходит о пищевых продуктах, то там тоже происходят значительные изменения. Технологии пищевой промышленности будущего – это интеллектуальные решения, позволяющие достичь большей экономии и сократить отходы при приготовлении пищи.
От 3D-принтеров до безмясных “гамбургеров” – существует множество идей, которые предлагают потребителям больше возможностей. Некоторые из этих технологий уже используются в жизни, а другие все еще находятся в зачаточном состоянии и проходят испытания в лабораторных тестах.
Стоит познакомимся с некоторыми из них.
1. 3D принтеры для печати пищевых продуктов
Да, вы не ошиблись. Существует несколько моделей 3D принтеров, способных печатать продукты питания в буквальном смысле этого слова. Как видите, технологии были адаптированы и для гастрономического сектора. Еда получается не только эстетически красивая и аппетитная, но и очень вкусная. Уже сегодня на принтере можно напечатать макароны, шоколад и некоторые приправы. Единственным минусом является то, что пока такие принтеры стоят запредельно дорого, как и изготовленный на них продукт.
2. Искусственное мясо, произведенное в лаборатории
Возможно ли существование мяса не животного происхождения? До недавнего времени ответом на этот вопрос было “нет”. Однако, ученные, обеспокоенные проблемами окружающей среды и благополучии животных, начали заниматься поиском альтернативы.
Из стволовых клеток животных, ученые смогли создать искусственное мясо со сходной текстурой, вкусом и питательными свойствами, как у натурального продукта.
Конечно, затраты на его производство еще очень высоки, но вполне вероятно, что в ближайшие два года искусственное мясо появится на рынке и будет доступно по цене.
3. Съедобные бутылки с водой
Одной из больших проблем, стоящих перед окружающей средой – это нескончаемое образование отходов жизнедеятельности человека. Ситуация выглядит еще хуже, когда речь заходит о пластиковых бутылках, которые разлагаются сотни лет. Решение было найдено ученными из Лондона.
Оно заключается в создании съедобных бутылок, изготовленных из морских водорослей. Такая тара имеет огромное преимущество в том, что ее производство выходит намного дешевле, чем пластиковая.
Вы когда-нибудь думали о том, чтобы съесть бутылку после того, как закончите пить?
4. Искусственная рыба
В лаборатории можно выращивать не только мясо, но и рыбу. За последнее десятилетие ученым удалось разработать искусственное рыбное филе. Те, кто пробовал, заявляют, что его практически невозможно отличить от вкуса настоящей рыбы. Эти эксперименты были проведены компанией “New Wave Foods”, в результате которых также была получена искусственная креветка, изготовленная из морских водорослей. Имитация текстуры и вкуса омара и краба – это следующие цели компании.
5. ДНК-диета
Вы, конечно, задавались вопросом, почему некоторые диеты работают для одних людей, а для других – нет. Ответ прост: потому что каждый человек уникален. Основываясь на этом ответе, ученые начали изучать диеты для каждого типа ДНК.
Идея заключается в том, чтобы использовать секвенирование ДНК для понимания уникальных характеристик пациента и, исходя из этого, предложить ему пищу и питательные вещества в точном количестве, чтобы он мог достичь своих целей.
Ожидается, что когда-нибудь эти диеты будут способны сделать тело человека совершенным, но пока это только многообещающая инициатива.