Таргетная терапия в лечении рака
Для лечения рака применяют разные методы, один из них — таргетная терапия.
Вокруг такой терапии много заблуждений, которые в основном связаны с ее высокой эффективностью и меньшим токсическим влиянием на здоровые органы и ткани.
В этой статье разбираемся, что такое таргетная терапия, как она работает и почему подходит не всем.
Содержание
Что такое таргетная терапия и как она работает
Таргетная терапия — точно направленный метод лечения. То есть средства, используемые для таргетной терапии, знают свою мишень (target) и «бьют» точно по ней, не повреждая другие ткани.
Таргетная терапия в онкологии — лечение с помощью лекарственных препаратов, которые нацелены на специфические особенности или молекулярные механизмы клеток опухолей и могут остановить рост и распространение рака.
Мишенями таргетных препаратов выступают определенные белки или гены.
Таргетная терапия может использоваться как самостоятельный метод лечения рака или в сочетании с другими методами, такими как химиотерапия, хирургическое лечение или лучевая терапия.
Есть определенные виды рака, при которых таргетная терапия работает лучше, чем другие методы лечения (рак молочной и предстательной железы, толстой кишки, легких и др.). А для некоторых типов рака в клинической практике используют в основном химиотерапию. Например, для лечения нейробластомы или хориокарциномы матки.
Но знание молекулярного профиля опухоли может помочь врачу выбрать препарат для таргетной терапии не по показаниям, так называемые off-label-назначения.
Off-label (офф-лэйбл) — это назначение препаратов «не по инструкции». То есть выбранные лекарства не входят в стандарты лечения заболевания, но практика, а также данные статистики показывают их эффективность.
Со временем клинические рекомендации и протоколы лечения могут изменить, а в инструкцию по применению внести дополнительные пункты, но пока этого не случилось препарат назначают офф-лэйбл.
В чем отличие таргетной терапии от химиотерапии?
Основное отличие — механизм действия. Препараты для химиотерапии действуют на все быстро делящиеся клетки. Их цель — остановить процесс деления клеток, причем не только злокачественных. Например, попадая в организм они будут «бить» по здоровым клеткам крови или слизистых оболочек.
Именно с этим связаны и основные побочные эффекты:
Таргетная терапия — это, так называемый следующий этап развития химиотерапии. Препараты, используемые для таргетной терапии, работают прицельно, практически не повреждая другие клетки.
Типы таргетной терапии
По химической структуре препараты для таргетной терапии делят на две большие группы: малые молекулы и крупные молекулы (моноклональные антитела).
Малые молекулы имеют небольшой размер и могут проникать внутрь клетки, где точечно воздействуют на определенную «мишень». Крупные молекулы не могут действовать изнутри, поэтому взаимодействуют с рецепторами на поверхности опухолевой клетки.
Моноклональные антитела — это молекулы натурального происхождения, которые получают, используя кровь лабораторных животных или человека. Такие препараты, как правило, вводятся внутривенно.
Малые молекулы — вещества, синтезированные химически, без использования живых организмов. Эти препараты блокируют внутриклеточные части рецепторов факторов роста и белки, которые дают сигнал к клеточному делению, или нарушают синтез этих белков. Такие препараты человек принимает внутрь в виде таблеток.
Кроме этого, таргетные препараты подразделяются на несколько групп по механизму действия:

Как генетика влияет на риск заболеть раком что с этим делать?
Это наиболее распространенная группа препаратов, используемых для таргетной терапии. Они блокируют сигналы, передаваемые через специфические трансмембранные рецепторы (например, EGFR или HER2), внутрь опухолевой клетки. Функция таких рецепторов — регуляция роста и размножения клеток. Блокируя пути проведения сигнала, препараты останавливают рост злокачественных клеток.
Киназы — это ферменты (белки), которые влияют на транспорт веществ внутри клетки. Препараты этой группы препятствуют проведению сигнала от рецептора на поверхности клетки дальше по сигнальным путям, участвующим в росте и развитии клеток. И, таким образом, тормозят рост опухоли.
Апоптоз — клеточная гибель. Это один из естественных механизмов защиты организма, в том числе и от распространения клеток злокачественных опухолей. Но некоторые раковые клетки находят пути обхода этого механизма и продолжают расти. Индукторы апоптоза вызывают нормальную гибель клеток опухолей.
Ангиогенез — процесс образования новых кровеносных сосудов, которые обеспечивают питание клеток (в том числе злокачественных). Препараты этой группы могут влиять на специфические факторы роста эндотелия сосудов (VEGF) или другие вещества, участвующие в формировании сосудов. Так ингибиторы ангиогенеза лишают злокачественные клетки питания. В результате клетки гибнут.
Такие препараты воздействуют на иммунную систему организма в целом или на иммунные механизмы опухоли. Собственный иммунитет активизируется, вызывая гибель клеток опухоли.
Кому показана таргетная терапия
Как правило, таргетная терапия используется у пациентов с известными молекулярными нарушениями, на которые могут воздействовать таргетные препараты. Причем такие нарушения могут быть разными при одном и том же типе рака.

В таблицах приведены варианты таргетной терапии рака молочной железы.
HER2-положительный рак молочной железы
Иммуноконъюгаты(комплекс из моноклонального антитела и препарата для химиотерапии)
Таргетная терапия

Что такое таргетная терапия?
Таргетная терапия – это специальные лекарства, которые уничтожают определенные типы раковых клеток. Они воздействуют исключительно на вещества, благодаря которым некоторые виды онкологии растут и распространяются по организму.
Название метода происходит от английского слова «target» – цель или мишень. Именно так он и работает – точно против измененных тканей.
Чем таргетная терапия отличается от химиотерапии?
Подобные вещества, так же как и другие используемые для лечения рака лекарства, технически считаются химиотерапией, но принцип их действия отличается:
Как работает таргетная терапия?
Таргетные препараты предназначены для воздействия на определенные вещества в раковых клетках: избыток некоторых белков, а также соединения или изменения генов, которые отсутствуют в нормальных тканях.
Такие лекарства умеют:
Виды таргетной терапии
Существует несколько типов препаратов, каждый из которых выполняет определенную задачу.
Ингибиторы ангиогенеза: блокируют образование новых кровеносных сосудов, которые необходимы новообразованию для питания и быстрого роста – например, бевацизумаб, применяющийся при нескольких видах рака.
Моноклональные антитела: доставляют в опухолевую клетку молекулы, которые ее убивают. Одни их виды называют таргетной терапией, поскольку у них есть конкретная цель в онкологической клетке, которую они стремятся найти и атаковать. Другие действуют как иммунотерапия, стимулирующая иммунную систему и помогающая ей обнаруживать онкологию и бороться с ней. К таким лекарствам относят трастузумаб, работающий при некоторых типах новообразований молочной железы, и цетуксимаб, назначающийся пациентам с опухолями прямой кишки, легких, головы и шеи.
Ингибиторы протеасом: нарушают нормальную работу клеток, что приводит к их гибели. Их примером является бортезомиб, применяющийся при множественной миеломе – заболевании кроветворной системы.
Ингибиторы сигнальной трансдукции: блокируют активность молекул, передающих сигналы между клетками. Так работает препарат иматиниб, применяющийся при некоторых типах хронической лейкемии – поражении костного мозга, приводящем к образованию измененных клеток крови.
Высококвалифицированные специалисты Онкоцентра «Лапино-2» проводят любое противораковое лечение, включая таргетное – без очередей, задержек и потерь времени.
Как принимают таргетную терапию?
На сегодняшний день существует несколько форм, в которых выпускаются подобные препараты. Их можно принимать внутрь, как обычные таблетки, капсулы или сиропы, либо внутривенно.
Лекарства доставляют в организм через обычный катетер – тонкую мягкую пластиковую трубку в кровеносном сосуде, или центральный венозный, так называемый порт – устанавливаемое под кожу устройство. Они вводятся специалистом за несколько минут или часов.
Оральная таргетная терапия обычно принимается по четкому графику дома. Каждый пациент получает четкие инструкции о том, сколько, когда и как это нужно делать. Дозы средства рассчитываются таким образом, чтобы в организме постоянно присутствовало необходимое количество данных веществ, уничтожающих раковые клетки.
Любой малейший сбой или отклонение от схемы может повлиять на эффективность лечения.
О каждом пропуске или задержке в приеме препарата нужно сообщить врачу, который решит, как действовать в данной ситуации.
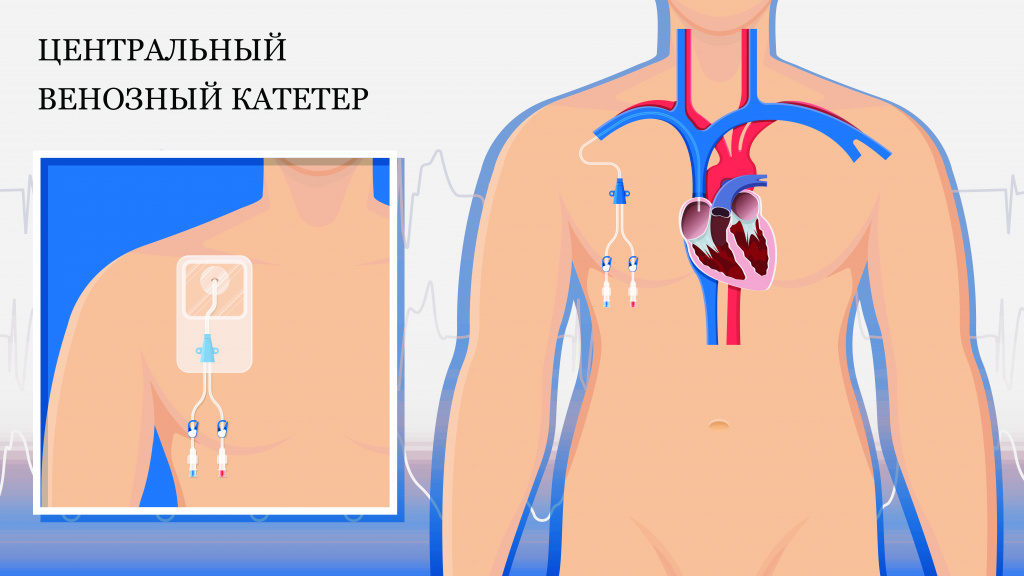
Порты для таргетной и химиотерапии
Центральный венозный катетер, или порт – удобное решение для онкобольных, которым нужно регулярно получать внутривенное лечение и сдавать кровь. С течением времени состояние их сосудов ухудшается из-за постоянных проколов, а попытки введения препаратов превращаются в пытку как для пациентов, так и для медицинского персонала.
Практически незаметное устройство, обычно устанавливаемое под кожу чуть ниже ключицы, эту проблему решает – его обладатели не испытывают проблем со сдачей анализов и доставкой в организм препаратов.
Преимуществ у портов много: они позволяют сократить количество уколов, избежать дискомфорта при проведении химио- или таргетной терапии, и уменьшить риски попадания препаратов на кожу, а значит и ее раздражения.
К их минусам можно отнести вероятность засорения катетера, появление в нем сгустков крови, его перекручивание либо смещение. Избежать неприятных последствий не сложно – достаточно строго следовать инструкциям по очистке, тщательно мыть руки, стараться избегать по нему ударов и не заниматься контактными видами спорта.
Побочные эффекты таргетной терапии
Несмотря на то, что таргетные препараты работают против раковых клеток и практически не повреждают здоровые, после их приема могут возникнуть побочные эффекты. Они встречаются не у всех пациентов и отличаются от «побочек» обычной химиотерапии, которая воздействует на все ткани тела.
Большая часть неприятных последствий проходит после окончания лечения, но поскольку многие вещества изобретены совсем недавно, долгосрочные последствия их приема еще изучены не полностью.
Проблемы с кожей
Самая распространенная из них – сыпь, обычно возникающая голове, лице, шее, груди и верхней части спины.
Чаще всего она начинается с покраснения и припухлостей на первых же неделях лечения, а примерно через месяц кожа покрывается корками, становится пересушенной и красной. У некоторых людей появляются круглые, плоские или выпуклые пятна или гнойные прыщи.
Сыпь вызывает зуд и жжение и нередко приводит к заметному изменению внешности, но обычно полностью проходит примерно через месяц после отмены таргетных препаратов.
Сухость, приводящая к ломкости, зуду, шелушению и даже трещинам – еще одна распространенная проблема, которая возникает практически у всех пациентов, получающих лечение на протяжении полугода.
Некоторые вещества могут вызвать покраснение и болезненность кутикулы, а также появление вокруг ногтей на руках и ногах отечных красных язв, которые нередко инфицируются.
Ладонно-подошвенный синдром – поражение кожи на ладонях и подошвах стоп, связан со многими препаратами для лечения рака, включая химио- и некоторые виды таргетной терапии. Его причина до сих пор точно не известна – возможно, все дело в повреждении крошечных кровеносных сосудов в конечностях или окружающих их тканей. Обычно он развивается в течение первых 2-6 недель лечения, а его первыми симптомами становятся повышенная чувствительность, покалывание или онемение. Затем пострадавшие области опухают, краснеют, как при солнечном ожоге, шелушатся, трескаются и покрываются волдырями.
Применение некоторых средств может привести к ухудшению качества волос – их сухости, ломкости, истончению и появлению залысин.
У части пациентов кожа или волосы темнеют или приобретают желтоватый оттенок.
Кроме того, возможно пересыхание, покраснение и ощущение жжения в области век и глаз.
При появлении сыпи или любых других проблем с кожей необходимо сразу же сообщить об этом врачу-онкологу, поскольку при отсутствии правильного лечения у пациента могут развиться инфекции, требующие отсрочки или даже прекращения терапии.
Другие побочные эффекты целевого лечения похожи на последствия стандартной «химии». К ним относят тошноту и рвоту, диарею или запоры, образование язв во рту, одышку – ощущение нехватки воздуха, кашель, усталость, головную боль, выпадение волос, повреждение печени, почек и щитовидной железы, а также аллергические реакции.
Таргетная терапия различных видов рака
Данные препараты подходят не для всех пациентов – они помогают только в том случае, если в раковых клетках человека присутствуют определенные изменения. Перед назначением лечения врачи проводят биопсию – изымают небольшую частичку новообразования и передают ее в лабораторию, где она тщательно исследуется. Если специалистам удается найти особенности опухоли, для которых уже созданы лекарства, их применяют – часто одновременно с химиотерапией или другими видами вмешательства.
Таргетная терапия рака гортани
Для лечения некоторых запущенных форм онкологии горла и гортани используется Цетуксимаб (Эрбитукс), блокирующий EGFR – белок, который помогает опухолевым клеткам быстро расти. Его можно комбинировать с лучевой или химиотерапией.
Таргетная терапия рака желчных протоков
На сегодняшний день при данном типе онкологии используется 2 типа препаратов:
Таргетная терапия немелкоклеточного рака легкого
Для пациентов с немелкоклеточной онкологией легких создано множество таргетных препаратов:
Таргетная терапия рака молочной железы
Примерно у 1 из 5 женщин с раком груди опухолевые клетки содержат на своей поверхности слишком много стимулирующего их рост белка – HER2. Эти HER2-положительные новообразования быстро развиваются и распространяются по организму. Для их лечения применяются:
Примерно 2 из 3 случаев рака молочной железы чувствительны к гормонам – веществам, которые создаются нашими железами, через кровоток попадают в органы и сообщают им, как действовать – работать или отдыхать, выделять что-то или поглощать. В таких ситуациях применяется гормональная терапия:
Олапариб (Линпарза) и Талазопариб (Талценна): блокируют белки PARP, необходимые для восстановления поврежденной ДНК, что часто приводит к гибели раковых клеток.
Сацитузумаб говитекан: моноклональное антитело, присоединенное к химиотерапевтическому препарату. Лекарство работает в случае избытка в опухоли белка Trop-2, помогающего ей быстро расти и распространяться по организму.
Таргетная терапия рака печени
Для пациентов с раком печени есть несколько типов таргетных препаратов:
Таргетная терапия рака пищевода
При лечении рака пищевода используется несколько типов таргетных препаратов.
Некоторые типы опухолей содержат слишком много белка HER2, который способствует быстрому росту онкологических клеток. Такие заболевания называются HER2-положительными. Против них можно применять:
Таргетная терапия рака поджелудочной железы
Для лечения онкологии поджелудочной железы используются:
Таргетная терапия рака почки
Врачи применяют 2 типа таргетных препаратов для лечения рака почки. Их назначают пациентам с запущенным заболеванием для снижения скорости разрастания опухоли или уменьшения ее размеров.
Таргетная терапия рака предстательной железы
При лечении онкологии простаты используются Рукабариб (Рубрака) и Олапариб (Линпарза) – так называемые ингибиторы PARP. Данные лекарства не позволяют восстанавливаться поврежденной ДНК в клетках новообразований, что приводит к их гибели.
Таргетная терапия саркомы матки
Пазопаниб (Вотриент): назначается при лейомиосаркоме – опасной для жизни опухоли гладкой мускулатуры матки, которая распространилась по организму или вернулась после проведенного лечения.
Таргетная терапия рака щитовидной железы
В случае папиллярного или фолликулярного рака щитовидной железы применяют 3 типа препаратов:
При медуллярном раке используются:
При анапластических новообразованиях применяются:
Таргетная терапия рака яичников
Пациенткам с онкологией яичников могут назначаться:
В Онкоцентре «Лапино-2» проводится не только инновационная таргетная терапия, но и любое другое противоопухолевое лечение всех типов онкологии самыми современными препаратами.
Таргетная терапия
К сожалению, химиотерапия характеризуется низким уровнем ответа (90% препаратов эффективны только у 30-50% пациентов). Соответственно, основной задачей в онкологии является повышение эффективности лечения с помощью более персонализированного подхода к лекарственной терапии.
Развитие молекулярной биологии и расшифровка генома человека позволили нам определить пути развития злокачественных заболеваний и определить молекулярные «мишени» для воздействия более точечных, таргетных препаратов.
Таргетная терапия в онкологии применяется уже более 20 лет и сегодня является незаменимой частью системного курса лечения большинства злокачественных новообразований, при соответствующей ее цене.

Что такое таргетная терапия и как она работает?
В переводе с английского языка “target” – мишень. Мишенью в данном случае являются те или иные молекулы, участвующие в процессе злокачественной трансформации клеток.
Например, на поверхности злокачественной клетки находятся рецепторы, с которыми взаимодействуют факторы роста (это белки, стимулирующие рост, размножение и дифференцировку клеток).
Далее информация с рецептора передается внутрь клетки и с помощью сигнальных путей попадает в ядро. Опухолевые клетки начинают активно размножаться, постепенно запускаются процессы инвазии (способность раковой клетки проникать в окружающие ткани), метастазирования (процесс распространения раковых клеток за пределы первичного очага в лимфатические узлы или отдаленные органы), ангиогенеза (процесс образования новых кровеносных сосудов, питающих опухоль), включаются антиапоптотические механизмы (механизмы избегания запрограммированной клеточной смерти, что позволяет клеткам бесконтрольно делиться).
Таргетная терапия воздействует прицельно на молекулы, которые, как правило, гиперэкспрессируются на поверхности злокачественных клеток (появляются в большем количестве), хотя и могут обнаруживаться на поверхности нормальных клеток (в меньшем количестве), или на мутированные молекулы (из-за поломок генов, которые приводят к экспрессии мутантных белков).
Чем таргетная терапия отличается от химиотерапии?
На протяжении десятилетий основным видом лечения рака была внутривенная цитотоксическая химиотерапия. Эти препараты действуют на быстро делящиеся клетки, включая как злокачественные, так и нормальные клетки организма. В результате, многие пациенты испытывают классические побочные эффекты: алопецию, желудочно-кишечных симптомы и миелосупрессию (уменьшение количества образующихся в костном клетке кровяных клеток: эритроцитов, лейкоцитов, тромбоцитов). Таргетные препараты действуют прицельно и не оказывают системного токсического воздействия на организм, однако, характеризуются другими побочными эффектами.
Химиопрепараты, как правило, вводится в организм с определенными интервалами (например, каждые 2 или 3 недели), так как организм должен восстановиться от действия цитостатической химиотерапии. Для таргетной же терапии необходимо поддержание концентрации препарата для постоянного воздействие на мишень.
Также нет необходимости в ведении максимальной дозы лекарств. Для таргетной терапии подбирается определенная дозировка, которая не является максимально переносимой в отличии от химиотерапевтического лечения, когда в организм вводятся максимальные допустимые дозы цитостатиков.
Виды таргетной терапии
Существует два основных класса таргетных препаратов:
EGFR-ингибиторы: EGFR (epidermal growths factor receptor, так же может обозначаться как EgbB1 или HER-1) – это трансмембранный рецептор, с которым связываются эпидермальные факторы роста (белки, стимулирующие рост и дифференцировку клеток). Препараты данной группы могут блокировать клеточный рост за счет блокировки рецептора на поверхности злокачественной клетки.
Анти-HER-2-препараты: также как и EGFR, HER2 – это трансмембранный рецептор (белок ErbB2 или HER-2/neu). Функция HER2 состоит в регуляции роста и размножения клеток. В случае гиперэкспрессии (в нормальной клетке есть две копии гена этого белка, в злокачественной клетки он представлен большим количеством), опухоль растет быстрее, так же характеризуется более высокой агрессивностью и резистентностью к химиотерапии.
Киназные ингибиторы: киназы – это ферменты (белки), способствующие перемещению химических веществ от одной молекулы к другой внутри путей передачи сигнала (сигнальных путей, условно начинающихся на поверхности клетки с рецептора и заканчивающихся в ядре клетке). Есть несколько сотен типов киназ и названы они в честь субстрата, на который они воздействуют. Многие киназы воздействуют на белки и, соответственно, называют протеинкиназами (часть, с помощью которой протеинкиназы связываются с белками называется остатком, например: тирозин, серин, треонин. Соответственно, называются тирозинкиназами и т.д.). Некоторые киназы являются частью трансмембранных белков и расположены на конце рецептора, другие же обнаруживаются в жидкости, заполняющей клетку (в цитоплазме). Например, EGFR и HER2 являются рецепторными киназами.
Ингибиторы пути Hedgehog: путь Hedgehog это важный сигнальный путь, участвующий во внутриматочном развитии плода (контролирующий рост плода). У взрослых людей путь Hedgehog в основном не активирован, однако, может активироваться у людей с немеланомными заболеваниями кожи.
Ингибиторы ангиогенеза: ангиогенез – процесс образования новых сосудов. Злокачественные клетки так же как и нормальные клетки нуждаются в питании и кровеобеспечении. Для этого они выбрасывают факторы роста эндотелия сосудов (VEGF), которые связываются с VEGF-рецепторами (VEGFR1/2/3) на поверхности клеток (в т.ч. нормальных клеток сосудов). Анти-VEGF-ингибиторы связываются киназами рецепторов VEGF или с VEGF-рецепторами.
Как определить мишени для таргетной терапии?
Биологическая таргетная терапия при раке подбирается индивидуально исходя из молекулярно-генетических особенностей опухоли, локализации опухоли, а также общего состояния пациента. Таким образом, для определения мишеней таргетной терапии необходимо проведение иммуногистохимического исследования (например, для определения статуса HER2/neu) или расширенного генетического исследования опухоли для определения мутаций генов, кодирующих определенные белки. Стоимость 1 курса таргетной терапии также рассчитывается индивидуально.
Расширенное генетическое исследование ONCOGENOTEST
Расширенное генетическое исследование ONCOGENOTEST позволяет найти мутации в опухоли. Это помогает:
Нужна помощь? Оформите заявку на сайте, мы свяжемся с вами в ближайшее время и ответим на все интересующие вопросы о проведении расширенного генетического исследования опухоли.
Противопоказания
В первую очередь это резистентость (устойчивость) к таргетной терапии. Для преодоления механизмов резистетности возможно применение комбинаций таргетной терапии. Например, использование двух препаратов, нацеленных на разные части сигнального пути при меланоме с мутацией BRAF V600E. Стандартом лечения в настоящий момент является применение таргетной терапии совместно с химиотерапией для более широкого воздействия лекарственных средств. Однако, в некоторых случаях, возможно определение маркеров резистентности еще до начала лечения, например, определение мутации T970M в гене EGFR, обуславливающей резистентость к анти-EGFR-ингибиторам в лечении немелкоклеточного рака легкого.
Побочные эффекты
Изначально предполагалось, что таргетные препараты будут менее токсичными нежели химиотерапевтические препараты в виду их точечного воздействия. Однако, таргетные препараты также могут обладать серьезным побочным действием.
Наиболее частыми из них являются: диарея и гепатотоксичность (лекарственные гепатиты или повышение показателей печеночных ферментов).
Другими побочными эффектами могут быть:
Некоторые побочные эффекты могут свидетельствовать об эффективности таргетной терапии, например, появление и тяжесть акнеподобной сыпи в лечении некоторыми препаратами свидетельствует о лучшем ответе на терапию. Так же как и при лечении анти-VEGF-препаратами, появление гипертензии свидетельствует о лучших исходах.


