Кальций
Кальций — химический элемент с атомным номером 20 в периодической системе, обозначается символом Ca (лат. Calcium ), мягкий щелочноземельный металл серебристо-серого цвета.
Умеренно твёрдый,
серебристо-белый металл
Содержание
История и происхождение названия
Нахождение в природе
Соединения кальция находятся практически во всех животных и растительных тканях. В организме человека и животного 1,4-2 % Са3(РО4)2 и 13 % СаСО3.
Получение
Свойства
Химические свойства
Применение
Применение металлического кальция
Металлотермия
Чистый металлический кальций широко применяется в металлотермии при получении редких металлов.
Ядерный синтез
Изотоп 48 Ca наиболее эффективный и употребительный материал для производства сверхтяжелых элементов, и открытия новых элементов таблицы Менделеева. Например в случае использования ионов 48 Ca для получения сверхтяжелых элементов на ускорителях, ядра этих элементов образуются в сотни и тысячи раз эффективней чем при использовании других «снарядов»(ионов).
Применение соединений кальция
Легирование сплавов
Чистый кальций применяется для легирования свинца идущего на изготовление аккумуляторных пластин необслуживаемых стартерных свинцово-кислотных аккумуляторов с малым саморазрядом. Так же металлический кальций идет на производство качественных кальциевых баббитов БКА.
Гидрид кальция
Нагреванием кальция в атмосфере водорода получают CaH ( гидрид кальция ) используемый в металлургии (металлотермии) и при получении водорода в полевых условиях.
Оптика
Фторид кальция (флюорит) применяется в виде монокристаллов в оптике (астрономические объективы, линзы, призмы), и как лазерный материал.
Лазерные материалы
Вольфрамат кальция ( шеелит ) в виде монокристаллов применяется в лазерной технике.
Карбид кальция
Химические источники тока
Кальций, а так же его сплавы с алюминием и магнием используются в резервных тепловых электрических батареях в качестве анода(например кальций-хроматный элемент ). Хромат кальция используется в таких батареях в качестве катода. Особенность таких батарей — чрезвычайно долгий срок хранения (десятилетия) в пригодном состоянии, возможность эксплуатации в любых условиях (космос, высокие давления), большая удельная энергия по весу и объему. Недостаток в недолгом сроке действия. Такие батареи используются там где необходимо на короткий срок создать колоссальную электрическую мощность (баллистические ракеты, некоторые космические аппараты и.т.д).
Огнеупорные материалы
Оксид кальция в свободном виде так и в составе керамических смесей применяется в производстве огнеупорных материалов.
Лекарственные средства
Соединения кальция широко применяются в качестве антигистаминного средства.
Биологическая роль
В организме животных ионы кальция играют существенную роль (кальциевые каналы).
Кальций — важнейший элемент для формирования скелета (см. витамин Д ).
С возрастом в организме усиливаются процессы, связанные с потерей ионов кальция, что приводит к остеопорозу (в отсутствие коррекции).
Изотопы
Из шести природных изотопов кальция пять стабильны. Шестой изотоп 48 Ca, самый тяжелый из шести и весьма редкий (его изотопная распространённость равна всего 0,187 %), как было недавно обнаружено, испытывает двойной бета-распад с периодом полураспада 5,3×10 19 лет.
См. также
Ссылки
Литература
af:Kalsium ar:كالسيوم ast:Calciu bg:Калций bn:ক্যালসিয়াম bs:Kalcijum ca:Calci co:Calciu cs:Vápník da:Calcium de:Calcium el:Ασβέστιο en:Calcium eo:Kalcio es:Calcio et:Kaltsium fi:Kalsium fr:Calcium gl:Calcio (elemento) he:סידן hr:Kalcij hu:Kalcium hy:Կալցիում id:Kalsium io:Kalcio is:Kalsín it:Calcio (metallo) ja:カルシウム jbo:bogjinme ko:칼슘 ku:Kalsiyûm la:Calcium lb:Kalzium lt:Kalcis lv:Kalcijs mi:Konupūmā mk:Калциум ml:കാത്സ്യം ms:Kalsium nl:Calcium nn:Kalsium no:Kalsium oc:Calci pl:Wapń pt:Cálcio ro:Calciu sh:Kalcij simple:Calcium sk:Vápnik sl:Kalcij sq:Kalciumi sr:Калцијум su:Kalsium sv:Kalcium ta:கல்சியம் th:แคลเซียม tr:Kalsiyum uk:Кальцій uz:Kalsiy vi:Canxi zh:钙 zh-yue:鈣
История открытия
Считается, что кальций был известен человеку еще с древних времён. В Древнем Риме, в Месопотамии и других цивилизациях Востока с использованием гашеной и негашеной извести возводили массивные и долговечные здания и сооружения. Но в чистом виде этот микроэлемент удалось получить лишь в XIX веке. Английский химик Гемфри Дэви в 1808 году проводил опыты и путём электролизации гашеной извести получил оксиды ртути, из которой выплавил новый металл, названный кальцием.
Ученый смог определить молярную формулу, вычислить уравнение и степень валентности этого микроэлемента.
В последующем человек научился получать чистый кальций путем использования различных технологий. Проведенные в последующем исследования показали, что этот микроэлемент содержится в большом количестве в земле, причём по мере приближения к ядру его массовая доля увеличивается. Он находится в различных горных породах, но в чистом виде в природе не встречается.
Нахождение в природе
Считается, что кальций — это один из самых распространённых элементов на Земле. Его общая доля составляет 3,38% всей массы коры. Однако из-за высокой активности его большая часть содержится в составе различных оксидов. Также он встречается в горных породах, в том числе в граните, различных силикатах и алюмосиликатах. В осадочных породах это соединение представлено в виде известняка, мела и различных минералов.
Природными источниками являются:
Также широко распространены в природе минералы кальция, в том числе ангидрид, известняк, доломит, апатиты и флюорит. Соли этого элемента содержатся в пресной или морской воде, определяя её показатели жесткости.
Экспериментальным путем установлено, что кальций входит в состав различных живых организмов, в том числе в костную ткань позвоночных видов, к которым относится человек. Из карбоната состоят жёсткие панцири и раковины различных беспозвоночных, скорлупа яиц птиц с пресмыкающимися.
Характеристики вещества
В естественных условиях кальций представляет собой металл с характерным серебристо-белым цветом. Он имеет высокую химическую активность, поэтому часто образует множество различных классов и всевозможных соединений с оксидами. Этот элемент представляет большую ценность для промышленного и технического химического синтеза, он необходим для правильной жизнедеятельности большинства живых видов на планете Земля. По своим физическим свойствам кальций относится к категории щелочноземельных, он отлично растворяется в воде, в особенности много этого соединения содержится в морской воде.
Его химические и физические характеристики зависят от особенностей схемы кристаллической решетки этого элемента. Строение атома кальция стандартно и отличается простотой. В зависимости от содержащихся в нем примесей, строение решетки этого микроэлемента может быть объемно-центрическим или кубическо-гранецентрическим. За счёт наличия металлического типа связи в молекуле обеспечивается максимально возможная прочность такого соединения.
Основные свойства:
Характеристики и химические свойства кальция могут изменяться в зависимости от наличия примесей и температуры окружающей среды. В обычных условиях этот металл имеет агрегатное твердое состояние. Его температура плавления составляет 842 градусов по Цельсию. Он является отличным тепло и электропроводником. Он реагирует на изменения показателей давления, которое модифицирует конфигурацию и положение его атомной решетки. При нагревании выше температуры плавления металл становится жидким, в последующем теряет свои свойства и переходит в парообразное состояние. Температура кипения составляет 1448 градусов.
Опытным путем установлена крайне интересная способность этого элемента. Под воздействием высокого давления это соединение теряет свою способность электропроводимости и другие характеристики кальция.
Однако в последующем после остывания все параметры восстанавливаются при этом отмечаются признаки сверхпроводника, которые в несколько раз превышают аналогичные показатели других элементов. Подобное делает кальций перспективным материалом при изготовлении микрочипов и изделий точной электроники.
Основные способы получения
Кальций обладает повышенной активностью, поэтому часто входит в различные соединения с другими элементами. Именно по этой причине длительное время не удавалось получить чистый материал без содержания различных примесей. Только лишь в начале XIX века англичанину Гемфри Дэви удалось путем электролиза синтезировать металл без содержания примесей. Ученый смог обнаружить взаимодействие электрического тока и расплавов солей с твердыми минералами.
Даже сегодня по прошествии стольких лет технология электролиза солей является наиболее востребованной, что объясняется её простотой и эффективностью. В металлургии применяется способ алюминотермии, который позволяет получить металл с чистотой порядка 98%. Развитие технологий и методов получения этого металла ограничено тем фактом, что такой процесс является ресурсоемким, требуя большого количества тепловой энергии и электрического тока огромной мощности.
Чистый металл хранят в герметичных емкостях с ограниченным доступом кислорода. Для предупреждения реакции с кислородом и водой кальций заливают слоем специальной жидкости (керосином или жидким парафином), что позволяет осуществлять транспортировку и длительное хранение этого металла, предупреждая его окисление и потерю химической чистоты.
На открытом воздухе кальций быстро начинает взаимодействовать с углекислым газом и кислородом, покрываясь характерным темным налетом.
Применение кальция
В чистом виде металл кальций применяют в качестве восстановителя при химических реакциях изготовления редкоземельных сплавов. Также этот элемент незаменим как раскислитель для бронзы, стали и других различных соединений. В химической промышленности он применяется при производстве бензина, позволяя удалять из топлива лишнюю серу. Из оксидов этого элемента изготавливают оболочки электрических кабелей, также из него выполняют антифрикционные материалы, которые незаменимы в радиоэлектронике и электронной промышленности.
Кальций — это биогенный элемент, необходимый для правильного протекания всех жизненных процессов в организме человека. Он присутствует в жидкостях и тканях растений и животных, поэтому играет важнейшую роль в правильной регенерации клеток. Польза и значение этого элемента для организма была установлена в начале прошлого века, а сегодня выводы ученых подтверждены многочисленными исследованиями. У человека содержание кальция достигает 2%, а у некоторых микроорганизмов — до 38%. Ученым известно лишь несколько видов простейших животных, жизнедеятельность которых может происходить без этого микроэлемента.
Большинство растений насыщаются кальцием из почвы, потребляя чистые микроэлементы с помощью специальных окислителей, выделяемых их клетками. Животные, в том числе человек, получают этот минерал с водой и пищей. Кальций необходим для образования клеточных мембран, также этот микроэлемент требуется для правильного обмена веществ. Его нехватка в организме приводит к развитию различных опасных заболеваний, вплоть до смерти человека.
Отдельные виды беспозвоночных научились запасаться кальцием, который необходим им для построения нового скелета и защитного панциря. К сожалению, у высших животных такой способности нет, поэтому им требуется постоянно получать этот микроэлемент извне, в том числе употребляя в пищу различные овощи и фрукты. Последние исследования показали, что обеспечить правильное всасывание кальция в организме человека можно лишь при наличии большого количества витамина D и других различных ферментов.
Кальций общее
 Что такое кальций
Что такое кальций
Са — это химический элемент II группы периодической системы элементов; ат. н. 20, ат. м. 40,08. Серебристо-белый металл который как и другие щелочные металлы быстро окисляется на воздухе. Один из самых распространенных элементов на Земле. В природе его очень много: из солей кальция образованы горные массивы и глинистые породы, он есть в морской и речной воде, входит в состав растительных и животных организмов.
Кальций постоянно окружает горожан: почти все основные стройматериалы — бетон, стекло, кирпич, цемент, известь — содержат этот элемент в значительных количествах.
Даже пролетая в самолете на многокилометровой высоте, мы не избавляемся от постоянного соседства с элементом № 20. Если, допустим, в самолете 100 человек, то, значит, этот самолет несет на борту примерно 150 кг кальция — в организме каждого взрослого человека не меньше килограмма элемента № 20. Не исключено, что во время полета количество кальция вблизи нас намного больше: известно, что сплавы кальция с магнием применяются в самолетостроении, и потому не исключено, что в самолете есть не только «органический», но и «собственный», «конструкционный» кальций.
Кальций элементный
Несмотря на повсеместную распространенность элемента № 20, даже химики и то не все видели элементный кальций. А ведь этот металл и внешне и по поведению совсем непохож на щелочные металлы, общение с которыми чревато опасностью пожаров и ожогов. Его можно спокойно хранить на воздухе, он не воспламеняется от воды. Механические свойства элементного кальция не делают его «белой вороной» в семье металлов: по прочности и твердости кальций превосходит многие из них; его можно обтачивать на токарном станке, вытягивать в проволоку, ковать, прессовать.
Искусственным путем природные соединения кальция не всегда и не во все удовлетворяют человека. Поэтому многие из них превращают в другие вещества. Некоторые соединения кальция, получаемые искусственным путем, стали даже более известными и привычными, чем известняки или гипс. Так, гашеную Са(ОН), и негашеную СаО известь применяли еще строители древности.
Получение кальция
Кальций впервые получен Дэви к 1808 г. с помощью электролиза. Но, как и другие щелочные и щелочноземельные металлы, элемент № 20 нельзя получить электролизом из водных растворов. Кальций получают при электролизе его расплавленных солей.
Это сложный и энергоемкий процесс. В электролизере расплавляют хлорид кальция с добавками других солей (они нужны для тоге, чтобы снизить температуру плавления СаСl2).
Стальной катод только касается поверхности электролита; выделяющийся кальций прилипает и застывает на нем. По мере выделения кальция катод постепенно поднимают и в конечном счете получают кальциевую «штангу» длиной 50—60 см. Тогда ее вынимают, отбивают от стального катода и начинают процесс
сначала. «Методом касания» получают кальций сильно загрязненный хлористым кальцием, железом, алюминием, натрием. Очищают его переплавкой в атмосфере аргона.
Если стальной катод заменить катодом из металла, способного сплавляться с кальцием, то при электролизе будет получаться соответствующий сплав. В зависимости от назначения его можно использовать как сплав, либо отгонкой в вакууме получить чистый кальций. Так получают сплавы кальция с цинком, свинцом и медью.
Получение кальция алюминием
Другой метод получения кальция — металлотермический — был теоретически обоснован еще в 1865 г. известным русским химиком Н. И. Бекетовым. Кальций восстанавливают алюминием при давлении всего в 0,01 мм ртутного столба. Температура процесса 1100—1200° С. Кальций получается при этом в виде пара, который затем конденсируют.
В последние годы разработан еще один способ получения элемента № 20. Он основан на термической диссоциации карбида кальция: раскаленный в вакууме до 1750° С карбид разлагается с образованием паров кальция и твердого графита.
Применение кальция
До последнего времени металлический кальций почти не находил применения. США, например, до второй мировой войны потребляли в год всего 10—25 т кальция, Германия —5—10 т. Но для развития новых областей техники нужны многие редкие и тугоплавкие металлы. Выяснилось, что кальций — очень удобный и активный восстановитель многих из них, и элемент № 20 стали применять при получении тория, ванадия, циркония, бериллия, ниобия, урана, тантала и других тугоплавких металлов.
Способность кальция связывать кислород и азот позволила применить его для очистки инертных газов и как геттер в вакуумной радиоаппаратуре.
Кальций используют и в металлургии меди, никеля, специальных сталей и бронз; им связывают вредные примеси серы, фосфора, избыточного углерода. В тех же целях применяют сплавы кальция с кремнием, литием, натрием, бором, алюминием.
Хранение
Металлический кальций длительно хранить можно в кусках весом от 0,5 до 60 кг. Такие куски хранят в бумажных мешках, вложенных в железные оцинкованные барабаны с пропаянными и покрашенными швами. Плотно закрытые барабаны укладывают в деревянные ящики. Куски весом меньше 0,5 кг подолгу хранить нельзя — они быстро превращаются в окись, гидроокись и карбонат кальция.
Соединения элемента
Цемент — это тоже соединение кальция, полученное искусственным путем. Сначала обжигают смесь глины или песка с известняком и получают клинкер, который затем размалывают в тонкий серый порошок. О цементе (вернее, о цементах) можно рассказывать очень много, это тема самостоятельной статьи.
То же самое относится и к стеклу, в состав которого тоже обычно входит элемент № 20.
Карбид кальция — вещество, открытое случайно при испытании новой конструкции печи! Еще недавно карбид кальция СаС2 использовали главным образом для автогенной сварки и резки металлов. При взаимодействии карбида с водой образуется ацетилен, а горение ацетилена в струе кислорода позволяет получать температуру почти 3000° С. В последнее время ацетилен, а вместе с ним и карбид все меньше расходуются для сварки и все больше — в химической промышленности.
Искусственным путем получают и гидрид кальция — сильнейший восстановитель, и активные окислители — хлорную известь Са(СlO)Сl и гипохлорит кальция Са(СlO)2.
Число примеров, подтверждающих первостепенную важность элемента № 20 и его соединений — природных и искусственных,— можно еще увеличить. Но вряд ли в этом
есть необходимость.
Кальций факты
ИЗОТОПЫ КАЛЬЦИЯ. Природный кальций состоит из шести изотопов с массовыми числами 40, 42, 43, 44, 46 и 48. Основной изотоп— 40Са; его содержание в металле около 97%. Полученные искусственным путем изотопы с массовыми числами 37, 38, 39, 41, 45, 47, 49 и 50 — радиоактивны. Один из них — 45Са может быть получен облучением металлического кальция или его соединений нейтронами в урановом реакторе. Наша промышленность выпускает следующие препараты с изотопом 45Са: кальций металлический, СаСО3, СаО, СаСl2, Ca(NO3)2, CaSO4, CaC2O4.
Радиоактивный кальций широко используют в биологии и медицине в качестве изотопного индикатора при изучении процессов минерального обмена в живом организме. С его помощью установлено, что в организме происходит непрерывный обмен ионами кальция между плазмой, мягкими тканями и даже костной тканью. Большую роль сыграл 45Са также при изучении обменных процессов, происходящих в почвах, и при исследовании процессов усвоения кальция растениями. С помощью этого же изотопа удалось обнаружить источники загрязнения стали и сверхчистого железа соединениями кальция в процессе выплавки.
ЗУБЫ И МЕТАЛЛЫ ЧИСТИТ РАЗНЫЙ МЕЛ. Природный мел в виде порошка входит в составы для полировки металлов. Но чистить зубы порошком из природного мела нельзя, так как он содержит остатки раковин и панцирей мельчайших животных, которые обладают повышенной твердостью и разрушают зубную эмаль. Поэтому зубной порошок готовят только из химически осажденного мела.
ЖЕСТКАЯ ВОДА. Комплекс свойств, определяемых одним словом «жесткость», воде придают растворенные в ней соли кальция и магния. Жесткая вода непригодна во многих случаях жизни. Она образует слой накипи в паровых котлах и котельных установках, затрудняет окраску и стирку тканей, не годится для варки мыла и приготовления эмульсий в парфюмерном производстве. Поэтому раньше, когда способы умягчения воды были несовершенны, текстильные и парфюмерные предприятия обычно размещались поблизости от источников «мягкой» воды.
Различают жесткость временную и постоянную. Временную (или карбонатную) жесткость придают воде растворимые гидрокарбонаты Са(НСО3)г и Mg(HCO3)2. Устранить ее можно простым кипячением, при котором гидрокарбонаты превращаются в нерастворимые в воде карбонаты кальция и магния.
Постоянная жесткость создается сульфатами и хлоридами тех же металлов. И ее можно устранить, но сделать это намного сложнее.
Сумма обеих жесткостей составляет общую жесткость воды. Оценивают ее в разных странах по-разному. Если в литре воды меньше 4 мг-экв, то вода считается мягкой; по мере увеличения их концентрации — все более жесткой и, если содержание превышает 12 единиц,— очень жесткой.
Жесткость воды обычно определяют с помощью раствора мыла. Такой раствор (определенной концентрации) прибавляют по каплям к отмеренному количеству воды. Пока в воде есть ионы Са2+ или Mg2+, они будут мешать образованию пены. По затратам мыльного раствора до появления пены вычисляют содержание ионов Са2+ и Mg2+.
Интересно, что аналогичным путем определяли жесткость воды еще в Древнем Риме. Только реактивом служило красное вино — его красящие вещества тоже образуют осадок с ионами кальция и магния.
«КИПЕЛКА» И «ПУШОНКА». Еще в I в. н.э. Диоскорид — врач при римской армии — в сочинении «О лекарственных средствах» ввел для окиси кальция название «негашеная известь», которое сохранилось и в наше время. Строители ее называют «кипелкой» — за то, что при гашении выделяется много тепла, и вода закипает.
Образующийся при этом пар разрыхляет известь, она распадается с образованием пушистого порошка. Отсюда строительное название гашеной извести — «пушонка». В зависимости от количества воды, добавляемой к извести, гашение идет до получения пушонки, известкового теста, известкового молока или известковой воды. Все они нужны для приготовления вяжущих растворов.
БЕТОНУ —ДВЕ ТЫСЯЧИ ЛЕТ. Бетон — важнейший строительный материал наших дней. Но это вещество (точнее, одну из его разновидностей — смесь дробленого камня, песка и извести) применяют с давних пор. Плиний Старший (I в. н. э.) так описывает постройку цистерн из бетона: «Для постройки цистерн берут пять частей чистого гравийного песка, две части самой лучшей гашеной извести и обломки силекса (твердая лава.— Ред.) весом но больше фунта каждый, после смешивания уплотняют как следует нижнюю и боковые поверхности ударами железной трамбовки».
ПОЧЕМУ КАЛЬЦИЙ — КАЛЬЦИЙ. В латинском языке слово «calx» обозначает известь и сравнительно мягкие, легко обрабатываемые камни, в первую очередь мел и мрамор. От этого слова и произошло название элемента № 20.
ЧТО ТАКОЕ «АРБОЛИТ»? Так назван материал, в состав которого входят отходы древесины, цемент, хлористый кальций и вода. После смешения компонентов и уплотнения вибрационным способом получается строительный материал с исключительно ценными свойствами: он не горит, не гниет, легко пилится пилой, обрабатывается на станке. Стоимость такого материала невелика. Плиты из арболита используют в строительстве малоэтажных зданий.
Статья на тему кальций общее
Кальций – полезные свойства и особенности металла
Этот химический элемент жизненно важен в буквальном смысле: из него состоят наши кости и зубы. Кальций – это также морские раковины, цветные мелки, сталактиты и сталагмиты в пещерах.
Что представляет собой
Кальций – это химический элемент периодической системы Д. И. Менделеева под №20. Мягкий серебристо-белый металл блестит, но затем тускнеет под пленкой-оксидом.
Состоит из шести стабильных изотопов, при этом 97% состава приходится на Ca40.
Относится к щелочноземельным металлам.
Международное обозначение – Calcium (Ca).
История
Применение кальциевых минералов – мрамора, гипса, известняка – исчисляется тысячелетиями.

Чистый металл первым в истории получил британский химик Гемфри Дэви (1808 год). Для этого он применил электролиз к смеси из оксида ртути и мокрой гашеной извести. Получив амальгаму, отделил ртуть.
Он же предложил латинское название элемента: calcis означает мягкий камень, известка.
Физико-химические характеристики
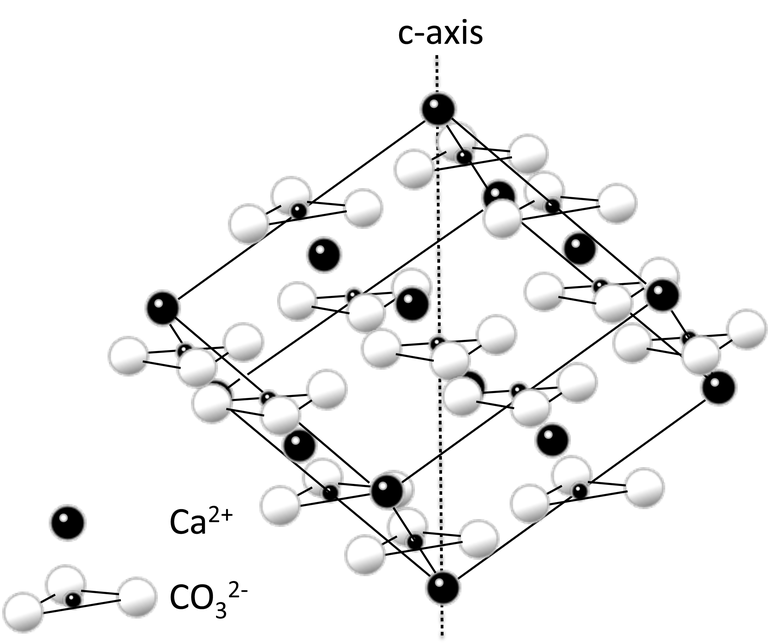
Кальций представлен двумя модификациями кубической решетки: с гране- и объемноцентрированной структурой.
Металл наделен многими достоинствами: пластичен, режется ножом, обрабатывается прессованием, прокаткой.
Химические свойства проявляются при нагревании:
Нагреваясь в кислороде либо на воздухе, кальций, его растворимые соли горят. Пламя получается красно-оранжевым. По цвету его легко отличить от других металлов.

Химическая активность вещества зашкаливает. Для устранения этого недостатка металл хранят в керосине, растопленном парафине либо закупоренном сосуде.
| Свойства атома | |
|---|---|
| Название, символ, номер | Ка́льций/Calcium (Ca), 20 |
| Атомная масса (молярная масса) | 40,078(4) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 4s2 |
| Радиус атома | 197 пм |
| Химические свойства | |
| Ковалентный радиус | 174 пм |
| Радиус иона | (+2e) 99 пм |
| Электроотрицательность | 1,00 (шкала Полинга) |
| Электродный потенциал | −2,76 В |
| Степени окисления | 2 |
| Энергия ионизации (первый электрон) | 589,4 (6,11) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 1,55 г/см³ |
| Температура плавления | 1112 К; 838,85 °C |
| Температура кипения | 1757 К; 1483,85 °C |
| Уд. теплота плавления | 9,20 кДж/моль |
| Уд. теплота испарения | 153,6 кДж/моль |
| Молярная теплоёмкость | 25,9 Дж/(K·моль) |
| Молярный объём | 29,9 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированная |
| Параметры решётки | 5,580 Å |
| Температура Дебая | 230 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) (201) Вт/(м·К) |
| Номер CAS | 7440-70-2 |
Уникальные свойства кальция как металла проявляются при усилении давления.
Под давлением он ведет себя как полупроводник, затем как металл, потом подобно сверхпроводнику. По проводимости в разы превосходит все химические элементы (например, ртуть – вшестеро).
Присутствие в природе
Кальций – третий по распространенности в земной коре среди металлов, пятый среди всех элементов. Четвертый по количеству минералов (385).
Однако высокая химическая активность исключает присутствие элемента в свободном виде:

Вещество с формулой СаСО3 – обычный мел.
Тонна земной коры содержит 32,7 кг кальция, литр морской воды – 410 мг.
Из морской воды кальций как строительный материал вытаскивают моллюски, кораллы.
Концентрацией кальция в составе определяется степень жесткости воды.
Технология получения
Конечный продукт промышленного производства – металлический кальций.

Получение металла проходит двумя методами:
Для обоих способов получения металла требуется вакуум и 960-1900°С.
Единственный производитель кальция в Европе – Чепецкий механический завод. Его открыли в 1949 году для нужд отечественной урановой промышленности. Уже тогда СССР отработал процесс восстановления урана кальцием. Сегодняшний ассортимент шире.
Где используется
Утилитарные характеристики металла обусловили сферы применения.

Промышленность
Львиная доля продукции металлургических комбинатов достается промышленному комплексу.
Здесь миссия кальция многогранна:
Металл используется при производстве аккумуляторных батарей, подшипников, оболочек кабелей.
Наука
Изотоп Ca-48 – материал с высоким КПД для производства сверхтяжелых элементов.
Кальцием восстанавливают уран.
С его помощью ученые пополняют таблицу Менделеева.
Другие сферы
Кальциевые материалы нашли применение на бытовом уровне:
Эстетично выглядящие образцы (флюорит, кальцинит, мрамор) попадают в минералогические коллекции.
Биологическое влияние
Кальций – важный для биологических организмов макроэлемент (1,6-2,1% по массе): он есть в растениях, организме животных, человека.
Жизненные процессы
Макроэлемент аккумулируется костями и зубами.
Известь (карбонат кальция) – строительный материал ракушек, кораллов, яичной скорлупы, накипи в чайнике.
Вещество задействовано в следующих процессах:
Тело человека массой 60 кг содержит полтора килограмма кальция.
Достаточное количество металла критично для детей и подростков: их скелет растет каждую минуту. У младенцев может проявиться рахитичность.
Питание
Макроэлемент поступает в организм во время еды. В детском возрасте продукт номер один – молоко.
Рацион взрослых разнообразнее. Веществом насыщены продукты всех групп:
Всасыванию кальция содействует лактоза, препятствуют кофе, углеводы, пальмовое масло, животные жиры (кроме сала).
Нормы
Суточная потребность в макроэлементе определяется возрастом (г):
| Возраст (лет) | Количество кальция (мг) |
| 0-6 | 1490 |
| 7-9 | 750 |
| 10-12 (мальчики) | 910 |
| 10-12 (девочки) | 1250 |
| 13-19 | 1250 |
| 20-49 | 1050 |
| 49+ | 1150-1350 |
Беременным и кормящим матерям требуется повышенная норма вещества.
Симптомы нехватки/переизбытка
Дефицит металла в организме проявляется многопланово:
На ментальном плане это депрессия, нервозность.
Хроническая нехватка макроэлемента ведет к хрупкости костей (остеопорозу).
Об избытке макроэлемента сигнализируют отвращение к еде, неутолимая жажда, расстройство ЖКТ (тошнота, рвота), повышенное мочеотделение, слабость.
Избыток вещества опасен: организм «цементируется».
Максимальная суточная доза кальция для взрослых – 2,5 г.
На российском рынке представлена промышленная и аптечная продукция.
Цены на промышленный кальций (руб. / кг):
Аптечный сегмент представлен отечественной и зарубежной продукцией. Упаковка глюконата кальция (10 таблеток) российского производства стоит 15-25 руб., препарата «Кальций-Д3 Никомед» – 300 – 700 руб.




 Что такое кальций
Что такое кальций 
