Карбид кальция
| Карбид кальция | |
 | |
 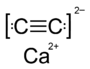 | |
| Общие | |
|---|---|
| Систематическое наименование | Кальция карбид |
| Химическая формула | CaC2 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 64.099 г/моль |
| Плотность | 2.22 г/см³ |
| Термические свойства | |
| Температура плавления | 2160 °C |
| Температура кипения | 2300 °C |
| Структура | |
| Координационная геометрия | 6 |
| Кристаллическая структура | Тетрагональная |
| Классификация | |
| Рег. номер CAS | 75-20-7 |
Карби́д ка́льция (углеро́дистый ка́льций, ацетилени́д кальция) — CaC2 — в чистом виде белое кристаллическое вещество. Соединение кальция с углеродом.
Содержание
История получения
Впервые получен в 1862 г. Ф. Вёлером нагреванием сплава цинка и кальция с углём.
Получение
В настоящее время получают прокаливанием в электрических печах (температура 1900—1950 °C) смеси оксида кальция с коксом.
Полученный таким образом технический продукт имеет грязную окраску вследствие загрязнения углём и другими красящими примесями. Он содержит также примеси фосфида и сульфида кальция, вследствие чего такой карбид кальция и полученный из него ацетилен имеют неприятный запах.
Свойства
При соединении с водой разлагается, образуя ацетилен и гидроксид кальция (гашеную известь).
Применение
Карбид кальция широко применяют в технике для производства ацетилена, цианамида кальция (при нагревании с азотом), а также для восстановления щелочных металлов.
См. также
Полезное
Смотреть что такое «Карбид кальция» в других словарях:
КАРБИД КАЛЬЦИЯ — (ацетиленид кальция, СаС2), химическое вещество, получаемое в промышленных масштабах путем нагрева кокса и оксида кальция (извести, СаО) в электропечи. Реагирует с водой, выделяя этин (ацетилен, С2Н2) горючий газ, дающий яркое пламя. Благодаря… … Научно-технический энциклопедический словарь
КАРБИД КАЛЬЦИЯ — твердое непрозрачное кристаллическое вещество, изготовляемое искусственно в электропечах из смеси обожженной извести с чистым коксом или древесным углем. Служит гл. обр. для получения ацетилена, необходимого при сварке и резке металлов.… … Технический железнодорожный словарь
карбид кальция — (CaC2) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN calcium carbide … Справочник технического переводчика
Карбид кальция — CaC2, соединение кальция с углеродом; один из важнейших карбидов (См. Карбиды), применяемых в технике. Химически чистый К. к. бесцветен (технический от светло бурого до чёрного); плотность 2,2 г/см3 tпл 2300 °С. С водой взаимодействует с… … Большая советская энциклопедия
карбид кальция — углеродистый кальций … Cловарь химических синонимов I
Товарный карбид кальция — Охлажденный, раздробленный и упакованный технический карбид кальция Источник: ГОСТ 27698 88: Печи для производства карбида кальция. Показатели энергопотребления … Словарь-справочник терминов нормативно-технической документации
Условный карбид кальция — Карбид кальция литражом Lст = 300 дм3/кг Источник: ГОСТ 27698 88: Печи для производства карбида кальция. Показатели энергопотребления … Словарь-справочник терминов нормативно-технической документации
Физический карбид кальция — Карбид кальция на выпуске из печи литражом Lp Источник: ГОСТ 27698 88: Печи для производства карбида кальция. Показатели энергопотребления … Словарь-справочник терминов нормативно-технической документации
карбид — а, м. carbide m. <лат. carbo + гр. eidos вид спец. Соединение металла с углеродом. Карбид железа. Карбид кальция. БАС 1. Карбидный ая, ое. ♦ Карбидная лампа. Лампа, в которой горит ацетилен, получаем действием воды на карбид кальция. БАС 1.… … Исторический словарь галлицизмов русского языка
КАРБИД — зловонное вещество с чрезвычайно сильным удушливым запахом; соединение железа с углеродом. Полный словарь иностранных слов, вошедших в употребление в русском языке. Попов М., 1907. карбид карбида, м [лат. carbo уголь + гр. вид] (хим.). Соединения … Словарь иностранных слов русского языка
Карбид кальция
| Карбид кальция | |
|---|---|
  | |
| Систематическое наименование | Кальция карбид |
| Традиционные названия | Ацетиленид кальция; углеродистый кальций |
| Хим. формула | CaC2 |
| Рац. формула | CaC2 |
| Состояние | твёрдое |
| Молярная масса | 64,0994 (±0,004) г/моль |
| Плотность | 2,22 г/см³ |
| Т. плав. | 2160 °C |
| Т. кип. | 2300 °C |
| Координационная геометрия | 6 |
| Кристаллическая структура | Тетрагональная |
| ГОСТ | ГОСТ 1460-81 ГОСТ 1460-2013 |
| Рег. номер CAS | 75-20-7 |
| PubChem | 6352 |
| Рег. номер EINECS | 200-848-3 |
| SMILES | |
| RTECS | EV9400000 |
| ChemSpider | 6112 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Карбид кальция (углеродистый кальций, ацетиленид кальция) — CaC2 — в чистом виде белое кристаллическое вещество. Бинарное неорганическое соединение кальция с углеродом.
Содержание
История получения
Впервые получен в 1861 году Фридрихом Вёлером нагреванием сплава цинка и кальция с углём.
Получение
В настоящее время получают прокаливанием в электрических печах (температура 1900—1950 °C) смеси оксида кальция с коксом.
Полученный таким образом технический продукт имеет чисто-черный цвет вследствие загрязнения углём и другими красящими примесями. Он содержит также примеси фосфида и сульфида кальция, вследствие чего такой карбид кальция и полученный из него ацетилен имеют неприятный запах.
Физические свойства
Химические свойства
При взаимодействии c водой карбид кальция гидролизуется с образованием ацетилена и гидроксида кальция (гашёной извести):
Представленная выше реакция является экзотермической.
Внешний вид и характеристики технического карбида кальция
Карбид кальция получают сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид кальция выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определённых размеров.
Технический карбид кальция представляет собой твёрдое кристаллическое вещество. По внешнему виду карбид кальция представляет собой твёрдое вещество тёмно-серого или коричневого цвета. Он даёт кристаллический излом серого цвета с различными оттенками в зависимости от чистоты. Карбид кальция жадно поглощает воду. При взаимодействии с водой даже на холоде карбид кальция разлагается с бурным выделением ацетилена и большого количества тепла. Разложение карбида кальция происходит и под влиянием атмосферной влаги.
По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков карбида кальция: 2×8; 8×15; 15×25; 25×80. Технический карбид кальция содержит до 80 % химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнекислота и другое.
Область применения карбида кальция
Карбид кальция используют при проведении автогенных работ и освещения, а также в производстве ацетиленовой сажи и продуктов органического синтеза, из которых главным является синтетический каучук.
Карбид кальция применяют в производстве цианамида кальция, из которого получают удобрения, цианистые соединения. Карбид кальция используют для получения карбидно-карбамидного регулятора роста растений, изготовления порошкового карбидного реагента.
Из 1 кг технического карбида получается от 235 до 285 л ацетилена в зависимости от его сорта и грануляции: чем чище и крупнее карбид кальция, тем большее количество ацетилена он даёт при разложении.
Для разложения 1 кг карбида кальция теоретически требуется 0,56 л воды. Практически берут от 5 до 20 л воды с целью лучшего охлаждения ацетилена и обеспечения безопасности при работе. Скорость разложения карбида кальция водой зависит от его чистоты, грануляции, температуры и чистоты воды. Чем чище карбид кальция, меньше размер его кусков, выше температура и чище вода, тем больше скорость.

Содержание
История получения карбида кальция
Карбид кальция был получен случайно в 1862 г. Немецкий химик Фридрих Вёлер (Friedrich W?hler) при попытке выделения металлического кальция из извести (карбоната кальция СаСО3) путем длительного прокаливания смеси, состоящей из извести и угля, получил массу сероватого цвета, в которой не обнаружил признаков металла. Как результат неудавшегося эксперимента он выбросил эту массу на свалку во дворе. Во время дождя лаборант заметил выделение какого-то газа из выброшенной массы. Это заинтересовало Фридриха Вёлера, он провел анализ газа и установил, что это ацетилен (С2Н2), ранее открытый Эдмундом Дэви (Edmund Davy), в 1836 г.
Однако имя этому газу присвоил французский химик Пьер Эжен Марселен Бертло (Marcellin Berthelot) после того, как в 1863 году получил ацетилен, пропуская водород над раскалёнными электрической дугой графитовыми электродами.
Томас Уилсон (Thomas Leopold «Carbide» Willson) в 1888 году и Фердинанд Фредерик Анри Муассан (Ferdinand Frederic Henri Moissan) в 1892 независимо друг от друга открыли метод получения карбида кальция в дуговой электропечи, что послужило толчком для дальнейшего развития промышленного получения технического карбида кальция.
В России первые заводы по изготовлению карбида кальция были построены акционерным обществом «Перун» в 1908 г. в Земковицах, а в 1910 г. в Петербурге. В 1914 г. на этом заводе работали две карбидные печи мощностью по 500 кВт и две печи по 900 кВт.
В 1917 г. при Макеевском металлургическом заводе была построена установка с электропечью мощностью 1800 кВт. Почти одновременно на заводе в Баку для нужд нефтепромышленности и на Аллавердском медеплавильном заводе также были пущены карбидные печи.
В 1930 г. был построен и пущен первый большой карбидный завод в Растяпино (ныне г. Дзержинск Нижегородской области). На этом заводе карбид кальция впервые стал выпускаться не только как товарный продукт, но и для получения цианамида кальция.
Получение карбида кальция
Технический карбид кальция получают в результате взаимодействия обожженной извести (СаО) с коксом (3С) или антрацитом в электрических печах при температуре 1900-2300°С. Шихту, состоящую из смеси кокса или антрацита и извести в определенной пропорции, загружают в электропечь, шихта расплавляется, при этом происходит эндотермическая химическая реакция (с поглощением тепла) по формуле:
Таким образом, для получения 1 т карбида кальция требуется:
Однако вследствие значительных потерь энергии в карбидных печах практически для получения 1 т технического карбида кальция расходуется от 2800 до 3700 кВт·ч в зависимости от мощности печи. Если мощность печи меньше 1000 кВт, то расход электроэнергии может достичь 4000 кВт·ч/т и более.
Расплавленный карбид кальция сливают из печи в специальные изложницы, в которых он остывает и затвердевает. После затвердевания его дробят в щековых дробилках и сортируют в решетчатых барабанах на куски различной величины от 2 до 80 мм.
Выход кусков различных размеров при дроблении приведен ниже:
| Грануляция, мм | 25-80 | 15-25 | 8-15 | 2-8 | до 2 |
|---|---|---|---|---|---|
| Выход, % | 66-80 | 8-10 | 6-14 | 4,5-6,5 | 1,5-3,0 |
Товарным карбидом кальция считается грануляцией от 2 до 100 мм. Карбидная пыль, получающаяся при дроблении, непригодна для нормальных ацетиленовых генераторов из-за слишком энергической реакции с водой, перегрева и опасности взрыва.
Зависимость удельного веса технического карбида кальция от содержания в нем СаС2, приведена в таблице ниже:
| Содержание СаС2 в техническом карбиде, % | 80 | 75 | 70 | 65 | 60 | 55 |
|---|---|---|---|---|---|---|
| Удельный вес технического карбида | 2,32 | 2,37 | 2,41 | 2.45 | 2,49 | 2,53 |
Технический карбид кальция, получаемый в электропечах, содержит ряд примесей, попадающих в него из исходных материалов, которыми пользуются при его производстве. Средний химический состав применяемого для сварки:
| Компонент | Содержание, % (по массе) |
|---|---|
| Карбид кальция (СаС2) | 72,5 |
| Известь (СаО) | 17,3 |
| Окись магния (MgO) | 0,4 |
| Окись железа (Fe2O3) и окись алюминия (Al2O3) | 2,5 |
| Окись кремния (SiO2) | 2,0 |
| Сера (S) | 0,3 |
| Углерод (С) | 1,0 |
| Другие примеси | 4,0 |
Как видно из приведенного состава, основной примесью является известь.
Примеси, содержащиеся в исходных материалах, применяемых для производства, ухудшают его качество. Особенно вредными примесями являются фосфор и сера, которые переходят в карбид кальция в виде фосфористых и сернистых соединений кальция, а при разложении карбида попадают в ацетилен в виде фосфористого водорода и сероводорода.
Гидролиз или карбид кальция плюс вода
Экзотермическая реакция (т.е. с выделением тепла) взаимодействия карбида кальция с водой протекает бурно по уравнению:
Тепловой эффект реакции слагается из тепла, выделяемого при взаимодействии с водой карбида кальция и негашеной извести. Взаимодействие извести с водой протекает по уравнению:
Выход ацетилена объем ацетилена в литрах, выделяемый при разложении 1 кг карбида, приведенный к 20° и 760 мм рт. ст.
Для разложения 1 кг химически чистого карбида кальция теоретически необходимо 0,562 кг воды, при этом получается 0,406 кг ацетилена (285 л) и 1,156 кг гашеной извести.
Значительный тепловой эффект реакции карбида кальция и опасность перегрева ацетилена заставляют вести процесс с большим избытком воды для охлаждения. Это делает процесс более безопасным. Температура выходящего из генератора ацетилена при этом превышает температуру окружающей среды всего на 10-15°С.
Количество воды необходимое для реакции с карбидом кальция
Минимальное количество воды, необходимое для охлаждения при реакции 1 кг карбида кальция, может быть рассчитано следующим образом.
При разложении 1 кг 70%-го карбида кальция образуется 0,284 кг ацетилена и 1,127 кг гидрата окиси кальция т.е. гашеной извести (принимая содержание окиси кальция в карбиде кальция равным 24%).
Принимаем, что начальная температура воды равна 15° С, а температура в генераторе во время работы равна 60° С. Уравнение теплового баланса для 1 кг карбида кальция выражается следующим образом:
Искомый минимальный безопасный объем воды равен:
Как уже говорилось выше, технический карбид кальция обычно содержит не более 70-80% CaC2. Поэтому из 1 кг технического карбида кальция можно получить от 230 до 280 л ацетилена.
Если учесть потери ацетилена на растворение в воде и продувку ацетиленового генератора, то для получения 1 м 3 (1000 дм 3 ) ацетилена практически приходится расходовать 4,3-4,5 кг карбида кальция. Более точные данные о фактическом выходе ацетилена в зависимости от количества примесей (сорта) и размеров «кусков» (грануляции) указаны в ГОСТ 1460.
Параметры влияющие на скорость реакции с водой
Чем меньше размеры кусков, тем быстрее происходит реакция карбида кальция с водой.
Чем выше температура воды, тем быстрее идет реакция карбида кальция. Если вода сильно загрязнена гашеной известью, образующейся при реакции карбида кальция, то реакция замедляется.
При разложении неподвижного карбида кальция в недостаточном количестве воды куски его могут покрываться коркой гашеной извести и сильно перегреваться, при этом может иметь место реакция:
В этом случае реакция карбида кальция происходит за счет отнятия влаги, содержащейся в гашеной извести. В результате повышается плотность корки, что приводит к еще большему перегреву. Поэтому непрерывное удаление извести из зоны реакции имеет большое значение, так как перегрев может привести к взрыву ацетилено-воздушной смеси или вызвать взрывчатый распад ацетилена.
При погружении карбида кальция в воду процесс разложения протекает также весьма неравномерно: вначале реакция идет очень активно с бурным выделением ацетилена, а затем скорость реакции уменьшается. Это объясняется уменьшением поверхности кусков и тем, что они покрываются коркой извести, препятствующей свободному доступу воды.
При перемешивании воды с находящимся в ней карбидом кальция реакция происходит быстрее и равномернее.
Скорость реакции карбида кальция в воде зависит от чистоты карбида кальция и поверхности соприкосновения кусков карбида кальция с водой.
Скорость реакции карбида кальция в воде является весьма важным элементом, характеризующим качество карбида кальция. Для практических целей пользуются понятием продолжительности разложения.
Продолжительностью разложения считают время, в течение которого выделяется 98% от всего количества ацетилена, который может быть выделенным из карбида кальция, так как остаток разлагается очень медленно и не характеризует процесс разложения применительно к условиям работы ацетиленовых генераторов.
В таблице ниже приведены экспериментальные данные о продолжительности разложения карбида кальция в зависимости от размеров его кусков.
| Размеры кусков, мм | Пыль | 2/4 | 5/8 | 8/15 | 15/25 | 25/50 | 50/80 |
|---|---|---|---|---|---|---|---|
| Продолжительность разложения, мин. | Несколько секунд | 1,17 | 1,65 | 1,82 | 4,23 | 13,5 | 16,6 |
Следует, оговорить, что данные таблицы характеризуют лишь те образцы карбида кальция, с которыми были проведены опыты. Практически могут иметь место значительные отклонения, главным образом в сторону уменьшения скорости реакции.
Скорость разложения в значительной степени зависит от выхода ацетилена из карбида кальция. Чем ниже выход, тем меньше скорость реакции.
На диаграмме ниже показаны изменения в скорости разложения карбида кальция двух сортов с одинаковыми размерами кусков (25/50).
Карбид кальция плюс азот
При температуре 1000°С карбид кальция, взаимодействуя с азотом, образует цианамид кальция. Уравнение реакции имеет следующий вид:
Эта реакция используется для промышленного производства цианамида кальция. Цианамид кальция применяется в качестве удобрения и как исходный продукт для получения цианидов.
Карбид кальция плюс водород
С водородом карбид кальция вступает в реакцию при температуре выше 2200°С с образованием ацетилена и металлического кальция. При высокой температуре карбид кальция восстанавливает большинство окислов металлов.
Хранение карбида кальция
После того как был получен карбид кальция хранение его допускается в специальных герметичных барабанах и специально оборудованных помещениях, но все это уже рассмотрено в статье о том, где и как хранить карбид кальция.
Карбид кальция (CaC2): структура, свойства, производство, применение
Содержание:
Одна из его наиболее важных химических реакций CaC2 что происходит с водой H2Или, в котором образуется ацетилен HC≡CH. По этой причине его используют для получения ацетилена промышленным способом. Из-за такой же реакции с водой он используется для созревания фруктов, в ложных орудиях и военно-морских ракетах.
Реакция CaC2 с водой также образует полезный ил для приготовления клинкера (компонента цемента), который производит меньше диоксида углерода (CO2) по сравнению с традиционным методом производства цемента.
С азотом (N2) карбид кальция образует цианамид кальция, который используется в качестве удобрения. ЦК2 он также используется для удаления серы из некоторых металлических сплавов.
Некоторое время назад ЦК2 Он использовался в так называемых карбидных лампах, но они уже не очень распространены, потому что они опасны.
Состав
Кристаллическая структура CaC2 происходит от кубической (как хлорид натрия NaCl), но как ион C2 2- при удлинении структура искажается и становится тетрагональной.
Номенклатура
Свойства
Физическое состояние
Кристаллическое твердое вещество, которое в чистом виде бесцветно, но если оно загрязнено другими соединениями, оно может быть желтовато-белым или от сероватого до черного.
Молекулярный вес
Температура плавления
Точка кипения
ЦК2 кипит при 2300ºC с разложением. Точку кипения необходимо измерять в инертной атмосфере, то есть без кислорода и влаги.
Плотность
Химические свойства
Карбид кальция реагирует с водой с образованием ацетилена HC≡CH и гидроксида кальция Ca (OH).2:
Ацетилен легко воспламеняется, поэтому CaC в присутствии влаги2 он может быть легковоспламеняющимся. Однако когда он высохнет, это не так.
Карбид кальция реагирует с азотом N2 с образованием цианамида кальция CaCN2:
Получение
Карбид кальция производят промышленным способом в электродуговой печи из смеси карбоната кальция (CaCO3) и углерод (C), который подвергается воздействию температуры 2000 ° C. Реакция резюмируется следующим образом:
CaO + 3 C → CaC2 + CO ↑
В электродуговой печи электрическая дуга образуется между двумя графитовыми электродами, стойкими к высоким температурам. Получается карбид кальция с чистотой 80-85%.
Приложения
При производстве ацетилена
В промышленности реакция карбида кальция с водой используется для получения ацетилена C2ЧАС2.
Это наиболее важное применение карбида кальция. В некоторых странах высоко ценится ацетилен, так как он позволяет производить поливинилхлорид, который является разновидностью пластика. Кроме того, ацетилен используется для сварки при высоких температурах.
В сокращении выбросов CO2
Остатки, полученные от получения ацетилена из CaC2 (также называемый «осадок карбида кальция» или «остатки карбида кальция») используются для получения клинкера или бетона.
Грязь из карбида кальция имеет высокое содержание гидроксида кальция (Ca (OH)2) (около 90%), немного карбоната кальция (CaCO3) и имеет pH более 12.
По этим причинам он может реагировать с SiO.2 или Al2ИЛИ3 образуя продукт, аналогичный продукту, полученному в процессе гидратации цемента.
Один из видов деятельности человека, который производит больше выбросов CO2 это строительная отрасль. Сотрудничество2 он образуется на востоке, чтобы отделиться от карбоната кальция во время реакции с образованием бетона.
Использование осадка карбида кальция для замены карбоната кальция (CaCO3) было обнаружено, что снижает выбросы CO2 на 39%.
При получении цианамида кальция
Карбид кальция также используется в промышленности для получения цианамида кальция CaCN.2.
Цианамид кальция используется в качестве удобрения, потому что с почвенной водой он превращается в цианамид H2N = C = N, который обеспечивает растения азотом, важным для них питательным веществом.
В металлургической промышленности
Карбид кальция используется для удаления серы из таких сплавов, как ферроникель. CaC смешанный2 со сплавом, расплавленным при 1550 ° С. Сера (S) реагирует с карбидом кальция с образованием сульфида кальция CaS и углерода C:
Удаление серы благоприятно, если смешивание является эффективным и содержание углерода в сплаве низкое. Сульфид кальция CaS плавает на поверхности расплавленного сплава, откуда его сливают и выбрасывают.
В различных применениях
Карбид кальция использовался для удаления серы из железа. Также как топливо при производстве стали и как мощный раскислитель.
Его используют для созревания фруктов. Ацетилен образуется из карбида кальция с водой, который способствует созреванию фруктов, таких как бананы.
Карбид кальция используется в манекенах, чтобы вызвать характерный для них громкий хлопок. Здесь также используется образование ацетилена, который взрывается искрой внутри устройства.
ЦК2 он используется для генерации сигналов на море при самовоспламенении морских ракет.
Прекращенное использование
ЦК2 он использовался в так называемых карбидных лампах. Их действие заключается в капании воды на карбид кальция с образованием ацетилена, который воспламеняется и, таким образом, дает свет.
Эти лампы использовались на угольных шахтах, но их использование было прекращено из-за наличия метана CH4 в тех шахтах. Этот газ легко воспламеняется, и пламя карбидной лампы может воспламениться или взорваться.
Они широко использовались в сланцевых, медных и оловянных рудниках, а также в ранних автомобилях, мотоциклах и велосипедах в качестве фар или фар.
В настоящее время их заменяют электрические лампы или даже светодиодные лампы. Однако они по-прежнему используются в таких странах, как Боливия, на серебряных рудниках Потоси.
Риски
Карбид кальция CaC2 в сухом виде он не горюч, но в присутствии влаги быстро образует ацетилен, которым и является.
Для тушения пожара в присутствии CaC2 нельзя использовать воду, пену, углекислый газ или галогенные огнетушители. Следует использовать песок или гидроксид натрия или кальция.
Ссылки
История фотографии: избранные изобретатели и события
9 занятий для детей с образовательными потребностями




