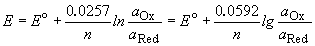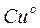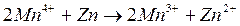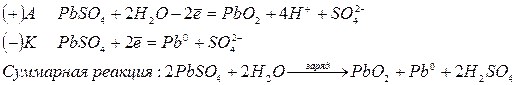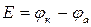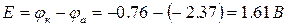СХЕМА РАБОТЫ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА И ТИПОВЫЕ ЗАДАЧИ
Фундаментальные законы физики и химии, и в том числе, закон сохранения массы и энергии вещества, находят свое подтверждение на уровне перемещения мельчайших частиц – электронов, массами которых в химии обычно пренебрегают.
Речь идет об окислительно-восстановительных процессах, сопровождающихся переходом электронов от одних веществ (восстановителей) к другим (окислителям). Причем вещества могут обмениваться электронами, непосредственно соприкасаясь друг с другом.
Однако существует множество случаев, когда прямого контакта веществ не происходит, а процесс окисления-восстановления все равно идет. А если он идет самопроизвольно, то при этом еще и энергия выделяется. Ее человек с успехом использует для выполнения электрической работы.
Реализуется такая возможность в гальваническом элементе, схема работы которого, а также расчеты, связанные с ним, рассматриваются в данной статье.
Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:
В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.
Возникает так называемый двойной электрический слой.
Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:
На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
Потенциал металла в растворе его же соли в момент равновесия записывают так:
Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu 2+ из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности. Сюда же подойдут сульфат-анионы SO4 2- и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.
Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
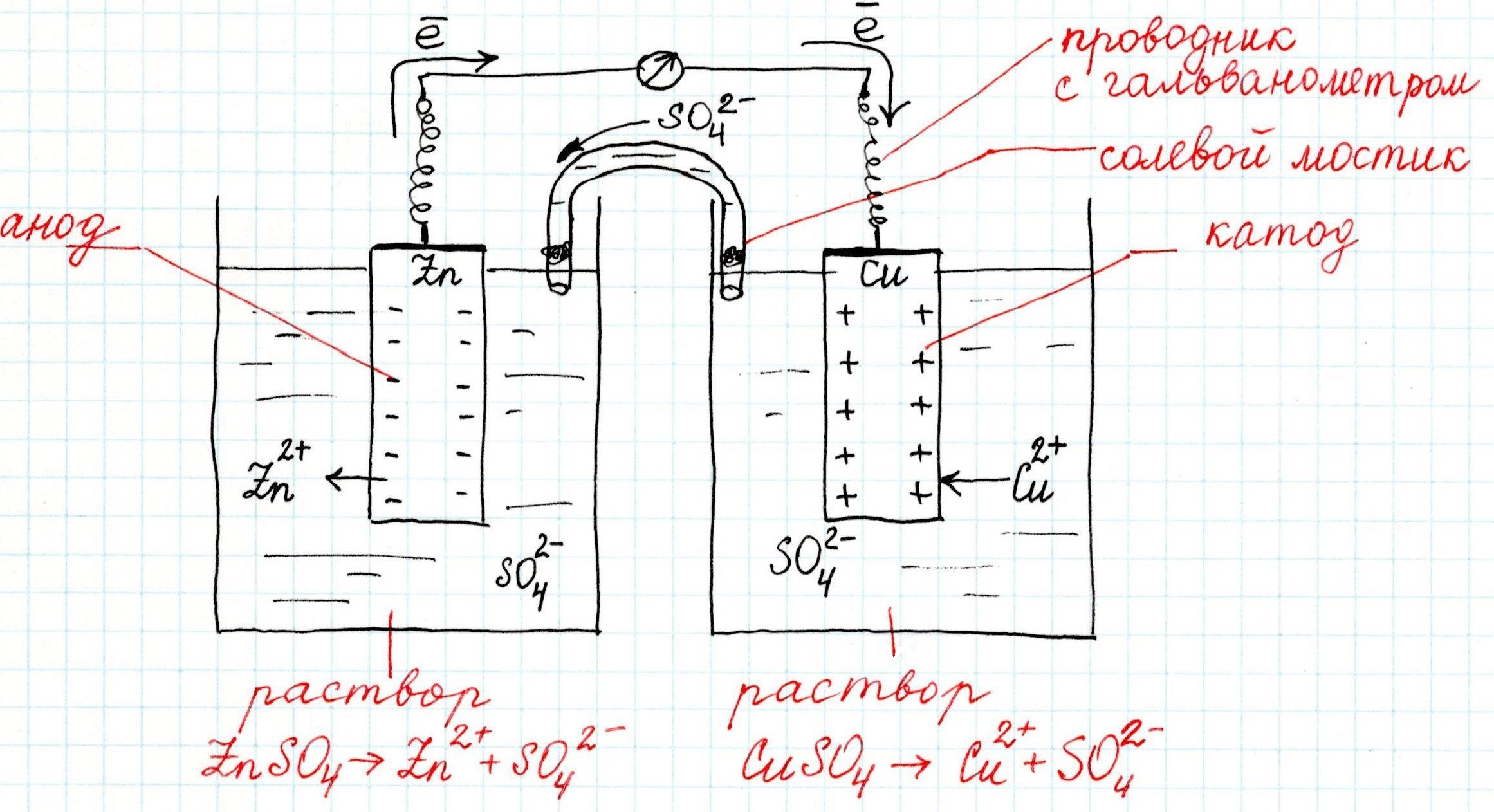
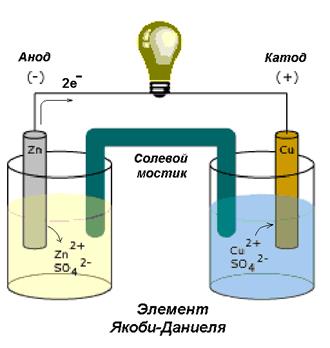
Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
Известно, что электрический ток – это направленное движение заряженных частиц (электронов).
На активном металле скапливаются электроны, а поверхность малоактивного металла, заряжается положительно. Если соединить проводником (например, металлической проволокой) оба металла, то электроны с одного перейдут на другой, а двойной электрический слой перестанет существовать. Это будет означать возникновение электрического тока.
Причем, ток возникает за счет окислительно-восстановительного процесса: активный металл окисляется (так как отдает электроны малоактивному), а малоактивный металл восстанавливается (так как принимает электроны от активного). Металлы друг с другом не соприкасаются, а взаимодействуют через посредника: внешнего проводника. Данная схема и есть схема гальванического элемента. Именно так устроен и работает гальванический элемент Даниэля-Якоби:
В схеме элемента показан «солевой мостик». Он представляет собой трубку, в которой присутствует электролит, не способный взаимодействовать ни с электродами (катодом или анодом), ни с электролитами в пространствах у электродов. Например, это может быть раствор сульфата натрия Na2SO4. Подобный мостик нужен для того, чтобы уравновешивать (нейтрализовать) заряды, образующиеся в растворах гальванического элемента.
Таким образом, возникшая электрическая цепь замыкается: анод → проводник с гальванометром → катод → раствор в катодном пространстве → «солевой мостик» → раствор в анодном пространстве → анод.
Анод – электрод, на котором происходит окисление (цинковая пластинка):
Электроны цинка Zn отправляются по внешней цепи (то есть по проводнику) на катод.
Катод – электрод, на котором происходит восстановление (медная пластинка):
В общем виде весь процесс окисления-восстановления в гальваническом элементе выглядит так:
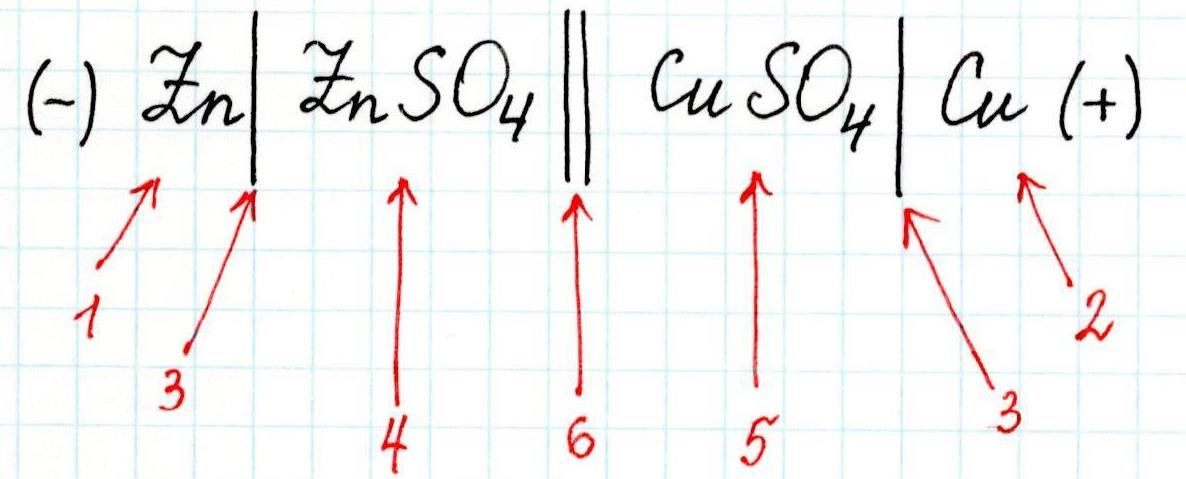
Для любого гальванического элемента можно составить запись в виде схемы. Например, для приведенного элемента Даниэля-Якоби она будет выглядеть так:
3 – скачок потенциала (граница раздела фаз);
4 – электролит в анодном пространстве;
5 – электролит в катодном пространстве;
6 – граница между растворами (солевой мостик).
Или сокращенно:
Типовые задачи на схему гальванического элемента: примеры решения
По вопросу, рассмотренному в данной статье, возможны два основных вида задач.
Задача 1. Составьте схему гальванического элемента, в котором протекает реакция:

Задача 2. Напишите электродные и суммарные уравнения реакций, протекающих в гальваническом элементе:

Итак, разобрав принцип работы гальванического элемента, мы научились записывать схему его работы и определять основные процессы на электродах.
Как написать гальванический элемент
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля):
Электродные полуреакции принято записывать как реакции восстановления (таблица 12.1), поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод: Cu 2+ + 2e = Cu
Левый электрод: Zn 2+ + 2e = Zn
Общая реакция: Cu 2+ + Zn = Cu + Zn 2+
Потенциал E электрода рассчитывается по формуле Нернста:
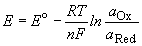
Стандартные электродные потенциалы электродов измеряются относительно стандартного водородного электрода, потенциал которого принят равным нулю. Значения некоторых стандартных электродных потенциалов приведены в таблице 12.1.
Электродвижущая сила (ЭДС) элемента равна разности потенциалов правого и левого электродов:
Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция.
Стандартная ЭДС равна разности стандартных потенциалов:
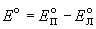
Для элемента Даниэля стандартная ЭДС равна
ЭДС элемента связана с 
Зная стандартную ЭДС, можно рассчитать константу равновесия протекающей в элементе реакции:
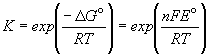
Константа равновесия реакции, протекающей в элементе Даниэля, равна
Зная температурный коэффициент ЭДС 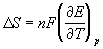

Таблица 12.1. Стандартные электродные потенциалы при 25 o С.
Электродная реакция
Пример 12-1. Рассчитать стандартный электродный потенциал пары Cu 2+ /Cu + по данным таблицы 11.1 для пар Cu 2+ /Cu и Cu + /Cu.
откуда E o = +0.153 В.
Пример 12-2. Составить схему гальванического элемента, в котором протекает реакция
Рассчитать стандартную ЭДС элемента при 25 o C, 
Правый электрод: Ag + + e = Ag E o = 0.7792 В
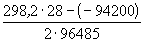
12-2. Рассчитать произведение растворимости и растворимость AgCl в воде при 25 o C по данным таблицы 12.1. (ответ)
12-3. Рассчитать произведение растворимости и растворимость Hg2Cl2 в воде при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-4. Рассчитать константу равновесия реакции диспропорционирования 2Cu + 
12-5. Рассчитать константу равновесия реакции ZnSO4 + Cd = CdSO4 + Zn при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-6. ЭДС элемента, в котором обратимо протекает реакция 0.5 Hg2Cl2 + Ag = AgCl + Hg, равна 0.456 В при 298 К и 0.439 В при 293 К. Рассчитать 


12-11. Три гальванических элемента имеют стандартную ЭДС соответственно 0.01, 0.1 и 1.0 В при 25 o C. Рассчитать константы равновесия реакций, протекающих в этих элементах, если количество электронов для каждой реакции n = 1. (ответ)
12-14. В гальваническом элементе обратимо протекает реакция CuSO4 + Zn = ZnSO4 + Cu. Рассчитать 



Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Алгоритм составления схемы гальванического элемента.
Федеральное бюджетное образовательное учреждение
Высшего профессионального образования
САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ
МОРСКОЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Гармашова И.В., Даниловская Л.П.
Методические указания для самостоятельной подготовки студентов к лабораторному занятию по теме
Гальванический элемент, электродные потенциалы
Санкт-Петербург
Краткие теоретические седения
В технике применяется два основных электрохимических процесса, имеющих общую природу:
§ получение электрической энергии за счет химических реакций (химические источники тока);
§ протекание химических реакций под действием электрического тока (электролиз).
Взаимное превращение электрической и химической форм энергии происходит в электрохимических системах, состоящих из:
– проводников первого рода – веществ, обладающих электронной проводимостью и находящихся в контакте с электролитом — металлов;
– проводников второго рода – веществ, обладающих ионной проводимостью – электролитов.
ПОНЯТИЕ ОБ ЭЛЕКТРОДНОМ ПОТЕНЦИАЛЕ
При погружении металла в раствор происходит переход катионов с металла в раствор или из раствора на металл. На границе раздела двух фаз (металл-раствор) происходит перенос электрического заряда, т.е. протекает электрохимическая реакция, которая приводит к возникновению скачка потенциала.
Металлическая пластинка, погруженная в раствор электролита, называется электродом.
Переход ионов прекращается после установления динамического равновесия, заключающегося в том, что скорость растворения ионов равна скорости обратного процесса – выделения их на поверхность металла.
Возьмем две металлические пластинки, например, цинковую и медную. При погружении цинковой пластинки, более активного металла, в раствор соли цинка ZnSO4 происходит отрыв ионов цинка Zn 2 + от кристаллической решетки металла под влиянием полярных молекул растворителя (рис.1). В результате перехода катионов в раствор металл приобретает отрицательный заряд за счет оставшихся на нем электронов, а прилежащий к нему слой раствора заряжается положительно за счет катионов, удерживаемых отрицательным зарядом металла. При погружении медной пластинки, менее активного металла, происходит процесс осаждения катионов из раствора на металле. Пластинка приобретает положительный заряд (рис. 1).
Рис. 1. Механизм возникновения электродного потенциала
Схема записи цинкового электрода: Zn|Zn 2+
Реакция, протекающая в элементе: 
Схема записи медного электрода: Cu 2+ |Cu
Реакция, протекающая в элементе: 
Переход заряженных частиц через границу «раствор-металл» сопровождается возникновением на границе раздела фаз двойного электрического слоя (ДЭС). ДЭС создается электрическими зарядами, находящимися на металле, и ионами противоположного заряда, ориентированными в растворе у поверхности электрода (рис.2).
Рис. 2 Структура двойного электрического слоя
б- распределение потенциала в ДЭС.
I – плотная часть ДЭС, II – диффузная часть ДЭС
Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода (φ). Эти потенциалы ограничивают процесс дальнейшего перемещения ионов с металла на металл. По мере удаления ионов от границы раздела величина потенциала в двойном электрическом слое убывает.
Потенциалы, возникающие на металлах, погруженных в растворы собственных солей, называются равновесными электродными потенциалами(φ р ).
Величина равновесного электродного потенциала зависит от природы электрода, температуры и концентрации ионов металла в растворе и выражается уравнением Нернста:

R – универсальная газовая постоянная (8,314 Дж/моль·К)
n– число электронов, участвующих в электродном процессе (или заряд катиона);
F – постоянная Фарадея (96,485 Кл/моль);
[Me n + ] – концентрация ионов Me n + в растворе (моль/л)
При температуре 25 0 C и множителя 2,303 для перехода от натуральных логарифмов и десятичным комбинация физических констант в уравнении (1) будет иметь вид:
Таким образом, уравнение Нернста примет вид:

Например, в электродной системе протекает полуреакция

Следовательно, уравнение Нернста для цинкового электрода можно записать как:
На металле, погруженном в электролит, не содержащий ионов этого металла (морская вода, раствор кислоты и т.п.), возникает неравновесный (коррозионный) потенциал ( 


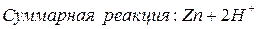
Значения абсолютных величин электродных потенциалов принципиально измерить невозможно. Следовательно, ограничиваются нахождением относительных величин электродных потенциалов по отношению к другому электроду, принятому в качестве стандартного электрода сравнения.
Основным стандартным электродом, потенциал которого условно принят за нуль, является водородный электрод(рис. 3). С ним сравнивают потенциалы других электродов.
Рис. 3. Схема устройства водородного электрода
Водородный электрод состоит из платиновой проволоки с приваренной к ней пластинки, покрытой платиновой чернью, погруженной в раствор кислоты с активностью ионов водорода, равной 1 моль/л. В сосуд подают химически чистый водород под давлением 1 атм.
Схема записи водородного электрода:
На границе раздела фаз устанавливается равновесие:
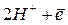
Уравнение Нернста для расчета величины водородного электродного потенциала (n=1) имеет вид:
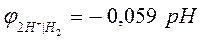
На практике для измерения электродных потенциалов металлов в качестве электрода сравнения не используют водородный электрод, т.к. он сложен в изготовлении и эксплуатации.
В качестве электрода сравнения используют хлорсеребряный электрод (см. приложение 2)
По величине стандартных электродных потенциалов (φ 0 ) металлические электроды располагаются в определенной последовательности, называемой электрохимическим рядом напряжений (см. приложение1).Положительные величины φ 0 указывают на то, что на данном электроде будет протекать реакция восстановления, а отрицательные величины φ 0 соответствуют тому, что на нем пойдет процесс окисления. Чем меньше значение φ 0 – потенциала, тем активнее металл.
Металлы с отрицательным значением потенциала вытесняют водород из растворов разбавленных кислот. Каждый металл способен вытеснять из растворов солей другие, менее активные металлы металлы, которые имеют большее алгебраическое значение потенциала. Так, если погрузить в раствор CuSO4 пластину из цинка, то часть ее растворится, а из раствора на поверхности пластины выделится красноватый слой меди:

Энергия этой окислительно-восстановительной реакции может быть превращена в электрическую энергию. Однако для этого необходимо пространственное разделение процессов окисления и восстановления.
Гальванические элементы относятся к химическим источникам электрического тока и позволяют получать ток за счет самопроизвольного протекания химической реакции.
Гальваническим элементомназывается обратимая электрохимическая система, состоящая из двух электродов, погруженных в раствор электролита, в которой энергия окислительно-восстановительного процесса превращается в электрическую.
Гальванический элемент состоит из двух электродов, различающихся величиной φ-потенциалов. Электрод с меньшим значением φ-потенциала является анодом, а электрод с бỏльшим значением потенциала – катодом.
Устройство и принцип работы гальванического элемента можно рассмотреть на примере электрохимического элемента Якоби-Даниэля (рис. 4).
Рис. 4. Устройство элемента Якоби-Даниэля
Такой элемент имеет электроды из цинка и меди, погруженные в сернокислые растворы этих металлов. Емкости соединены между собой солевым мостиком, заполненным раствором хлорида калия (KCl).
При замыкании цепи гальванического элемента между цинковым электродом и раствором электролита идет реакция окисления, т.е. цинковая пластинка растворяется:

Ионы цинка из электрода переходят в раствор, а на электроде остаются электроны. Следовательно, цинковая пластинка заряжается отрицательно и становится анодом.
Между медным электродом и окружающим его раствором CuSO4 идет реакция восстановления:

Ионы меди из раствора осаждаются на медном электроде, который приобретает положительный заряд и становится катодом.
ЗАПОМНИТЕ!О к и с л е н и е – отдача электронов – происходит н а а н о д е, в о с с т а н о в л е н и е – приобретение электронов – н а к а т о д е. В гальваническом элементе анод имеет знак «-», а катод имеет знак «+».
Для гальванического элемента принята следующая форма записи:
 |
Источником электрической энергии в элементе служит окислительно-восстановительная реакция, называемая суммарной или разрядной:
Cu 2+ + Zn = Cu + Zn 2+
Важнейшей характеристикой гальванического элемента является электродвижущая сила (ЭДС), которая определяется как предельная разность потенциалов, возникающая на границе раздела фаз в разомкнутой цепи элемента.
Э Д С – количественная характеристика эффективности работы гальванического элемента – она показывает, насколько полно осуществляется процесс перехода химической энергии в электрическую.
Величина Е всегда положительна (Е>0).
Для медно-цинкового гальванического элемента ЭДС равна:
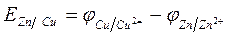
Работа гальванического элемента связана с уменьшением энергии Гиббса 



Рис. 5. Схема концентрационного элемента
Следовательно, при замыкании внешней цепи поток электронов устремится слева направо; в результате на правом электроде выделяется серебро, а левый электрод постепенно растворяется.
На отрицательном электроде (аноде) данного элемента протекает окисление серебра

А на положительном (катоде) – восстановление ионов раствора
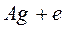
При этом в правой части элемента начнут накапливаться анионы 


где 
Алгоритм составления схемы гальванического элемента.
1.Записать схемы электродов.
2.Рассчитать величины электродных потенциалов металлов (φ1 и φ2), используя уравнение Нернста
3.Определить, зная, что φк > φа, металл электрода-анода и металл электрода-катода.
4.Составить схему гальванического элемента, используя принятую форму записи.
5.Записать уравнения катодной, анодной и суммарной реакций, идущих в элементе.
6.Рассчитать ЭДС гальванического элемента.
Гальванические элементы – это химические источники тока однократного действия. Применяются в виде сухих, наливных и топливных батарей.
ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА
Химические источники тока делятся на первичные и вторичные источники тока. Первичные источники не перезаряжаются, т.е. израсходованные активные материалы в них не могут быть регенерированы или заменены, и батарею электропитания приходится выбрасывать. Вторичная (аккумуляторная) батарея может быть перезаряжена. Израсходованные активные материалы в ней могут быть регенерированы, и такая батарея электропитания допускает многократное повторное использование.
Первичные источники тока
Сухой элемент Лекланше. Большинство первичных источников тока, выпускаемых в настоящее время промышленностью, относятся к сухим батареям электропитания. Около 25% сухих батарей выполнены на основе марганцово-цинкового элемента Лекланше – одного из первых сухих элементов.
В сухом элементе Лекланше (рис. 6) имеется графитовый положительный электрод, окруженный электролитом в виде смеси диоксида марганца (MnO2), графитового порошка, хлорида аммония (NH4Cl), хлорида цинка (ZnCl2) и воды. Эта смесь служит также деполяризующим агентом, предотвращающим образование газообразного водорода внутри элемента. Если не предотвратить образование водорода, то под давлением газа батарейка раздувается, в результате чего нарушается ее герметичность и из нее вытекает электролит. Электролит и графитовый электрод находятся в тонкостенном цинковом стаканчике, который, выполняя функции защитного корпуса, служит также отрицательным электродом батарейки.
Рис. 6. ГРАФИТОВО-ЦИНКОВЫЙ СУХОЙ ЭЛЕМЕНТ
1 –бесшовный цинковый стаканчик (отрицательный электрод); 2 – графитовый стержень (положительный электрод); 3 – деполяризующая смесь; 4 – пастообразный электролит.
В элементе Лекланше электричество вырабатывается за счет химического взаимодействия электролита с цинковым электродом, являющимся анодом. При подключении к зажимам батарейки внешней нагрузки, например лампочки карманного фонарика, через лампочку начинает проходить ток от цинкового электрода к графитовому. Ток не прекращается, пока не растворится почти весь цинк. После этого батарейка теряет работоспособность, и ее необходимо заменить.
Щелочной марганцово-цинковый сухой элемент.Щелочной марганцово-цинковый сухой элемент отличается от сухого элемента Лекланше главным образом тем, что в нем в качестве электролита используется высокоактивная щелочь КОН.
Схема записи элемента:
Реакции, идущие на катоде и аноде в марганцово-цинковом гальваническом элементе:
В щелочном элементе примерно вдвое больше активных веществ, чем в элементе Лекланше, и он очень подходит для многих устройств со сравнительно большой потребляемой мощностью, таких, как лампы-вспышки фотоаппаратов, вращательные электроприводы и мощные стереофонические звуковые системы. Щелочные элементы применяются примерно в 50% бытовой электронной аппаратуры.
Щелочной марганцово-цинковый элемент дает напряжение 1,5 В.
Топливные элементы.
Топливные элементымогут работать в непрерывном режиме без простоев для перезарядки, так как их активный материал (водород, СО2, уголь, жидкие и газообразные углеводороды) подводится из внешнего источника. Их электролит в процессе работы не изменяется. В топливных элементах энергия химических реакций, выделяющаяся в процессе окисления топлива, непосредственно преобразуется в электричество. Их теоретический КПД близок к 100%. т.к. окислительно-восстановительная реакция горения топлива используется непосредственно для прямого получения электрического тока в топливном элементе.
Топливные элементы в будущем могут использоваться как автономные источники тока для автомобилей и катеров, электрогенераторы для индивидуальных домашних хозяйств, переносные силовые блоки для инструментов и другого оборудования.
Электрическую энергию получают непрерывно до тех пор, пока в анодное пространство элемента не прекратится подача топлива, а в катодное – кислорода (или воздуха). Схема записи низкотемпературного Н2/О2 топливного элемента:
Вторичные источники тока
Вторичные ЭХГ – это аккумуляторы, в которых проходят обратимые процессы. Аккумуляторы перезаряжаются пропусканием постоянного тока в направлении, противоположном направлению тока в режиме разрядки. При этом активные соединения в элементе восстанавливаются в результате обратной химической реакции.
Свинцовый аккумулятор.Свинцовый аккумулятор – самый распространенный в настоящее время. Он был изобретен Ж.Планте в 1860 г. Аккумулятор состоит из положительного электрода (катода) – свинцовой пластинки с ячейками, заполненными пастообразным оксидом свинца PbO2. и отрицательного электрода (анода) – решетчатой пластинки, заполненной пастой из губчатого свинца. Каждый аккумулятор состоит из нескольких пар таких пластин, погруженных в электролит – разбавленный раствор серной кислоты – и соединенных последовательно. Напряжение заряженного элемента аккумулятора составляет 2 В. Состояние свинцового аккумулятора оценивается путем измерения относительной плотности электролита. Непосредственно после зарядки она составляет примерно 1,26, а по мере разрядки понижается почти до 1,0 (это объясняется тем, что серная кислота образует химическое соединение с материалом пластин, давая в остатке воду).
В процессе разряда аккумулятора, т.е. при его работе, на электродах протекают реакции:
Для заряда аккумулятора используют внешний источник тока, подключая его к электродам. В результате на электродах протекают процессы в обратном направлении:
Преимуществами свинцового аккумулятора являются: большая электрическая емкость, устойчивость к работе, большое количество циклов разряда – заряда. К недостаткам относятся: большая масса, малая удельная емкость, выделение водорода при заряде, негерметичность при наличии концентрированного раствора серной кислоты.
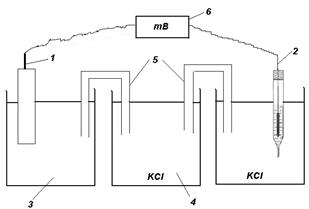
Для измерения электродного потенциала металла необходимо составить гальванический элемент (рис. 7) из исследуемого электрода (ИЭ) и электрода сравнения (ЭС). Для этого опустить ИЭ в раствор соли этого же металла или в морскую воду, а ЭС – в раствор хлорида калия (KCl) Затем с помощью электролитических мостиков соединить эти электроды через промежуточный сосуд с раствором хлорида калия. Это обеспечивает контакт электролитов, но препятствует их смешиванию.
Рис. 7 Схема установки для измерения ЭДС гальванического элемента:
1 –исследуемый электрод (ИЭ); 2 – хлорсеребряный электрод (ЭС);
3 – сосуд с электролитом (раствором соли, морской водой и т.д.);
4 – промежуточный сосуд с насыщенным раствором KCl; 5 – солевые мостики; 6 – прибор для измерения ЭДС.
Электроды ИЭ и ЭС подключают к измерительному прибору таким образом, чтобы стрелка прибора отклонялась вправо. После измерения ЭДС (Е) гальванического элемента можно рассчитать электродный потенциал металла по формуле
В качестве электрода сравнения в данной работе используют хлорсеребряный электрод (см. приложение 2). Потенциал этого электрода, измеренный по отношению к стандартному водородному электроду, составляет 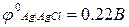
Так как φиэпо отношению к φэсможет быть как катодом, так и анодом, то φиэрассчитывается, соответственно:
А) φИЭ= 
Опыт 1. Влияние природы металла и состава электролита на величину электродного потенциала
Для работы использовать следующие металлы: Fe, Zn, Al, Cu, Mg.
Собрать гальванические элементы, состоящие из электрода сравнения и предложенных металлов в 1М растворах их солей. Измерить Е, рассчитать потенциалы исследуемых электродов и сравнить их с табличными данными (см. приложение 1). Измерить Е и рассчитать величины электродных потенциалов исследуемых металлов, погруженных в искусственную морскую воду. Результаты измерений занести в таблицу.
| Исследуемый металл | Электролит | Е,мВ | φМе, мВ |
| φ р | φ нр | φ о | |
| Fe | FeSO4 | — | |
| Морская вода | — | ||
| Zn | ZnSO4 | — | |
| Морская вода | — | ||
| Al | Al2(SO4)3 | — | |
| Морская вода | — | ||
| Cu | CuSO4 | — | |
| Морская вода | — | ||
| Mg | MgSO4 | — | |
| Морская вода | — |
Опыт2. Влияние концентрации электролита на величину электродного потенциала.
Собрать гальванический элемент, состоящий из хлорсеребряного электрода сравнения и медного электрода.
Определить характер изменения потенциала медного электрода в зависимости от концентрации раствора сульфата меди. Для работы использовать растворы CuSO4 следующих концентраций:
Записать в таблицу результаты измерений Е, рассчитать величины потенциалов медных электродов и сравнить полученные данные с теоретическими значениями потенциалов (по формуле Нернста) при тех же концентрациях растворов.
| Исследуемый электрод (ИЭ) | Концентрация CuSO4 (моль/л) | Е, мВ | φиэ, мВ |
| Экспериментальная величина | Теоретическая | ||
| Cu | 1M | ||
| 0,1M | |||
| 0,01M | |||
| 0,001M |
По полученным данным построить график экспериментальной и теоретической зависимости потенциала φ р от концентрации [Cu 2+ ]. Сделать вывод.
Опыт 3. Определение концентрации раствора соли.
Соберите гальванический элемент в соответствии с предложенной схемой записи:
A (-) Ag | AgCl, KCl║ MeA | Me (+) K
Измерьте с помощью высокоомного вольтметра величину ЭДС элемента. Рассчитайте величину равновесного потенциала исследуемого электрода 
Вопросы для самоконтроля по темам:
«Электродные потенциалы. Гальванический элемент»
1. Дайте определение понятия «электрод».
2. Дайте определение понятия «гальванический элемент».
3. Приведите схемы записи и полуреакции, протекающие в элементе для электродов:
4. Приведите примеры электродов сравнения.
5. Дайте определение понятиям:
— равновесный электродный потенциал;
— коррозионный электродный потенциал;
— стандартный электродный потенциал.
6. Приведите уравнение Нернста для расчета величины электродного потенциала для произвольного электрода и обозначьте входящие величины.
7. Укажите факторы, влияющие на величину электродного потенциала.
8. Приведите уравнение Нернста для расчета величины электродного потенциала для водородного электрода при известном значении pH.
9. Какой процесс протекает на катоде? на аноде?
10. Изобразите схематично гальванический элемент Якоби-Даниэля.
11. Запишите анодную, катодную и суммарную реакции, протекающие при работе гальванического элемента Якоби-Даниэля.
12. Приведите уравнение для расчета ЭДС гальванического элемента.
13. Каковы принципы составления гальванического элемента?
14. Приведите схему записи медно-цинкового гальванического элемента.
15. Приведите уравнения реакций, идущих на положительно и отрицательно заряженных электродах.
16. Приведите суммарную реакцию, идущую при работе медно-цинкового гальванического элемента.
17. Дайте определение понятия «концентрационный гальванический элемент.
18. Серебряные электроды погружены в растворы солей с концентрациями 0,1 М и 0.001 М. Назовите электрод-анод.
19. Приведите схему записи концентрационного гальванического элемента.
20. Приведите примеры первичных источников тока.
21. Приведите примеры вторичных источников тока.
22. Устройство элемента Лекланше.
23. Какие преимущества имеют топливные элементы по сравнению с другими источниками энергии?
24. Назовите вещества, используемые в топливных элементах в качестве реагентов.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1.Составить схему гальванического элемента, анодом которого является магний, погруженный в раствор соли с концентрацией 0,01М.
Решение.1. Записываем схему электрода: Mg|Mg 2+
2. По уравнению Нернста рассчитываем величину электродного потенциала:
3. Так как в условии задачи не указан материал, из которого изготовлен катод, то используя соотношение φк > φа, выбираем металл с более положительным потенциалом. Например, цинковый электрод. Значение потенциала выбранного электрода определяем по таблице «Стандартные электродные потенциалы металлов при 25 0 С».
Следовательно, 
4. Записываем схему гальванического элемента:
5. Записываем электродные реакции:
Суммарная реакция: Mg 0 + Zn 2+ ® Mg 2+ + Zn 0
6. Рассчитываем ЭДС гальванического элемента:
Пример 2.Составьте схему гальванического элемента, состоящего из водородного электрода, погруженного в раствор с рН =3 и железного электрода, погруженного в раствор соли с концентрацией 0.1М. Рассчитайте ЭДС элемента.
Решение.1. Записываем схемы электродов:
2. По уравнению Нернста рассчитываем величину электродного потенциала железного электрода:
3. Используя уравнение Нернста [3] рассчитываем величину электродного потенциала водородного электрода.

Таким образом, электродный потенциал водородного электрода можно записать следующим образом:
Так как величина φ-потенциала железного электрода меньше следовательно этот электрод является анодом:(-0,47 2+ ||2H + |H2 (+) K
6. Рассчитываем ЭДС гальванического элемента.
Задания для самоконтроля
1. Составьте схему гальванического элемента, состоящего из никелевого электрода-катода, погруженного в раствор соли с концентрацией 0.02М. Напишите уравнения электродных реакций и вычислите ЭДС гальванического элемента.
2. Составьте схему гальванического элемента, состоящего из медного электрода, погруженного в раствор соли меди с концентрацией 0.01М и железного электрода, погруженного в раствор соли железа с концентрацией 0.1М. Напишите уравнения электродных реакций. Вычислите ЭДС гальванического элемента.
3. Составьте схему гальванического элемента, состоящего из стандартного водородного электрода и ртутного электрода. Рассчитайте его ЭДС при [Hg 2+ ]=0,1 М. Напишите уравнения электродных реакций.
4. Составьте схему и рассчитайте ЭДС концентрационного гальванического элемента, составленного из двух железных электродов, погруженных в раствор соли железа с концентрациями 1 М и 0,01 М. Напишите уравнения электродных реакций.
5. В гальваническом элементе протекает химическая реакция
Напишите его схему и уравнения электродных реакций. Вычислите ЭДС этого элемента при стандартных условиях. Какой металл вместо никеля можно взять, чтобы увеличить ЭДС?
6. Составьте схему гальванического элемента, в котором протекает следующая реакция:

Вычислите ЭДС при стандартных условиях.
7. ЭДС элемента (Pt) H2|HCl||AgCl|Ag при 25 0 С равна 0.322 В. Чему равен рН раствора НСl? φAg = 0,22 В
8. Составьте схему гальванического элемента, состоящего из водородного электрода, погруженного в раствор с pH=5, и марганцевого электрода, погруженного в раствор соли марганца с концентрацией 0.2 М. Напишите уравнения электродных реакций и рассчитайте его ЭДС.
9. Составьте схему гальванического элемента, состоящего из водородного электрода, погруженного в раствор с pH=10, и серебряного электрода, погруженного в раствор соли серебра с концентрацией 0.01 М. Напишите уравнения электродных реакций и рассчитайте его ЭДС.
10. Напишите уравнения реакций, протекающих при работе медно-цинкового гальванического элемента. Укажите, как повлияют на электродвижущую силу этого элемента (повысят, понизят, оставят без изменения) следующие воздействия:
а) увеличение [Cu 2+ ] до 3 М;
б) добавление в катодное пространство NaOH для осаждения Cu(OH)2;
в) удваивание размера цинкового электрода;
г) уменьшение [Zn 2+ ] до 0.1 М;
д) повышение температуры.
11. Серебряную деталь с чернью из Ag2S поместили в оцинкованную емкость с мыльным раствором. Через некоторое время деталь стала блестящей, так как чернь полностью растворилась. Объясните, что послужило причиной растворения черни.
Приложение
Таблица № 1 Электрохимический ряд напряжений металлов (стандартные электродные потенциалы)

1- серебряная проволока; 2 – слой AgCl;
Схема записи электрода: Ag|AgCl, KCl насыщ.
Реакция, протекающая на электроде
Уравнение Нернста для расчета величины электродного потенциала:
1. Глинка Н.Л. Общая химия: Учебник. Л.: Химия. 1985
2. Коровин Н.В., Масленникова Г.Н. и др. Курс общей химии. М., Высшая школа. 1990.
3. Химия. Справочные материалы. Под ред. академика Ю.Д.Третьякова. М., «Просвещение». 1994.
4. Зимон А.Д., Лещенко Н.Ф. Физическая химия. М., Химия. 2000.
5. Трусов В.И., Соколова Л.Б. Введение в химию для судостроителей. Часть 2. Учебное пособие. С.-Петербург, 1997.
6. Даниловская Л.П. Электрохимические процессы в технике. Методические указания. С.-Петербург, 1993.
7. Грицкевич А.И. Решение типовых задач по курсу общей химии. Методические указания. С.-Петербург, 2006.