Типы химических реакций в органической химии
При протекании химических реакций происходит разрыв одних и возникновение других связей. Химические реакции условно делят на органические и неорганические. Органическими реакциям принято считать реакции, в которых, по крайней мере, одно из реагирующих веществ является органическим соединением, изменяющим свою молекулярную структуру в процессе реакции. Отличием органических реакций от неорганических является то, что, как правило, в них участвуют молекулы. Скорость таких реакции низка, а выход продукта обычно составляет всего лишь 50-80 %. Для повышения скорости реакции применяют катализаторы, повышают температуру или давление. Далее рассмотрим типы химических реакций в органической химии.
Классификация по характеру химических превращений
Реакции замещения
В ходе реакций замещения один атом или группа атомов в начальной молекуле замещается на иные атомы или группы атомов, образуя новую молекулу. Как правило, такие реакции характерны для насыщенных и ароматических углеводородов, например:
Реакции присоединения
При протекании реакций присоединения из двух или более молекул веществ образуется одна молекула нового соединения. Такие реакции характерны для ненасыщенных соединений. Различают реакции гидрирования (восстановления), галогенирования, гидрогалогенирования, гидратации, полимеризации и т.п:
Реакция элиминирования (отщепления)
В результате реакций отщепления органические молекулы теряют атомы или группы атомов, и образуется новое вещество, содержащее одну или несколько кратных связей. К реакциям элиминирования относятся реакции дегидрирования, дегидратации, дегидрогалогенирования и т.п.:
Реакции изомеризации и перегруппировка
В ходе таких реакций происходит внутримолекулярная перестройка, т.е. переход атомов или групп атомов с одного участка молекулы в другое без изменения молекулярной формулы вещества, участвующего в реакции, например:
Реакции окисления
В результате воздействия окисляющего реагента происходит повышение степени окисления углерода в органическом атоме, молекуле или ионе процесс за счет отдачи электронов, вследствие чего образуется новое соединение:
Реакции конденсации и поликонденсации
Заключаются во взаимодействии нескольких (двух и более) органических соединений с образованием новых С-С связей и низкомолекулярного соединения:
Поликонденсация – образование молекулы полимера из мономеров, содержащих функциональные группы с выделением низкомолекулярного соединения. В отличие от реакции полимеризации, в результате которых образуется полимер, имеющий состав, аналогичный мономеру, в результате реакций поликонденсации состав образованного полимера отличается от его мономера:
Реакции разложения
Это процесс расщепления сложного органического соединения на менее сложные или простые вещества:
Классификация химических реакций по механизмам
Протекание реакций с разрывом ковалентных связей в органических соединениях возможно по двум механизмам (т.е. пути, приводящему к разрыву старой связи и образованию новой) – гетеролитическому (ионному) и гомолитическому (радикальному).
Гетеролитический (ионный) механизм
В реакциях, протекающих по гетеролитическому механизму образуются промежуточные частицы ионного типа с заряженным атомом углерода. Частицы, несущие положительный заряд называются карбкатионы, отрицательный – карбанионы. При этом происходит не разрыв общей электронной пары, а ее переход к одному из атомов, с образованием иона:
Склонность к гетеролитическому разрыву проявляют сильно полярные, например Н–O, С–О и легко поляризуемые, например С–Вr, С–I связи.
Реакции нуклеофильного замещения
Характерны для алкил- и арилгалогенидов:
Реакции нуклеофильного присоединения
Реакции электрофильного замещения
Реакции электрофильного присоединения
Гомолитический (радикальный механизм)
В реакциях, протекающих по гомолитическому (радикальному) механизму на первой стадии происходит разрыв ковалентной связи с образованием радикалов. Далее образовавшийся свободный радикал выступает в качестве атакующего реагента. Разрыв связи по радикальному механизму свойственен для неполярных или малополярных ковалентных связей (С–С, N–N, С–Н).
Различают реакции радикального замещения и радикального присоединения
Реакции радикального замещения
Характерны для алканов
Реакции радикального присоединения
Характерны для алкенов и алкинов
Таким образом, мы рассмотрели основные типы химических реакций в органической химии
Типы химических реакций в органической химии
Реакции органических веществ можно формально разделить на четыре основных типа: замещения, присоединения, отщепления (элиминирования) и перегруппировки (изомеризации). Очевидно, что все многообразие реакций органических соединений невозможно свести к предложенной классификации (например, реакции горения). Однако такая классификация поможет установить аналогии с уже знакомыми вам реакциями, протекающими между неорганическими веществами.
Как правило, основное органическое соединение, участвующее в реакции, называют субстратом, а другой компонент реакции условно рассматривают как реагент.
Реакции замещения
Реакции замещения — это реакции, в результате которых осуществляется замена одного атома или группы атомов в исходной молекуле (субстрате) на другие атомы или группы атомов.
В реакции замещения вступают предельные и ароматические соединения, такие как алканы, циклоалканы или арены. Приведем примеры таких реакций.
Под действием света атомы водорода в молекуле метана способны замещаться на атомы галогена, например, на атомы хлора:
Другим примером замещения водорода на галоген является превращение бензола в бромбензол:
Уравнение этой реакции может быть записано иначе:
При этой форме записи реагенты, катализатор, условия проведения реакции записывают над стрелкой, а неорганические продукты реакции — под ней.
В результате реакций замещения у органических веществ образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
Реакции присоединения — это реакции, в результате которых две или более молекул реагирующих веществ соединяются в одну.
В реакции присоединения вступают ненасыщенные соединения, такие как алкены или алкины. В зависимости от того, какая молекула выступает в качестве реагента, различают гидрирование (или восстановление), галогенирование, гидрогалогенирование, гидратацию и другие реакции присоединения. Каждая из них требует определенных условий.
1.Гидрирование — реакция присоединения молекулы водорода по кратной связи:
2. Гидрогалогенирование — реакция присоединения галогенводорода (гидрохлорирование):
3. Галогенирование — реакция присоединения галогена:
4.Полимеризация — особый тип реакций присоединения, в ходе которых молекулы вещества с небольшой молекулярной массой соединяются друг с другом с образованием молекул вещества с очень высокой молекулярной массой — макромолекул.
Реакции полимеризации — это процессы соединения множества молекул низкомолекулярного вещества (мономера) в крупные молекулы (макромолекулы) полимера.
Примером реакции полимеризации может служить получение полиэтилена из этилена (этена) под действием ультрафиолетового излучения и радикального инициатора полимеразации R.
Наиболее характерная для органических соединений ковалентная связь образуется при перекрывании атомных орбиталей и образовании общих электронных пар. В результате этого образуется общая для двух атомов орбиталь, на которой находится общая электронная пара. При разрыве связи судьба этих общих электронов может быть разной.
Типы реакционноспособных частиц
Орбиталь с неспаренным электроном, принадлежащая одному атому, может перекрываться с орбиталью другого атома, на которой также находится неспаренный электрон. При этом происходит образование ковалентной связи по обменному механизму:
Обменный механизм образования ковалентной связи реализуется в том случае, если общая электронная пара образуется из неспаренных электронов, принадлежащих разным атомам.
Процессом, противоположным образованию ковалентной связи по обменному механизму, является разрыв связи, при котором к каждому атому отходит по одному электрону (гомолитический тип разрыва). В результате этого образуются две незаряженные частицы, имеющие неспаренные электроны:

Такие частицы называются свободными радикалами.
Свободные радикалы — атомы или группы атомов, имеющие неспаренные электроны.
Свободнорадикальные реакции — это реакции, которые протекают под действием и при участии свободных радикалов.
В курсе неорганической химии это реакции взаимодействия водорода с кислородом, галогенами, реакции горения. Реакции этого типа отличаются высокой скоростью, выделением большого количества тепла.
Ковалентная связь может образоваться и по донорно-акцепторному механизму. Одна из орбиталей атома (или аниона), на которой находится неподеленная электронная пара, перекрывается с незаполненной орбиталью другого атома (или катиона), имеющего незаполненную орбиталь, при этом формируется ковалентная связь, например:
Разрыв ковалентной связи приводит к образованию положительно и отрицательно заряженных частиц (гетеролитический разрыв); так как в данном случае оба электрона из общей электронной пары остаются при одном из атомов, у другого атома получается незаполненная орбиталь:
Рассмотрим электролитическую диссоциацию кислот:
Нуклеофилы (Nu) — анионы или молекулы, имеющие неподеленную пару электронов, взаимодействующие с участками молекул, на которых сосредоточен эффективный положительный заряд.
Примеры нуклеофилов: Сl — (хлорид-ион), ОН — (гидроксид-анион), СН3O — (метоксид-анион), СН3СОО — (ацетат-анион).
Частицы, имеющие незаполненную орбиталь, напротив, будут стремиться заполнить ее и, следовательно, будут притягиваться к участкам молекул, на которых присутствует повышенная электронная плотность, отрицательный заряд, неподеленная электронная пара. Они являются электрофилами, «друзьями» электрона, отрицательного заряда или частиц с повышенной электронной плотностью.
Электрофилы — катионы или молекулы, имеющие незаполненную электронную орбиталь, стремящиеся к заполнению ее электронами, так как это приводит к более выгодной электронной конфигурации атома.
Электрофилом с незаполненной орбиталью является не любая частица. Так, например, катионы щелочных металлов имеют конфигурацию инертных газов и не стремятся к приобретению электронов, так как имеют низкое сродство к электрону.
Из этого можно сделать вывод, что несмотря на наличие у них незаполненной орбитали, подобные частицы не будут являться электрофилами.
Основные механизмы протекания реакций
Выделено три основных типа реагирующих частиц — свободные радикалы, электрофилы, нуклеофилы — и три соответствующих им типа механизма реакций:
Кроме классификации реакций по типу реагирующих частиц, в органической химии различают четыре вида реакций по принципу изменения состава молекул: присоединения, замещения, отщепления, или элиминирования (от англ. to eliminate — удалять, отщеплять) и перегруппировки. Так как присоединение и замещение могут происходить под действием всех трех типов реакционноспособных частиц, можно выделить несколько основных механизмов протекания реакций.
Кроме того, рассмотрим реакции отщепления, или элиминирования, которые идут под воздействием нуклеофильных частиц — оснований.
6. Элиминирование:
Можно считать, что в этой реакции происходит отщепление молекулы бромводорода от молекулы 2-бромпропана. В присутствии щелочи образуются бромид натрия и вода.
Правило В. В. Марковникова
Отличительной чертой алкенов (непредельных углеводородов) является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
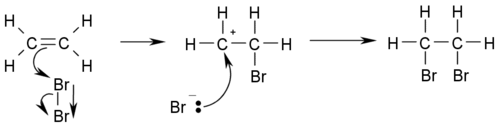
Гидрогалогенирование (присоединение галоген водорода):
При присоединении галогенводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
Реакции присоединения
Из Википедии — свободной энциклопедии
Реакции присоединения (англ. addition reaction ) — в органической химии так называются химические реакции, в которых одни химические соединения присоединяются к кратным (двойным или тройным) связям другого химического соединения. Присоединение может осуществляться как по связи углерод-углерод, так и по связи углерод-гетероатом. Реакции присоединения обозначают английскими буквами «Ad».
Общий вид реакций присоединения по связи углерод-углерод:
− C | = C | − + X − Y → − C X | − C Y | − <\displaystyle <\mathsf <-<\stackrel <|>
− C ≡ C − + X − Y → − C X = C Y − <\displaystyle <\mathsf <-C>>\!\!\equiv \!<\mathsf <\!C\!\!-+\ X\!\!-\!\!Y>>\rightarrow <\mathsf <-CX\!\!=\!\!CY\!\!->>>
Общий вид реакций присоединения по связи углерод-кислород:
− C | = O + X − Y → − C Y | − O X <\displaystyle <\mathsf <-<\stackrel <|>
Обычно, реагент, к которому происходит присоединение называют субстратом, а другой («Х-Y») — атакующим реагентом.
Примером реакции присоединения может служить бромирование этилена:
В зависимости от природы атакующей частицы и механизма реакции различают нуклеофильное, электрофильное, радикальное или синхронное присоединение.
Как написать реакции присоединения
Классификацию органических реакций проводят на основе общих для всех реакций признаков: строение и состав исходных и конечных продуктов; изменение степеней окисления реагирующих частиц; тепловой эффект реакции; ее обратимость и т.п.
Наиболее часто органические реакции классифицируют по следующим признакам:
· по конечному результату реакции (на основе сопоставления строения исходных и конечных продуктов);
· по минимальному числу частиц, участвующих в элементарной реакции;
· по механизму разрыва ковалентных связей в реагирующих молекулах.
Тип многостадийных реакций определяют по самой медленной (лимитирующей) стадии. Различные способы классификации часто сочетаются друг с другом.
1. Классификация реакций по конечному результату
В основе этой классификации лежит сопоставление числа, состава и строения исходных и конечных продуктов по уравнению реакции. В соответствии с конечным результатом различают следующие типы органических реакций:
Если процесс сопровождается изменением степени окисления атома углерода в органическом соединении, то выделяют также реакции окисления и восстановления. Окисление и восстановление органических веществ может проходить по какому-либо из названных выше типов реакций.
Атом или атомная группировка в молекуле органического соединения замещается на другой атом (или атомную группировку):
Реакции этого типа можно рассматривать как реакции обмена, но в органической химии предпочтительней термин «замещение», поскольку в обмене участвует (замещается) лишь меньшая часть органической молекулы.
C2H6 + Cl2 (на свету) → CH 3 CH 2 Cl + HCl хлорирование этана
CH 3 CH 2 Cl + KOH (водн. р-р) → CH 3 CH 2 OH + KCl щелочной гидролиз хлорэтана
В реакциях присоединения молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при этом другие продукты реакции не образуются:
К реакциям присоединения относятся также реакции полимеризации:
В реакции отщепления (элиминирования) происходит отрыв атомов или атомных групп от молекулы исходного вещества при сохранении ее углеродного скелета.
· отщепление хлороводорода (при действии на хлоралкан спиртовым раствором щёлочи)
· отщепление воды (при нагревании спирта с серной кислотой)
CH3-CH2OH → CH 2 =CH 2 + H 2 O дегидратация этанола
· отщепление водорода от алкана (в присутствии катализатора)
Реакции изомеризации или перегруппировки
В органическом соединении происходит переход (миграция) отдельных атомов или групп атомов от одного участка молекулы к другому без изменения ее качественного и количественного состава:
В этом случае исходное вещество и продукт реакции являются изомерами (структурными или пространственными).
Например, в результате перегруппировки может изменяться углеродный скелет молекулы:
В результате реакции разложения из молекулы сложного органического вещества образуется несколько менее сложных или простых веществ:
К этому типу реакций относится процесс крекинга – расщепление углеродного скелета крупных молекул при нагревании и в присутствии катализаторов:
Реакции разложения при высокой температуре называют пиролизом, например:
СН4 → C + 2H2 пиролиз метана (1000 o C)
Реакции окисления и восстановления
Если атом углерода в органической молекуле окисляется (отдает электроны более электроотрицательному атому), то этот процесс относят к реакциям окисления, т.к. продукт восстановления окислителя (обычно неорганическое вещество) не является конечной целью данной реакции. И наоборот, реакцией восстановления считают процесс восстановления атома углерода в органическом веществе.
Часто в органической химии ограничиваются рассмотрением реакций окисления и восстановления как реакций, связанных с потерей и приобретением атомов водорода и кислорода.
Вещество окисляется, если оно теряет атомы H и (или) приобретает атомы O. Кислородсодержащий окислитель обозначают символом [O]:
Вещество восстанавливается, если оно приобретает атомы H и (или) теряет атомы O. Восстановитель обозначают символом [H]:
Классификация реакций по числу частиц, участвующих в элементарной стадии
По этому признаку все реакции можно разделить на диссоциативные (мономолекулярные) и ассоциативные (бимолекулярные, тримолекулярные).
· Мономолекулярные реакции – реакции, в которых участвует только одна молекула (частица):
К этому типу относятся реакции распада и изомеризации. Процессы электролитической диссоциации также соответствуют этому типу, например:
Это самый распространенный тип элементарных реакций.
· Тримолекулярные реакции – реакции типа
в которых происходит столкновение трех молекул.
Тримолекулярные реакции встречаются довольно редко. Одновременное соударение большего числа частиц маловероятно.
Классификация реакций по механизму разрыва связей
В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются нарадикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, наэлектрофильные и нуклеофильные.
Разрыв ковалентной связи может происходить двумя способами, обратными механизмам ее образования.
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
Электрофильной называется реакция, в которой молекула органического вещества подвергается действию электрофильного реагента.
Электрофильные («любящие электроны») реагенты или электрофилы – это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне.
CH2=CH2 + HCl → CH3CH2Cl (электрофил – H + в составе HCl)
Механизм электрофильного присоединения обозначается символом AdE (по первым буквам английских терминов: Ad – addition [присоединение], E – electrophile [электрофил]).
Катион NO2 + образуется в смеси конц. кислот HNO3 и H2SO4.
Обозначение механизма – SE (S – substitution [замещение]).
Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента.
Строение некоторых нуклеофильных реагентов
Благодаря подвижности π-электронов, нуклеофильными свойствами обладают также молекулы, содержащие π-связи:
(Между прочим, это объясняет, почему этилен CH2=CH2 и бензол C6H6, имея неполярные углерод-углеродные связи, вступают в ионные реакции с электрофильными реагентами).
Примеры нуклеофильных реакций
Механизм нуклеофильного замещения обозначается символом SN (по первым буквам английских терминов: S – substitution [замещение], N – nucleophile [нуклеофил]).
Обозначение механизма – AdN (Ad – addition [присоединение]).