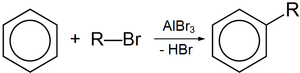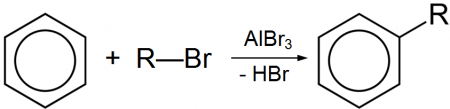Бромид алюминия
| Бромид алюминия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Бромид алюминия |
| Химическая формула | AlBr3, Al2Br6 |
| Эмпирическая формула | AlBr3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 266,69 г/моль |
| Плотность | 3,205 [1] г/см³ |
| Термические свойства | |
| Температура плавления | 97,5 [1] °C |
| Температура кипения | 255 [2] °C |
| Энтальпия образования (ст. усл.) | − 514; − 422 (AlBr3, газ); − 971(Al2Br6, газ) [3] кДж/моль |
| Структура | |
| Кристаллическая структура | моноклинная |
| Классификация | |
| Рег. номер CAS | 7727-15-3 |
| Рег. номер EINECS | 231-779-7 |
Броми́д алюми́ния (бромистый алюминий) — это неорганическое бинарное соединение. Химическая формула 
Содержание
Физические свойства
Безводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
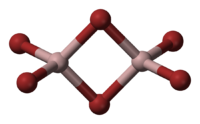
В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно.
Химические свойства
Получение
Безводный бромид алюминия получают взаимодействием элементов (Al и Br2) при нагревании:
Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:
Применение
Коммерческое применение бромида алюминия в настоящий момент относительно небольшое.
Безводный бромид алюминия используется в органическом синтезе, в частности, в реакции алкилирования по Фриделю-Крафтсу, по аналогии с хлоридом алюминия.
Соединение может выступать катализатором в реакции изомеризации бромалканов, например [12] :
Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом [13] :
Опасность для здоровья
При контакте с кожей бромид алюминия может вызывать ожоги.
Бромид алюминия (III)
Al 2 Br 6
AlBr 3 · 6H 2 O (гексагидрат)
374,785 г / моль (гексагидрат)
2,54 г / см 3 (гексагидрат)
93 ° C (гексагидрат)
СОДЕРЖАНИЕ
Состав
Димерная форма трибромида алюминия (Al 2 Br 6 ) преобладает в твердом состоянии, в растворах в некоординирующих растворителях (например, CS 2 ), в расплаве и в газовой фазе. Только при высоких температурах эти димеры распадаются на мономеры:
Al 2 Br 6 → 2 AlBr 3 ΔH ° dis = 59 кДж / моль
Видовой монобромид алюминия образуется в результате реакции HBr с металлическим Al при высокой температуре. Он диспропорционирует вблизи комнатной температуры:
Синтез
В качестве альтернативы также происходит прямое бромирование:
Реакции
Трибромид алюминия реагирует с четыреххлористым углеродом при 100 ° C с образованием тетрабромида углерода :
Безопасность
Алюминий бромистый
Алюминий бромистый
Бесцветное кристаллическое вещество.
ФИЗИЧЕСКИЕ СВОЙСТВА
Безводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно.
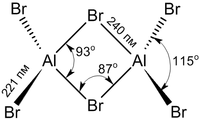
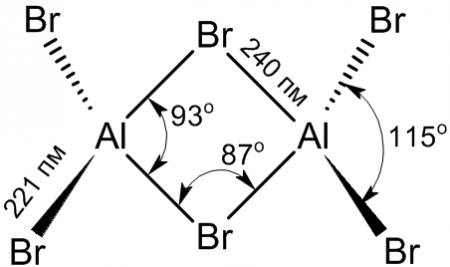
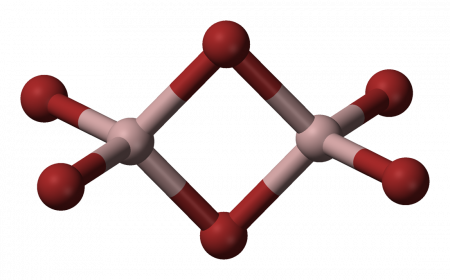
Структура молекулы бромида алюминия Al2Br6 представляет собой сдвоенные тетраэдры, в центре которых расположены атомы алюминия, ковалентно связанные с атомами брома.
Координационное число алюминия в молекуле бромида равно 4.
Энергия разрыва связи Al—Br в молекуле бромида алюминия составляет примерно 358 кДж/моль.
Вещество очень гигроскопично: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr3•6H2O. Хорошо растворимо в воде, спирте, сероуглероде, ацетоне; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор).
ПОЛУЧЕНИЕ
Безводный бромид алюминия получают взаимодействием элементов (Al и Br2) при нагревании, водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой.
ПРИМЕНЕНИЕ
Коммерческое применение бромида алюминия в настоящий момент относительно небольшое.
Бромид алюминия входит как основной компонент в состав ксилольных электролитов для электроосаждения алюминиевых покрытий.
Безводный бромид алюминия используется в органическом синтезе, в частности, в реакции алкилирования по Фриделю-Крафтсу, по аналогии с хлоридом алюминия.
Соединение может выступать катализатором в реакции изомеризации бромалканов.
Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом
Как составить формулу бромида алюминия
Бромид алюминия
 |  |
наименование
− 422 (AlBr3, газ);
− 971(Al2Br6, газ) кДж/моль


Содержание
Физические свойства
Безводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно.
Структура молекулы бромида алюминия Al2Br6 представляет собой сдвоенные тетраэдры, в центре которых расположены атомы алюминия, ковалентно связанные с атомами брома.
Координационное число алюминия в молекуле бромида равно 4.
Энергия разрыва связи Al—Br в молекуле бромида алюминия составляет примерно 358 кДж/моль.
Вещество очень гигроскопично: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr3•6H2O. Хорошо растворимо в воде, спирте, сероуглероде, ацетоне; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор).
Химические свойства
AlBr3 + 4 H2O ⇆ [Al(H2O)4] 3+ + 3Br − [Al(H2O)4] 3+ + H2O ⇆ [Al(H2O)3(OH)] 2+ + H3O + При нагревании водного раствора гидролиз можно провести полностью: AlBr3 + 3 H2O = Al(OH)3 ↓ + 3 HBr ↑
AlBr3 + 3 NaOH = Al(OH)3 ↓ + 3 NaBr AlBr3 + 4 NaOH = Na[Al(OH)4] + 3 NaBr
2 AlBr3 = 2 Al + 3 Br2 При нагревании бромида алюминия с алюминием в газовой фазе (1000 °C) образуется нестабильный монобромид алюминия: AlBr3 + 2 Al ⇆ 3 AlBr
AlBr3 + 4 LiH = Li[AlH4] + 3 LiBr
Получение
Безводный бромид алюминия получают взаимодействием простых веществ (Al и Br2):
Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:
2 Al + 6 HBr = 2 AlBr3 + 3 H2 ↑
Применение
Коммерческое применение бромида алюминия в настоящий момент относительно небольшое.
Бромид алюминия входит как основной компонент в состав ксилольных электролитов для электроосаждения алюминиевых покрытий.
Безводный бромид алюминия используется в органическом синтезе, в частности, в реакции алкилирования по Фриделю-Крафтсу, по аналогии с хлоридом алюминия.
Соединение может выступать катализатором в реакции изомеризации бромалканов, например:
Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом:
Опасность для здоровья
При контакте с кожей бромид алюминия может вызывать ожоги.
Соединение умеренно ядовито: ЛД 50 (крысы) ≈ 1600 мг/кг (перорально); ЛД50 (крысы) ≈ 815 мг/кг (внутрибрюшинно).
Бромид алюминия
| Бромид алюминия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Бромид алюминия |
| Химическая формула | AlBr3, Al2Br6 |
| Эмпирическая формула | AlBr3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 266,69 г/моль |
| Плотность | 3,205 [1] г/см³ |
| Термические свойства | |
| Температура плавления | 97,5 [1] °C |
| Температура кипения | 255 [2] °C |
| Энтальпия образования (ст. усл.) | − 514; − 422 (AlBr3, газ); − 971(Al2Br6, газ) [3] кДж/моль |
| Структура | |
| Кристаллическая структура | моноклинная |
| Классификация | |
| Рег. номер CAS | 7727-15-3 |
| Рег. номер EINECS | 231-779-7 |
Броми́д алюми́ния (бромистый алюминий) — это неорганическое бинарное соединение. Химическая формула 
Содержание
Физические свойства
Безводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно.
Химические свойства


Получение
Безводный бромид алюминия получают взаимодействием элементов (Al и Br2) при нагревании:
Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:
Применение
Коммерческое применение бромида алюминия в настоящий момент относительно небольшое.
Безводный бромид алюминия используется в органическом синтезе, в частности, в реакции алкилирования по Фриделю-Крафтсу, по аналогии с хлоридом алюминия.
Соединение может выступать катализатором в реакции изомеризации бромалканов, например [12] :
Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом [13] :
Опасность для здоровья
При контакте с кожей бромид алюминия может вызывать ожоги.
Бромид алюминия
Бромид алюминия — это неорганическое бинарное соединение. Химическая формула 
| Бромид алюминия | |
|---|---|
| Общие | |
| Систематическое наименование | Бромид алюминия |
| Хим. формула | AlBr3, Al2Br6 |
| Рац. формула | AlBr3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 266,69 г/моль |
| Плотность | 3,205 |
| Термические свойства | Температура |
| • плавления | 97,5 |
| • кипения | 255 °C | Энтальпия |
| • образования | − 514; − 422 (AlBr3, газ); − 971(Al2Br6, газ) кДж/моль |
| Структура | |
| Кристаллическая структура | моноклинная |
| Классификация | |
| Рег. номер CAS | 7727-15-3 |
| PubChem | 24409 |
| Рег. номер EINECS | 231-779-7 |
| SMILES | |
| RTECS | BD0350000 |
| Номер ООН | 1725 |
| ChemSpider | 22818 |
| Безопасность | |
| Пиктограммы ECB |    |
| NFPA 704 | Физические свойстваБезводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C. В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно. Структура молекулы бромида алюминия Al2Br6 представляет собой сдвоенные тетраэдры, в центре которых расположены атомы алюминия, ковалентно связанные с атомами брома. Координационное число алюминия в молекуле бромида равно 4. Энергия разрыва связи Al—Br в молекуле бромида алюминия составляет примерно 358 кДж/моль. Вещество очень гигроскопично: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr3•6H2O. Хорошо растворимо в воде, спирте, сероуглероде, ацетоне; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор). Химические свойстваПолучениеБезводный бромид алюминия получают взаимодействием простых веществ (Al и Br2): Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой: Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом: Опасность для здоровьяПри контакте с кожей бромид алюминия может вызывать ожоги. Соединение умеренно ядовито: ЛД50 (крысы) ≈ 1600 мг/кг (перорально); ЛД50 (крысы) ≈ 815 мг/кг (внутрибрюшинно). Теперь вы знаете какие однокоренные слова подходят к слову Как пишется бромид алюминия, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову "Как пишется бромид алюминия", предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором. |