Соединения хлора
Хлороводород, соляная кислота (HCl)
Способы получения хлороводорода
Промышленный способ:
Лабораторный способ:
В лаборатории HCl получают действием концентрированной H2SO4 на хлориды:
Физические свойства хлороводорода
HCl хорошо растворяется в воде: при обычной температуре в 1 л воды растворяется
450 л газа (реакция экзотермическая). Насыщенный раствор содержит 36-37 % HCl по массе, имеет резкий, удушающий запах.
Химические свойства хлороводорода
Газообразный HCl
Безводный НСl химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Что означает, что в отсутствие воды хлороводород не проявляет кислотных свойств.
И только при очень сильном нагревании газообразный HCl реагирует с металлами, даже такими малоактивными, как Сu и Аg.
Восстановительные свойства HCl проявляются также в малой степени:
Раствор HCl
Водный раствор HCl является сильной кислотой, т.к. молекулы HCl практически полностью распадаются на ионы:
Общие свойства кислот
Он проявляет все свойства кислот:
Вступает в реакции с органическими соединениями:
с аминами:
с аминокислотами:
Кислородсодержащие кислоты галогенов
Хлорноватистая кислота (HClO) и ее соли
Хлорноватистая кислота очень слабая кислота и существует только в разбавленных водных растворах.
Получение хлорноватистой кислоты:
Химические свойства хлорноватистой кислоты:
HClO + KI → KIO3 + HCl
2HBr + HClO → HCl + Br2 + H2O
4HClO + MnS → 4HCl + MnSO4
HClO + KOH → KClO + H2O
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
NaClO + 2HCl → NaCl + Cl2 + H2O
Хлористая кислота (HClO2) и ее соли
Хлористая кислота HClO2– слабая кислота, существует только в водных растворах, очень неустойчива
Способы получения хлористой кислоты:
Химические свойства хлористой кислоты:
Соли хлористой кислоты – хлориты
Хлорноватая кислота (HClO3) и ее соли
Хлорноватая кислота HClO3– существует только в водных растворах, в свободном виде не выделена. Является сильной кислотой
Получение хлорноватой кислоты:
Действием кислот на хлораты:
Химические свойства хлорноватой кислоты:
Соли хлорноватой кислоты – хлораты:
Получают хлораты при пропускании хлора через подогретый раствор щелочи:
Хлорная кислота (HClO4) и ее соли
Хлорная кислота HClO4– летучая, хорошо растворимая в воде жидкость, не имеющая цвета. Является сильной кислотой и сильным окислителем. Взрывоопасна. Кислотный оксид — Cl2O7, соли хлорной кислоты — перхлораты.
Получение хлорной кислоты
Перегонкой при пониженном давлении смеси перхлората калия с серной кислотой:
Химические свойства хлорной кислоты
Химические свойства солей хлорной кислоты – перхлоратов:
Оксиды хлора
Оксид хлора (I), оксид дихлора ( Cl2O)
В газообразном состоянии имеет темно-желтый цвет, в жидком состоянии – красно-бурый. Неустойчив на свету при повышении температуры.
Получение оксид хлора (I)
Химические свойства оксида хлора (I)
Оксид хлора (IV), диоксид хлора, двуокись хлора ( ClO2)
ClO2 – ядовитый газ желто-зеленого цвета с резким запахом. Взрывается при механическом воздействии, при нагревании до 100 ºС и при контакте с восстановителем
Получение двуокиси хлора
В промышленности ClO2 получают, пропуская оксид серы (IV) через подкисленный раствор хлората натрия NaClO3:
В лаборатории ClO2получают при взаимодействии хлората калия с щавелевой кислотой в присутствии концентрированной серной кислоты:
Химические свойства оксида хлора (IV)
6ClO2 + 3H2O = HCl + 5HClO3 (горячая вода)
Оксид хлора (VI), триоксид хлора (ClO3 (Cl2O6))
ClO3 (Cl2O6) – вязкая жидкость красного цвета. Соприкосновение с органическими веществами приводит к взрыву.
Получение оксида хлора (VI)
Получают окислением озоном ClO2
Химические свойства оксида хлора (VI)
Оксид хлора (VII) (Cl2О7)
Cl2О7 – тяжелая, маслянистая жидкость, не имеющая цвета. Наиболее устойчивый из всех оксидов хлора. Очень взрывоопасен.
Получение оксида хлора (VII)
Получают при взаимодействии оксида фосфора (V) с концентрированной хлорной кислотой:
Химические свойства Cl2O7
Проявляет кислотные свойства.
Оксиды хлора
Известны следующие оксиды хлора:
| Название | Формула | Температура плавления | Температура кипения | Цвет |
|---|---|---|---|---|
| Оксид хлора(I) | Cl2O | −116 °C | 2 °C | от жёлтого до красноватого |
| Оксид хлора(IV) | ClO2 | −59 °C | 11 °C | жёлтый, оранжево-жёлтый |
| Оксид хлора(VI) | Cl2O6 | 3,5 °C | 203 °C | красно-коричневый |
| Оксид хлора(VII) | Cl2O7 | −91,5 °C | 80 °C | бесцветный |
 | Список значений слова или словосочетания со ссылками на соответствующие статьи. Если вы попали сюда из другой статьи Википедии, пожалуйста, вернитесь и уточните ссылку так, чтобы она указывала на статью. |
Полезное
Смотреть что такое «Оксиды хлора» в других словарях:
Хлора оксиды — Известны следующие оксиды хлора: Название Формула Температура плавления Температура кипения Цвет Оксид хлора(I) Cl2O 116 °C 2 °C от желтого до красноватого Оксид хлора(IV) ClO2 59 °C 11 °C желый,оранжево желтый Оксид хлора(VI) Cl2O6 3.5 °C … Википедия
ХЛОРА ОКСИДЫ — ХЛОРА ОКСИДЫ: гемиоксид Cl2O (желто коричневый газ) диоксид ClO2 (зеленовато желтый газ), триоксид Cl2O6 (темно коричневая жидкость), хлорный ангидрид Cl2O7 (бесцветная жидкость). Сильные окислители, взрывоопасны. ClO2 отбеливатель целлюлозы,… … Большой Энциклопедический словарь
ХЛОРА ОКСИДЫ: — ХЛОРА ОКСИДЫ: ХЛОРА ОКСИДЫ: гемиоксид Cl2O (желто коричневый газ), диоксид ClO2 (зеленовато желтый газ), триоксид Cl2O6 (темно коричневая жидкость), хлорный ангидрид Cl2O7 (бесцветная жидкость). Сильные окислители, взрывоопасны. ClO2 отбеливатель … Энциклопедический словарь
Оксиды — Оксид (окисел, окись) бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй… … Википедия
ХЛОРА ОКСИДЫ — Все X. о. имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду, имеют положит. Монооксид [оксид С1(I), дихлороксид, гемиоксид] С12 О желто оранжевый газ со слабым зеленоватым оттенком, в жидком состоянии красно… … Химическая энциклопедия
хлора оксиды — хлора оксиды: гемиоксид Cl2O (жёлто оранжевый газ), диоксид ClO2 (зеленовато жёлтый газ), триоксид Cl2O6 (ярко красная жидкость), хлорный ангидрид Cl2O7 (бесцветная жидкость). Сильные окислители, взрывоопасны. ClO2 отбеливатель целлюлозы, тканей … Энциклопедический словарь
ХЛОРА ОКСИДЫ — гемиоксид С12О (жёлто оранжевый газ), диоксид С1О2 (зеленовато жёлтый газ), триоксид Сl2О6 (ярко красная жидкость), хлорный ангидрид Сl2О7 (бесцв. жидкость). Сильные окислители, взрывоопасны. С1О2 отбеливатель целлюлозы, тканей, бумаги … Естествознание. Энциклопедический словарь
Оксид хлора(I) — У этого термина существуют и другие значения, см. Оксид хлора. Оксид хлора(I) … Википедия
Диоксид хлора — У этого термина существуют и другие значения, см. Оксид хлора. Диоксид хлора … Википедия
Оксид хлора(IV) — Общие … Википедия
хлора оксиды
Смотреть что такое «хлора оксиды» в других словарях:
Хлора оксиды — Известны следующие оксиды хлора: Название Формула Температура плавления Температура кипения Цвет Оксид хлора(I) Cl2O 116 °C 2 °C от желтого до красноватого Оксид хлора(IV) ClO2 59 °C 11 °C желый,оранжево желтый Оксид хлора(VI) Cl2O6 3.5 °C … Википедия
ХЛОРА ОКСИДЫ — ХЛОРА ОКСИДЫ: гемиоксид Cl2O (желто коричневый газ) диоксид ClO2 (зеленовато желтый газ), триоксид Cl2O6 (темно коричневая жидкость), хлорный ангидрид Cl2O7 (бесцветная жидкость). Сильные окислители, взрывоопасны. ClO2 отбеливатель целлюлозы,… … Большой Энциклопедический словарь
ХЛОРА ОКСИДЫ: — ХЛОРА ОКСИДЫ: ХЛОРА ОКСИДЫ: гемиоксид Cl2O (желто коричневый газ), диоксид ClO2 (зеленовато желтый газ), триоксид Cl2O6 (темно коричневая жидкость), хлорный ангидрид Cl2O7 (бесцветная жидкость). Сильные окислители, взрывоопасны. ClO2 отбеливатель … Энциклопедический словарь
ХЛОРА ОКСИДЫ — Все X. о. имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду, имеют положит. Монооксид [оксид С1(I), дихлороксид, гемиоксид] С12 О желто оранжевый газ со слабым зеленоватым оттенком, в жидком состоянии красно… … Химическая энциклопедия
ХЛОРА ОКСИДЫ — гемиоксид С12О (жёлто оранжевый газ), диоксид С1О2 (зеленовато жёлтый газ), триоксид Сl2О6 (ярко красная жидкость), хлорный ангидрид Сl2О7 (бесцв. жидкость). Сильные окислители, взрывоопасны. С1О2 отбеливатель целлюлозы, тканей, бумаги … Естествознание. Энциклопедический словарь
Оксиды хлора — Известны следующие оксиды хлора: Название Формула Температура плавления Температура кипения Цвет Оксид хлора(I) Cl2O −116 °C 2 °C от жёлтого до красноватого Оксид хлора(IV) ClO2 −59 °C 11 °C жёлтый, оранжево жёлтый Оксид… … Википедия
Оксиды — Оксид (окисел, окись) бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй… … Википедия
Оксид хлора(I) — У этого термина существуют и другие значения, см. Оксид хлора. Оксид хлора(I) … Википедия
Диоксид хлора — У этого термина существуют и другие значения, см. Оксид хлора. Диоксид хлора … Википедия
Оксид хлора(IV) — Общие … Википедия
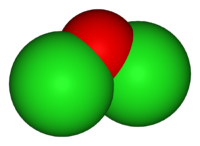
Оксид хлора(I)
| Оксид хлора(I) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид хлора(I) |
| Химическая формула | Cl2O |
| Физические свойства | |
| Состояние (ст. усл.) | газ |
| Молярная масса | 86,9054 г/моль |
| Плотность | 3,22 г/см³ |
| Термические свойства | |
| Температура плавления | −120,6 °C |
| Температура кипения | 2,2 °C |
| Энтальпия образования (ст. усл.) | +80,3 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 143 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7791-21-1 |
Содержание
Получение
Получают взаимодействием газообразного хлора с оксидом ртути (метод Пелуза). Реакция в зависимости от условий может протекать двумя различными путями, но во всех случаях с образованием искомого оксида хлора:

Образующийся Cl2O конденсируют при температуре −60 °C. При более высокой температуре соединение разлагается со взрывом.
Также водный раствор может быть получен хлорированием карбонатов щелочных или щёлочноземельных металлов в воде.
Свойства
В нормальных условиях представляет собой буровато-жёлтый газ с характерным запахом, напоминающим запах хлора. При температурах ниже 2 °C — жидкость золотисто-красного цвета. Ядовит: поражает дыхательные пути. Самопроизвольно медленно разлагается:
При больших концентрациях взрывоопасен. Плотность при нормальных условиях 3,22 кг/м³. Растворяется в четырёххлористом углероде. Хорошо растворим в воде с образованием слабой хлорноватистой кислоты:
Применение
В промышленных масштабах широко используется для производства гипохлоритов. Используется как отбеливатель. Производное гидролиза —хлорноватистая кислота — входит в состав жавелевой воды.
См. также
Оксид хлора(IV), Оксид хлора(VII) — оксиды элемента в другой степени окисления.
Литература
Полезное
Смотреть что такое «Оксид хлора(I)» в других словарях:
Оксид хлора(IV) — Общие … Википедия
Оксид хлора (IV) — Оксид хлора(IV) Общие Систематическое наименование Оксид хлора(IV) Химическая формула … Википедия
Оксид хлора(VI) — У этого термина существуют и другие значения, см. Оксид хлора. Оксид хлора(VI) Общие Систематическое наименование Оксид хлора(IV) Химическая формула Cl2O6 Физические свойства … Википедия
Оксид хлора(VII) — У этого термина существуют и другие значения, см. Оксид хлора. Оксид хлора(VII) … Википедия
Хлора оксиды — Известны следующие оксиды хлора: Название Формула Температура плавления Температура кипения Цвет Оксид хлора(I) Cl2O 116 °C 2 °C от желтого до красноватого Оксид хлора(IV) ClO2 59 °C 11 °C желый,оранжево желтый Оксид хлора(VI) Cl2O6 3.5 °C … Википедия
Оксид — (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся… … Википедия
Хлора окислы — соединения хлора с кислородом: Cl2O, ClO2, Cl2O6, Cl2O7, Cl2O8. Х. окись (оксид хлора, ангидрид хлорноватистой кислоты (См. Хлорноватистая кислота)), Cl2O, жёлто коричневый газ с резким запахом, похожим на запах хлора; tnл 121… … Большая советская энциклопедия
Оксид меди(I) — Оксид меди(I) … Википедия
Оксид марганца(IV) — Общие … Википедия
Оксид-дихлорид гафния — Общие Систематическое наименование Оксид дихлорид гафния Традиционные названия Дихлорид гафнила; хлористый гафнил Химическая формула HfOCl2 Физические свойства … Википедия
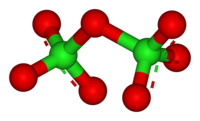
Оксид хлора(VII)
| Оксид хлора(VII) | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид хлора(VII) |
| Химическая формула | Cl2O7 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 182,901 а. е. м. |
| Молярная масса | 182.901 г/моль |
| Термические свойства | |
| Температура плавления | −91,5 °C |
| Температура кипения | 82 °C |
| Температура разложения | 120 °C |
| Классификация | |
| Рег. номер CAS | [12015-53-1] |
Окси́д хло́ра(VII) (дихлорогептаоксид) Cl2O7, (хлорный ангидрид) — кислотный оксид.
Молекула Cl2O7 имеет строение О3Cl—О—ClO3 (dCl—О = 0,1709 нм, в группах ClО3 — 0,1405 нм, угол ClOCl = 118,6°, ОClO 115,2°) c пространственной симметрией C2, молекула полярна (μ = 2,40·10 −30 Кл·м).
Свойства
Хлорный ангидрид представляет собой бесцветную маслянистую жидкость. Cl2O7 взрывается при нагревании выше 120 °C и от удара, однако он более устойчив, чем оксид и диоксид хлора. Жидкий Cl2О7 устойчив до 60—70 °C, но примесь низших оксидов хлора существенно ускоряет его распад:

Медленно растворяется в холодной воде, образуя хлорную кислоту:
Хлорный ангидрид является сильным окислителем.
Получение
Получают Cl2О7 при осторожном нагревании хлорной кислоты с фосфорным ангидридом или олеумом:
Оксид хлора(VII) получают также электролизом раствора НClО4 на платиновых электродах ниже 0 °C (Cl2O7 накапливается в анодном пространстве). Чистый Cl2O7 можно синтезировать также при нагревании в вакууме некоторых перхлоратов, например, Nb(ClO4)5 или МоО2(ClO4)2.
Литература
Полезное
Смотреть что такое «Оксид хлора(VII)» в других словарях:
Оксид хлора(I) — У этого термина существуют и другие значения, см. Оксид хлора. Оксид хлора(I) … Википедия
Хлора оксиды — Известны следующие оксиды хлора: Название Формула Температура плавления Температура кипения Цвет Оксид хлора(I) Cl2O 116 °C 2 °C от желтого до красноватого Оксид хлора(IV) ClO2 59 °C 11 °C желый,оранжево желтый Оксид хлора(VI) Cl2O6 3.5 °C … Википедия
Оксид — (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся… … Википедия
Оксид марганца(IV) — Общие … Википедия
Оксиды хлора — Известны следующие оксиды хлора: Название Формула Температура плавления Температура кипения Цвет Оксид хлора(I) Cl2O −116 °C 2 °C от жёлтого до красноватого Оксид хлора(IV) ClO2 −59 °C 11 °C жёлтый, оранжево жёлтый Оксид… … Википедия
Фторид рения(VII) — Общие … Википедия
Фторид хлора(I) — Фторид хлора(I) … Википедия
Фторид иода(VII) — Фторид иода(VII) … Википедия
Фторид хлора(III) — Фторид хлора(III) … Википедия
Фторид хлора(V) — (пентафторид хлора) ClF5, соединение хлора с фтором, представляющее собой при комнатной температуре бесцветный ядовитый тяжёлый газ с сильным раздражающим запахом. Конденсируется при охлаждении до −13 °C (или при увеличении давления) в … Википедия





