Алюминий или аллюминий?
Русский язык богат словами, которые так и просятся быть написанными неправильно: О вместо А, одну согласную вместо двух и наоборот. Именно таким словом выступает существительное алюминий, в котором многие пишущие совершают одну и ту же ошибку. Так как же пишется алюминий: с одной Л или с двумя?
Правописание слова
Русский язык заимствовал немало слов из разных языков, в частности, из греческого и латинского. Одним из таких слов и является слово алюминий. Обратимся к происхождению этого слова. Согласно «Объяснению 25 000 иностранных слов, вошедших в употребление в русском языке» А. Михельсона, этимология восходит к латинскому alumen, то есть «квасцы», из которых впервые алюминий и добыли. Неизвестное вещество назвали aluminium, а мы знаем его под именем алюминий.
Впрочем, неудивительно, что рука то и дело стремится добавить к этому существительному ещё одну Л: у нас действительно множество иностранных, но давно привычных нам слов, которые пишутся с удвоенной сонорной согласной – М, Л или Н – в корне:
Поэтому часто хочется написать так же и другие заимствованные слова типа «волейбол», «галерея», «гуманизм». При этом, как правило, заимствование из других языков вынуждает нас писать слова близкими к оригиналу, такова языковая традиция. Поэтому и аЛюминий мы пишем с одной Л в корне. Никакой проверочной формы этого существительного не существует, его нужно просто запомнить!
Тем не менее, можно прибегнуть к мнемонике. Например, использовать шуточный приём, старый анекдот:
– Сегодня будем грузить люминь! – Товарищ прапорщик, не люминь, а алюминий… – А самые умные будут грузить чугуний!
Так как написать слово «люминь» с двумя Л довольно проблематично, поэтому запомнить правописание нужного нам слова оказывается совсем несложно!
Примеры предложений
Ошибочное написание
Неправильным считается написание данного слово следующим образом писать: «аллюминий», «олюминий», «оллюминий».
Синонимы
Синонимами к этому существительному могут быть только эпитеты к металлу: «легкий, крылатый, серебристый металл», «металл для самолетов».
Заключение
Итак, чтобы запомнить правописание аЛюминия, никакого правила не существует. Это слово можно либо просто запомнить, либо воспользоваться мнемоническим приемом, либо же просто заглянуть в орфографический словарь.
Алюминий
Кусок чистого алюминия
Алюминий — очень редкий минерал семейства меди-купалита подкласса металлов и интерметаллидов класса самородных элементов. Преимущественно в виде микроскопических выделений сплошного мелкозернистого строения. Может образовывать пластинчатые или чешуйчатые кристаллы до 1 мм., отмечены нитевидные кристаллы длиной до 0,5 мм. при толщине нитей несколько мкм. Лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке.
СТРУКТУРА
Кубическая гранецентрированная структура. 4 оранжевых атома
СВОЙСТВА
Самородный алюминий. Поле зрения 5 x 4 мм. Азербайджан, Гобустанский район, Каспийское море, Хере-Зиря или остров Булла
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью, парамагнетик. Температура плавления 660°C. К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см 3 ), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость. Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой — оксидом алюминия.) надежно предохраняет металл от дальнейшего окисления. Но если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь в оксид алюминия. Алюминий растворяется даже в разбавленных соляной и серной кислотах, особенно при нагревании. А вот в сильно разбавленной и концентрированной холодной азотной кислоте алюминий не растворяется. При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона.
ЗАПАСЫ И ДОБЫЧА
По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14%.
Современный метод получения, процесс Холла—Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
ПРОИСХОЖДЕНИЕ
Аллюминий, агрегированный с коркой байерита на поверхности. Узбекистан, Навойская область, Учкудук
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико. Самые распространенные вещества, содержащие рассматриваемый металл: полевые шпаты; бокситы; граниты; кремнезем; алюмосиликаты; базальты и прочие. В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
ПРИМЕНЕНИЕ
Украшение из алюминия
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость. Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем.
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 г. были подарены весы с чашами из золота и алюминия. Мода на ювелирные изделия из алюминия сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
Алюминий
| Алюминий(Al) | |
|---|---|
| Атомный номер | 13 |
| Внешний вид | мягкий, лёгкий, серебристо-белый металл, быстро окисляющийся |
| Свойства атома | |
| Атомная масса (молярная масса) | 26,.981539 а. е. м. (г/моль) |
| Радиус атома | 143 пм |
| Энергия ионизации (первый электрон) | 577,2(5,98) кДж/моль (эВ) |
| Электронная конфигурация | [Ne] 3s 2 3p 1 |
| Химические свойства | |
| Ковалентный радиус | 118 пм |
| Радиус иона | 51 (+3e) пм |
| Электроотрицательность (по Полингу) | 1,61 |
| Электродный потенциал | -1,66 в |
| Степени окисления | 3 |
| Термодинамические свойства | |
| Плотность | 2,6989 г/см³ |
| Удельная теплоёмкость | 0,900 Дж/(K·моль) |
| Теплопроводность | 237 Вт/(м·K) |
| Температура плавления | 933,5 K |
| Теплота плавления | 10,75 кДж/моль |
| Температура кипения | 2740 K |
| Теплота испарения | 284,1 кДж/моль |
| Молярный объём | 10,0 см³/моль |
| Кристаллическая решётка | |
| Структура решётки | кубическая гранецентрированая |
| Период решётки | 4,050 Å |
| Отношение c/a | n/a |
| Температура Дебая | 394,00 K |
Алюми́ний (лат. Аluminium ) — химический символ Al, III группа периодической системы Менделеева, атомный номер 13, атомная масса 26,9815, мягкий, лёгкий, серебристо-белый металл, быстро окисляющийся, удельная плотность 2,7 г/ см³, температура плавления 660 °C. По распространённости в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов.
Содержание
История
История алюминия. В 1807 году английский химик Гэмфри Дэви открыл вещество под названием «alum» («квасцы»), которое представляло собой соль неизвестного металла, этот металл был назван им «алюмиум». Позднее, это название было преобразовано в «aluminium» («алюминий»). Дэйви безуспешно пытался выделить этот металл с помощью электролиза (вещество практически не растворялось в воде). В 1825 году датскому физику Эрстеду удалось выделить алюминий, как отдельный элемент. Немецкий учёный Фридрих Вёлер в 1845 году провёл обширные исследования по изучению свойств этого металла, одно из которых была его необычайная лёгкость. Также он использовал новый способ получения алюминия. AlCl3 + 3K = 3KCl + Al
В 1886 году Поль Эру во Франции и Чарльз Холл из Огайо одновременно изобрели способ получения алюминия с помощью электролитического метода. Оба этих учёных родились в 1863 году и умерли в 1914 году в возрасте 51 года. Согласно этому методу расплаву подвергался не сам Al2O3, а его раствор в расплавленном криолите Na3AlF6. Данный процесс проводится в электрических печах при температуре 960°C. Способ, изобретённый двумя этими выдающимися учёными, используется и до сих пор.
Получение
Физические свойства
Нахождение в природе
В природе алюминий встречается только в соединениях (минералах ).
Алунит – ( Na, K )2 SO4 × Al2( SO4 )3 × 4Al( OH )3
Химические свойства
При нормальных условиях алюминий покрыт тонкой и прочной оксидной пленкой и потому не реагирует с простыми веществами: с H2O (t°); O2, HNO3 (без нагревания)). Al – активный металл-восстановитель.
Легко реагирует с простыми веществами:
3) с другими неметаллами реагирует при нагревании:
с серой, образуя сульфид алюминия :
с азотом, образуя нитрид алюминия :
с углеродом, образуя карбид алюминия :
Сульфид и карбид алюминия полностью гидролизуются:
Со сложными веществами:
4) с водой (после удаления защитной оксидной пленки, например, амальгамированием ):
5) со щелочами (с оброзованием тетрагидроксоалюминатов и других алюминатов ):
6) Легко растворяется в соляной и разбавленной серной киcлотах:
При нагревании растворяется в кислотах – окислителях, образующих растворимые соли алюминия:
7) восстанавливает металлы из их оксидов ( алюминотермия ):
Применение
Кусок алюминия и американская монетка.
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость (на воздухе алюминий мгновенно покрывается прочной плёнкой Al2O3, которая препятствует его дальнейшему окислению), высокая теплопроводность, неядовитость его соединений. В частности, эти свойства сделали алюминий чрезвычайно популярным при производстве кухонной посуды, алюминиевая фольга в пищевой промышленности и для упаковки.
Основной недостаток алюминия как конструкционного материала — малая прочность, поэтому его обычно сплавляют с небольшим количеством меди и магния (сплав называется дюралюминий ).
В качестве восстановителя
Сплавы на основе алюминия
В качестве конструкционного материала обычно используют не чистый алюминий, а разные сплавы на его основе.
Алюминий как добавка в другие сплавы
Алюминий является важным компонентом многих сплавов. Например, в алюминиевых бронзах основные компоненты — медь и алюминий. В магниевых сплавах в качестве добавки чаще всего используется алюминий. Для изготовления спиралей в электронагревательных приборов используют (наряду с другими сплавами) фехраль (Fe, Cr, Al).
Ювелирные изделия
Стекловарение
В стекловарении используются фторид, фосфат и оксид алюминия.
Алюминий и его соединения в ракетной технике
Алюминий и его соединения используются в качестве высокоэффективного ракетного горючего в двухкомпонентных ракетных топливах и в качестве горючего компонента в твердых ракетных топливах. Следующие соединения алюминия представляют наибольший практический интерес как ракетное горючее:
Теоретические характеристики топлив, образованных гидридом алюминия с различными окислителями.
| Окислитель | Удельная тяга(Р1,сек) | Температура сгорания °С | Плотность топлива г/см 3 | Прирост скорости, ΔVид,25, м/сек | Весовое содерж.горючего % |
|---|---|---|---|---|---|
| Фтор | 348,4 сек | 5009°С | 1,504 | 5328 м/сек | 25% |
| Тетрафторгидразин | 327,4 сек | 4758°С | 1,193 | 4434 м/сек | 19% |
| ClF3 | 287,7 сек | 4402°С | 1,764 | 4762 м/сек | 20% |
| ClF5 | 303,7 сек | 4604°С | 1,691 | 4922 м/сек | 20% |
| Перхлорилфторид | 293,7 сек | 3788°С | 1,589 | 4617 м/сек | 47% |
| Окись фтора | 326,5 сек | 4067°С | 1,511 | 5004 м/сек | 38,5% |
| Кислород | 310,8 сек | 4028°С | 1,312 | 4428 м/сек | 56% |
| Перекись водорода | 318,4 сек | 3561°С | 1,466 | 4806 м/сек | 52% |
| N2O4 | 300,5 сек | 3906°С | 1,467 | 4537 м/сек | 47% |
| Азотная кислота | 301,3 сек | 3720°С | 1,496 | 4595 м/сек | 49% |
См. также
Ссылки
af:Aluminium ar:ألمنيوم ast:Aluminiu bg:Алуминий bn:অ্যালুমিনিয়াম bs:Aluminijum ca:Alumini co:Alluminiu cs:Hliník cy:Alwminiwm da:Aluminium de:Aluminium el:Αργίλιο en:Aluminium eo:Aluminio es:Aluminio et:Alumiinium eu:Aluminio fa:آلومینیوم fi:Alumiini fr:Aluminium gd:Almain gl:Aluminio (elemento) he:אלומיניום hr:Aluminij hu:Alumínium hy:Ալյումին id:Aluminium io:Aluminio is:Ál it:Alluminio ja:アルミニウム jbo:jinmrmalume ko:알루미늄 ksh:Allu ku:Bafûn la:Aluminium lb:Aluminium lt:Aliuminis lv:Alumīnijs mk:Алуминиум ml:അലൂമിനിയം ms:Aluminium nl:Aluminium nn:Aluminium no:Aluminium nov:Aluminie pl:Glin pt:Alumínio ro:Aluminiu sh:Aluminijum simple:Aluminium sk:Hliník sl:Aluminij sr:Алуминијум sv:Aluminium sw:Alumini ta:அலுமினியம் tg:Алюминий th:อะลูมิเนียม tr:Alüminyum ug:Alyumin uk:Алюміній uz:Alyuminiy vi:Nhôm zh:铝 zh-yue:鋁
Алюминий
(молярная масса)
1‑я: 577,5 (5,984) кДж/моль (эВ)
2‑я: 1816,7 (18,828) кДж/моль (эВ)
Содержание
История
Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути.
Название элемента образовано от лат. alumen — квасцы.
До развития промышленного электролитического способа получения алюминия этот металл был дороже золота. В 1889 году британцы, желая почтить богатым подарком великого русского химика Д. И. Менделеева, подарили ему аналитические весы у которых чашки были изготовлены из золота и алюминия.
Нахождение в природе
Распространённость
По распространённости в земной коре занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14 %.
Природные соединения алюминия
В природе алюминий, в связи с высокой химической активностью, встречается почти исключительно в виде соединений. Некоторые из природных минералов алюминия:
Тем не менее, в некоторых специфических восстановительных условиях (жерла вулканов) найдены ничтожные количества самородного металлического алюминия.
В природных водах алюминий содержится в виде малотоксичных химических соединений, например, фторида алюминия. Вид катиона или аниона зависит, в первую очередь, от кислотности водной среды. Концентрации алюминия в водоёмах России колеблются от 0,001 до 10 мг/л. В морской воде его концентрация 0,01 мг/л.
Изотопы алюминия
Природный алюминий состоит практически полностью из единственного стабильного изотопа 27 Al с ничтожными следами 26 Al, наиболее долгоживущего радиоактивного изотопа с периодом полураспада 720 тыс. лет, образующегося в атмосфере при расщеплении ядер аргона 40 Arпротонами космических лучей с высокими энергиями.
Получение
Алюминий образует прочную химическую связь с кислородом. По сравнению с другими металлами, восстановление алюминия до металла из природных оксидов и алюмосиликатов более сложно в связи с его высокой реакционной способностью и с высокой температурой плавления всех его руд, например таких, как бокситы, корунды.
Обычное восстановление до металла обжигом оксида с углеродом (как например, в металлургических процессах восстановления железа) — невозможно, так как сродство к кислороду у алюминия выше, чем у углерода.
Электролиз в расплаве криолита:
Для производства 1000 кг чернового алюминия требуется 1920 кг глинозёма, 65 кг криолита, 35 кг фторида алюминия, 600 кг анодных графитовых электродов и около 17 МВт·ч электроэнергии (
Лабораторный способ получения алюминия предложил Фридрих Вёлер в 1827 году восстановлением металлическим калием безводного хлорида алюминия (реакция протекает при нагревании без доступа воздуха):
Физические свойства
Алюминий образует сплавы почти со всеми металлами. Наиболее известны сплавы с медью и магнием (дюралюминий) и кремнием (силумин).
Химические свойства
Легко реагирует с простыми веществами:
Сульфид и карбид алюминия полностью гидролизуются:
Со сложными веществами:
Производство и рынок
Достоверных сведений о получении алюминия до XIX века нет. Встречающееся иногда со ссылкой на «Естественную историю» Плиния утверждение, что алюминий был известен при императоре Тиберии, основано на неверном толковании источника.
В 1825 году датский физик Ганс Христиан Эрстед получил несколько миллиграммов металлического алюминия, а в 1827 году Фридрих Вёлер смог выделить крупинки алюминия, которые, однако, на воздухе немедленно покрывались тончайшей плёнкой оксида алюминия.
До конца XIX века алюминий в промышленных масштабах не производился.
Только в 1854 году Анри Сент-Клер Девиль (его исследования финансировал Наполеон III, рассчитывая, что алюминий пригодится его армии) изобрёл первый способ промышленного производства алюминия, основанный на вытеснении алюминия металлическим натрием из двойного хлорида натрия и алюминия NaCl·AlCl3. В 1855 году был получен первый слиток металла массой 6—8 кг. За 36 лет применения, с 1855 по 1890 год, способом Сент-Клер Девиля было получено 200 тонн металлического алюминия. В 1856 году он же получил алюминий электролизом расплава хлорида натрия-алюминия.
В 1885 году был построен завод по производству алюминия в немецком городе Гмелингеме, работающий по технологии, предложенной Николаем Бекетовым. Технология Бекетова мало чем отличалась от способа Девиля, но была проще и заключалась во взаимодействии между криолитом (Na3AlF6) и магнием. За пять лет на этом заводе было получено около 58 т алюминия — более четверти всего мирового производства металла химическим путём в период с 1854 по 1890 год.
Метод, изобретённый почти одновременно Чарльзом Холлом в США и Полем Эру во Франции (1886 год) и основанный на получении алюминия электролизом глинозёма, растворённого в расплавленном криолите, положил начало современному способу производства алюминия. С тех пор, в связи с улучшением электротехники, производство алюминия совершенствовалось. Заметный вклад в развитие производства глинозёма внесли русские учёные К. И. Байер, Д. А. Пеняков, А. Н. Кузнецов, Е. И. Жуковский, А. А. Яковкин и др.
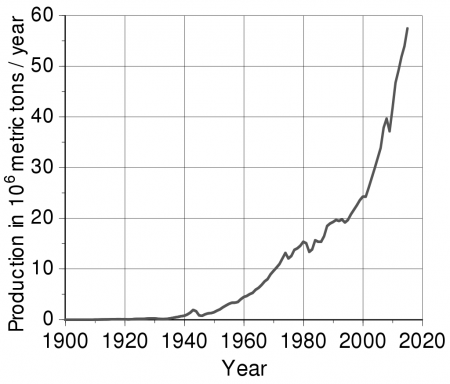
Первый алюминиевый завод в России был построен в 1932 году в городе Волхов. Металлургическая промышленность СССР в 1939 году производила 47,7 тыс. тонн алюминия, ещё 2,2 тыс. тонн импортировалось.
Вторая мировая война значительно стимулировала производство алюминия. Так, в 1939 году общемировое его производство, без учёта СССР, составляло 620 тыс. т, но уже к 1943 году выросло до 1,9 млн т.
К 1956 году в мире производилось 3,4 млн т первичного алюминия, в 1965 году — 5,4 млн т, в 1980 году — 16,1 млн т, в 1990 году — 18 млн т.
В 2007 году в мире было произведено 38 млн т первичного алюминия, а в 2008 — 39,7 млн т. Лидерами производства являлись:
В 2016 году было произведено 59 млн тонн алюминия
На мировом рынке запас составляет 2,224 млн т., а среднесуточное производство — 128,6 тыс. т. (2013.7).
В России монополистом по производству алюминия является компания «Российский алюминий», на которую приходится около 13 % мирового рынка алюминия и 16 % глинозёма.
Мировые запасы бокситов практически безграничны, то есть несоизмеримы с динамикой спроса. Существующие мощности могут производить до 44,3 млн т первичного алюминия в год. Следует также учитывать, что в будущем некоторые из применений алюминия могут быть переориентированы на использование, например, композитных материалов.
Цены на алюминий (на торгах международных сырьевых бирж) с 2007 по 2015 годы составляли в среднем 1253—3291 долларов США за тонну.
Применение
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость (на воздухе алюминий мгновенно покрывается прочной плёнкой Al2O3, которая препятствует его дальнейшему окислению), высокая теплопроводность, неядовитость его соединений. В частности, эти свойства сделали алюминий чрезвычайно популярным при производстве кухонной посуды, алюминиевой фольги в пищевой промышленности и для упаковки. Первые же три свойства сделали алюминий основным сырьём в авиационной и авиакосмической промышленности (в последнее время медленно вытесняется композитными материалами, в первую очередь, углеволокном).
Основной недостаток алюминия как конструкционного материала — малая прочность, поэтому для упрочнения его обычно сплавляют с небольшим количеством меди и магния (сплав называется дюралюминий).
Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем. Меньшую электропроводность алюминия (3,7·10 7 См/м) по сравнению с медью (5,84·10 7 См/м), для сохранения одинакового электрического сопротивления, компенсируют увеличением площади сечения алюминиевых проводников. Недостатком алюминия как электротехнического материала является образование на его поверхности прочной диэлектрической оксидной плёнки, затрудняющей пайку и за счёт ухудшения контактного сопротивления вызывающей повышенное нагревание в местах электрических соединений, что, в свою очередь, отрицательно сказывается на надёжности электрического контакта и состоянии изоляции. Поэтому, в частности, 7-я редакция Правил устройства электроустановок, принятая в 2002 году, запрещает использовать алюминиевые проводники сечением менее 16 мм².
В качестве восстановителя
Сплавы на основе алюминия
В качестве конструкционного материала обычно используют не чистый алюминий, а разные сплавы на его основе. Обозначение серий сплавов в данной статье приведена для США (стандарт H35.1 ANSI) и согласно ГОСТ России. В России основные стандарты — это ГОСТ 1583 «Сплавы алюминиевые литейные. Технические условия» и ГОСТ 4784 «Алюминий и сплавы алюминиевые деформируемые. Марки». Существует также UNS маркировка и международный стандарт алюминиевых сплавов и их маркировки ISO R209 b.
В сплавах этой системы, содержащих до 6 % Mg, образуется эвтектическая система соединения Al3Mg2 c твёрдым раствором на основе алюминия. Наиболее широкое распространение в промышленности получили сплавы с содержанием магния от 1 до 5 %.
Рост содержания Mg в сплаве существенно увеличивает его прочность. Каждый процент магния повышает предел прочности сплава на 30 МПа, а предел текучести — на 20 МПа. При этом относительное удлинение уменьшается незначительно и находится в пределах 30—35 %.
Сплавы с содержанием магния до 3 % (по массе) структурно стабильны при комнатной и повышенной температуре даже в значительно нагартованном состоянии. С ростом концентрации магния в нагартованном состоянии структура сплава становится нестабильной. Кроме того, увеличение содержания магния свыше 6 % приводит к ухудшению коррозионной стойкости сплава.
Для улучшения прочностных характеристик сплавы системы Al-Mg легируют хромом, марганцем, титаном, кремнием или ванадием. Попадания в сплавы этой системы меди и железа стараются избегать, поскольку они снижают их коррозионную стойкость и свариваемость.
Основными примесями в сплавах системы Al-Mn являются железо и кремний. Оба этих элемента уменьшают растворимость марганца в алюминии. Для получения мелкозернистой структуры сплавы этой системы легируют титаном.
Присутствие достаточного количества марганца обеспечивает стабильность структуры нагартованного металла при комнатной и повышенной температурах.
В качестве легирующих добавок могут применяться марганец, кремний, железо и магний. Причем наиболее сильное влияние на свойства сплава оказывает последний: легирование магнием заметно повышает пределы прочности и текучести. Добавка кремния в сплав повышает его способность к искусственному старению. Легирование железом и никелем повышает жаропрочность сплавов второй серии.
Нагартовка этих сплавов после закалки ускоряет искусственное старение, а также повышает прочность и сопротивление коррозии под напряжением.
Однако существенным недостатком этих сплавов является крайне низкая коррозионная стойкость под напряжением. Повысить сопротивление коррозии сплавов под напряжением можно легированием медью.
Нельзя не отметить открытой в 1960-е годы закономерности: присутствие лития в сплавах замедляет естественное и ускоряет искусственное старение. Помимо этого, присутствие лития уменьшает удельный вес сплава и существенно повышает его модуль упругости. В результате этого открытия были разработаны новые системы сплавов Al-Mg-Li, Al-Cu-Li и Al-Mg-Cu-Li.
Алюминий как добавка в другие сплавы
Алюминий является важным компонентом многих сплавов. Например, в алюминиевых бронзах основные компоненты — медь и алюминий. В магниевых сплавах в качестве добавки чаще всего используется алюминий. Для изготовления спиралей в электронагревательных приборах используют (наряду с другими сплавами) фехраль (Fe, Cr, Al). Добавка алюминия в так называемые «автоматные стали» облегчает их обработку, давая чёткое обламывание готовой детали с прутка в конце процесса.
Ювелирные изделия
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 году были подарены весы с чашами из золота и алюминия. Мода на ювелирные изделия из алюминия сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
В Японии алюминий используется в производстве традиционных украшений, заменяя серебро.
Столовые приборы
По приказу Наполеона III были изготовлены алюминиевые столовые приборы, которые подавались на торжественных обедах ему и самым почётным гостям. Другие гости при этом пользовались приборами из золота и серебра.
Затем столовые приборы из алюминия получили широкое распространение, со временем использование алюминиевой кухонной утвари существенно снизилось, но и в настоящее время их всё ещё можно увидеть лишь в некоторых заведениях общественного питания — несмотря на заявления некоторых специалистов о вредности алюминия для здоровья человека. Кроме того, такие приборы со временем теряют привлекательный вид из-за царапин и форму из-за мягкости алюминия.
Из алюминия делают посуду для армии: ложки, котелки, фляжки.
Стекловарение
В стекловарении используются фторид, фосфат и оксид алюминия.
Пищевая промышленность
Алюминий зарегистрирован в качестве пищевой добавки Е173.
Алюмогель — студенистый осадок, образующийся при быстром осаждении гидроксида алюминия из солевых растворов, не имеющий кристаллического строения и содержащий большое количество воды используется в качестве основы для антацидных, обезболивающих и обволакивающих средств (алгелдрат; в смеси с гидроксидом магния — альмагель, маалокс, гастрацид и др.) при заболеваниях желудочно-кишечного тракта.
Военная промышленность
Алюминий и его соединения в ракетной технике
Алюминий и его соединения используются в качестве высокоэффективного ракетного горючего в двухкомпонентных ракетных топливах и в качестве горючего компонента в твёрдых ракетных топливах. Следующие соединения алюминия представляют наибольший практический интерес как ракетное горючее:
Триэтилалюминий (обычно в смеси с триэтилбором) используется также для химического зажигания (как пусковое горючее) в ракетных двигателях, так как он самовоспламеняется в газообразном кислороде. Ракетные топлива на основе гидрида алюминия, в зависимости от окислителя, имеют следующие характеристики:
| Окислитель | Удельная тяга (Р1, с) | Температура сгорания, °С | Плотность топлива, г/см³ | Прирост скорости, ΔV ид, 25, м/с | Весовое содержание горючего, % |
|---|---|---|---|---|---|
| Фтор | 348,4 | 5009 | 1,504 | 5328 | 25 |
| Тетрафторгидразин | 327,4 | 4758 | 1,193 | 4434 | 19 |
| ClF3 | 287,7 | 4402 | 1,764 | 4762 | 20 |
| ClF5 | 303,7 | 4604 | 1,691 | 4922 | 20 |
| Перхлорилфторид | 293,7 | 3788 | 1,589 | 4617 | 47 |
| Фторид кислорода | 326,5 | 4067 | 1,511 | 5004 | 38,5 |
| Кислород | 310,8 | 4028 | 1,312 | 4428 | 56 |
| Пероксид водорода | 318,4 | 3561 | 1,466 | 4806 | 52 |
| N2O4 | 300,5 | 3906 | 1,467 | 4537 | 47 |
| Азотная кислота | 301,3 | 3720 | 1,496 | 4595 | 49 |
Алюмоэнергетика
Алюмоэнергетика использует алюминий как универсальный вторичный энергоноситель. Его применения в этом качестве:
Алюминий в мировой культуре
Токсичность
Несмотря на широкую распространённость в природе, ни одно живое существо не использует алюминий в метаболизме — это «мёртвый» металл. Отличается незначительным токсическим действием, но многие растворимые в воде неорганические соединения алюминия сохраняются в растворённом состоянии длительное время и могут оказывать вредное воздействие на человека и теплокровных животных через питьевую воду. Наиболее ядовиты хлориды, нитраты, ацетаты, сульфаты и др. Для человека токсическое действие при попадании внутрь оказывают следующие дозы соединений алюминия (мг/кг массы тела):
В первую очередь действует на нервную систему (накапливается в нервной ткани, приводя к тяжёлым расстройствам функции ЦНС). Однако свойство нейротоксичности алюминия стали изучать с середины 1960-х годов, так как накоплению металла в организме человека препятствует механизм его выведения. В обычных условиях с мочой может выделяться до 15 мг элемента в сутки. Соответственно, наибольший негативный эффект наблюдается у людей с нарушенной выделительной функцией почек.
Норматив содержания алюминия в воде хозяйственно-питьевого использования в России составляет 0,2 мг/л. При этом данная ПДК может быть увеличена до 0,5 мг/л главным государственным санитарным врачом по соответствующей территории для конкретной системы водоснабжения.
По некоторым биологическим исследованиям, поступление алюминия в организм человека было сочтено фактором в развитии болезни Альцгеймера, но эти исследования были позже раскритикованы, и вывод о связи одного с другим опровергался.
Соединения алюминия также, возможно, стимулируют рак молочной железы при применении антиперспирантов на основе хлорида алюминия. Но научных данных, подтверждающих это меньше, чем противоположных.
В ряде источников, авторство которых не указывается, содержатся утверждения о том, что алюминий якобы способен замещать кальций в костной ткани. Это противоречит научным данным, поскольку в электрохимическом ряду активности металлов алюминий стоит правее кальция — то есть, является менее химически активным металлом.