Этилен (этен), получение, свойства, химические реакции
Этилен (этен), получение, свойства, химические реакции.
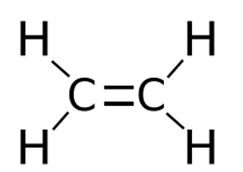
Этилен (этен), C2H4 – органическое вещество класса алкенов. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Этилен (этен), формула, газ, характеристики:
Химическая формула этилена C2H4, рациональная формула H2CCH2, структурная формула CH2=CH2. Изомеров не имеет.
Этилен – бесцветный газ, без вкуса, со слабым запахом. Легче воздуха.
Этилен является фитогормоном, т.е. низкомолекулярным органическим веществом, вырабатываемым растениями и имеющим регуляторные функции. Он образуется в тканях самого растения и выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов ), распускание бутонов (процесс цветения), старение и опадание листьев и цветков, участие в реакции растений на биотический и абиотический стресс, коммуникации между разными органами растений и между растениями в популяции.
Пожаро- и взрывоопасен.
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Этилен — самое производимое органическое соединение в мире.
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства этилена (этена):
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства этилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
Однако при нагревании этилена до температуры 300 o C разрыва двойной углерод-углеродной связи не происходит – реакция галогенирования протекает по механизму радикального замещения:
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется этанол.
Этилен легко окисляется. В зависимости от условий проведения реакции окисления этилена могут быть получены различные вещества: многоатомные спирты, эпоксиды или альдегиды.
В результате образуется эпоксид.
В результате образуется ацетальдегид.
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
Этилен в лабораторных условиях получается в результате следующих химических реакций:
Применение и использование этилена (этена):
Примечание: © Фото //www.pexels.com, //pixabay.com

как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена
напишите уравнение реакций этилен
2 ЧАС
4
Этилен (ИЮПАК имя: этен) это углеводород который имеет формулу C
2 ЧАС
4 или H2C = CH2. Это бесцветный легковоспламеняющийся газ со слабым сладковатым оттенком. мускусный»запах в чистом виде. [5] Это самый простой алкен (углеводород с углерод-углерод двойные связи).
Этилен широко используется в химической промышленности и его мировом производстве (более 150 млн. тонны в 2016 году [6] ) превосходит любой другой органическое соединение. [7] [8] Большая часть этого производства идет на полиэтилен, широко используемый пластик содержащий полимер цепи этиленовых звеньев с различной длиной цепи. Этилен также является важным природным гормон растения и используется в сельском хозяйстве для ускорения созревания плодов. [9] В гидрат этилена этиловый спирт.
Содержание
Структура и свойства
Как простая молекула, этилен спектроскопически прост. Его УФ-видимый спектр до сих пор используется в качестве проверки теоретических методов. [10]
Использует
Полимеризация
Полиэтилен потребляет более половины мировых поставок этилена. Полиэтилен, также называемый полиэтилен и полиэтилен, является наиболее широко используемым пластиком в мире. Он в основном используется для создания фильмов в упаковка, сумки для переноски и мусор лайнеры. Линейный альфа-олефины, произведено олигомеризация (образование коротких полимеров) используются как предшественники, моющие средства, пластификаторы, синтетические смазки, добавки, а также в качестве сомономеров при производстве полиэтиленов. [11]
Окисление
Этилен окисленный производить окись этилена, ключевое сырье для производства поверхностно-активные вещества и моющие средства к этоксилирование. Оксид этилена также гидролизуют для получения этиленгликоль, широко используемый в качестве автомобильного антифриза, а также в качестве гликолей с более высокой молекулярной массой, гликолевые эфиры, и полиэтилентерефталат.
Этилен окисляется палладием с образованием ацетальдегид. Это преобразование остается основным промышленным процессом (10 млн кг / год). [12] Процесс протекает через начальное комплексообразование этилена с центром Pd (II).
Галогенирование и гидрогалогенирование
Основные промежуточные продукты из галогенирование и гидрогалогенирование этилена включают этилендихлорид, этилхлорид, и дибромид этилена. Добавление хлора влечет за собой «оксихлорирование», т.е. сам хлор не используется. Некоторые продукты, производные от этой группы, являются поливинил хлорид, трихлорэтилен, перхлорэтилен, метилхлороформ, поливинилиденхлорид и сополимеры, и этилбромид. [13]
Алкилирование
Основные химические промежуточные продукты из алкилирование с этиленом этилбензол, предшественник стирол. Стирол используется в основном в полистирол для упаковки и изоляции, а также в стирол-бутадиен резина для шин и обуви. В меньшем масштабе этилтолуол, этиланилины, 1,4-гексадиен и алюминий алкилы. Продукты этих промежуточных продуктов включают полистирол, ненасыщенный полиэфиры и этилен-пропилен терполимеры. [13]
Оксо реакция
Гидратация
Этилен долгое время представлял собой основной неферментирующий прекурсор этиловый спирт. Исходный метод повлек за собой преобразование его в диэтилсульфатс последующим гидролизом. Основным методом, применяемым с середины 1990-х годов, является прямая гидратация этилена, катализируемая твердые кислотные катализаторы: [14]
Димеризация в бутены
Этилен димеризованный к гидровинилирование давать п-butenes с использованием процессов, лицензированных Lummus или IFP. Процесс Lummus производит смешанные п-бутены (в первую очередь 2-бутены), а процесс IFP производит 1-бутен. 1-бутен используется как сомономер в производстве некоторых видов полиэтилен.
Плоды и цветение
Ниша использует
Производство
Мировое производство этилена в 2005 году составило 107 миллионов тонн, [7] 109 млн тонн в 2006 г., [17] 138 миллионов тонн в 2010 году и 141 миллион тонн в 2011 году. [18] К 2013 году этилен производили не менее 117 компаний в 32 странах мира. Чтобы удовлетворить постоянно растущий спрос на этилен, резко увеличиваются производственные мощности во всем мире, особенно в Ближний Восток И в Китай. [19]
Промышленный процесс
Лабораторный синтез
Хотя этилен имеет большое промышленное значение, он редко синтезируется в лаборатории и обычно покупается. [22] Его можно получить путем обезвоживания этиловый спирт с серная кислота или в газовой фазе с оксид алюминия. [23]
Биосинтез
Этилен в природе производится из метионина. Непосредственным предшественником является 1-аминоциклопропан-1-карбоновая кислота. [24]
Лиганд
История
Некоторые геологи и ученые считают, что знаменитый греческий оракул на Delphi (в Пифия) вошла в свое трансоподобное состояние под действием этилена, поднимающегося из замыканий на землю. [26]
Этилен, по-видимому, был открыт Иоганн Иоахим Бехер, который получил его путем нагрева этиловый спирт с серной кислотой; [27] он упомянул газ в своем Physica Subterranea (1669). [28] Джозеф Пристли также упоминает газ в своем Эксперименты и наблюдения, относящиеся к различным разделам натурфилософии: с продолжением наблюдений в эфире (1779), где он сообщает, что Ян Ингенхауз видел, как этилен синтезировали таким же образом мистером Эне в Амстердаме в 1777 году, и что впоследствии Ингенхауз сам произвел этот газ. [29] Свойства этилена изучали в 1795 г. четырьмя нидерландский язык химики Иоганн Рудольф Дейманн, Адриен Паэтс ван Троствик, Антони Лауверенбург и Николас Бондт обнаружили, что он отличается от водород газ и что он содержит как углерод, так и водород. [30] Эта группа также обнаружила, что этилен может сочетаться с хлор производить масло голландских химиков, 1,2-дихлорэтан; это открытие дало этилену название, используемое для него в то время, олефиантный газ (нефтедобывающий газ.) [31] Термин олефиантный газ, в свою очередь, является этимологическим происхождением современного слова «олефин», класса углеводородов, в котором этилен является первым членом.
В середине 19 века суффикс -ene (древнегреческий корень, добавленный в конец женских имен, означающий «дочь») широко использовался для обозначения молекулы или ее части, которая содержала на один атом водорода меньше, чем молекула, которую модифицируют. Таким образом, этилен ( C
2 ЧАС
4 ) была «дочерью этил» ( C
2 ЧАС
5 ). Название этилен использовалось в этом смысле еще в 1852 году. [ нужна цитата ]
После экспериментов Лакхардта, Крокера и Картера в Чикагском университете, [33] этилен использовался как анестетик. [34] [5] Он оставался в использовании до 1940-х годов, даже когда хлороформ постепенно прекращался. Его резкий запах и взрывной характер ограничивают его использование сегодня. [35]
Номенклатура
Безопасность
Как и все углеводороды, этилен горючий удушающий. Он указан как МАИР канцероген класса 3, поскольку в настоящее время нет доказательств того, что он вызывает рак у людей. [39]
Этилен
Полезное
Смотреть что такое «Этилен» в других словарях:
Этилен — Этилен … Википедия
ЭТИЛЕН — (греч.). Маслородный газ, бесцветный, состоит из углерода и водорода. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ЭТИЛЕН бесцветный горючий удушливый газ. Полный словарь иностранных слов, вошедших в… … Словарь иностранных слов русского языка
Этилен-N — Этилен N,N динитрамин Этилен N,N динитрамин Этилен N,N динитрамин (этилендинитрамин, ЭДНА, гейлеит) химическое соединение C2H6 … Википедия
Этилен — – простейший представитель олефиновых углеводородов, представляющий собой бесцветный газ со слабым приятным запахом; легче воздуха, плохо растворим в воде, горит светящимся пламенем. Этилен является одним из основных продуктов… … Нефтегазовая микроэнциклопедия
этилен — а, м. éthylène m. Бесцветный горючий газ, состоящий из углерода и водорода. БАС 1. Лекс. Толль 1864: этилен; СИС 1937: этиле н … Исторический словарь галлицизмов русского языка
ЭТИЛЕН — (CH2=CH2) простейший представитель олефинов; бесцветный газ со слабым запахом; легче воздуха, плохо растворим в воде, горит слегка светящимся пламенем. В больших количествах (до 20%) содержится в газах нефтепереработки, входит в состав коксового… … Российская энциклопедия по охране труда
ЭТИЛЕН — ЭТИЛЕН, см. ЭТЕН … Научно-технический энциклопедический словарь
ЭТИЛЕН — ЭТИЛЕН, этилена, мн. нет, муж. (см. этил) (хим.). Горючий газ со сладковатым запахом, одна из составных частей светильного газа. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ЭТИЛЕН — ЭТИЛЕН, а, м. Бесцветный газ Ч один из основных продуктов нефтехимической промышленности. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ЭТИЛЕН — С2Н4, ненасыщенный углеводород. В незначит, кол ве образуется в тканях растений и животных как промежуточный продукт обмена веществ. Содержащийся в разл. органах высших растений (плодах, цветках, листьях, стеблях, корнях) Э. антагонистически… … Биологический энциклопедический словарь
Этилен
Характеристики и физические свойства этилена
Представляет собой бесцветный горючий газ (строение молекулы показано на рис. 1), который обладает слабым запахом. Плохо растворяется в воде, но хорошо в диэтиловом эфире и углеводородах.
Рис. 1. Строение молекулы этилена.
Таблица 1. Физические свойства этилена.
Молярная масса, г/моль
Температура плавления, o С
Температура кипения, o С
Получение этилена
Способы получения этилена можно разделить на промышленные и лабораторные. В первом случае этен – это продуктдегидрирования этана, полученного при крекинге нефти.
В лабораторных условиях этилен можно получить при помощи дегидратации этанола (1), дегалогенированиямоно- и дигалогенпроизводных этана (2, 3) или при неполном гидрировании ацетилена (4):
Химические свойства этилена
Этилен способен присоединять водород (гидрирование) (5), галогены (галогенирование) (6), галогеноводороды (гидрогалогенирование) (7) и воду (гидратация) (8):
В зависимости от условий проведения реакции окисления этилена могут быть получены многоатомные спирты (9), эпоксиды (10) или альдегиды (11):
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и воды:
Этилен подвергается полимеризации:
Кроме этого, если проводить галогенирование этилена при температуре 400 o С, то разрыва двойной связи происходить не будет, будет замещаться один атом водорода в углеводородном радикале:
Применение этилена
Основное направление использование этилена — промышленный органический синтез таких соединений как галогенопроизводные, спирты (этанол, этиленгликоль), уксусный альдегид, уксусная кислота и др. Кроме этого данное соединение в производстве полимеров.
Примеры решения задач
этан → этен → этанол → этен → хлорэтан → бутан.
Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной):
Для получения этена из этанола используют реакцию дегидротации:
Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования:
Для получения бутана из хлорэтана используют реакцию Вюрца:
| Задание | Сколько граммов потребуется для бромирования 16,8 г алкена, если известно, что при каталитическом гидрировании такого же количества алкена присоединилось 6,72 л водорода? Каков состав и возможное строение исходного углеводорода? |
| Решение | Запишем в общем виде уравнения бромирования и гидрирования алкена: |
Рассчитаем количество вещества водорода:
n(H2) = 6,72 / 22,4 = 0,3 моль,
следовательно, алкена тоже будет 0,3 моль (уравнение 2), а по условию задачи это 16,8 г. Значит молярная масса его будет равна:
что соответствует формуле C4H8.
Найдем массу брома:
M(Br2) = 2×Ar(Br) = 2×80 = 160 г/моль;
m(MnO2) = 0,3 × 160 = 48 г.
Составим структурные формулы изомеров: бутен-1 (1), бутен-2 (2), 2-метилпропен (3), циклобутан (4).
Этилен — структурная формула, химические свойства, применение
В данной статье мы расскажем вам о многочисленных химических свойствах такого органического вещества, как этилен. Во всех подробностях разберем химические реакции с этим веществом. Помимо химических свойств обязательно рассмотрим и общее строение этилена, а также применение данного алкена, основанное на его качествах и способностях.
Характеристики этилена
Этилен, или этен, имеет структурную формулу C2 H4 и является простейшим представителем непредельных этиленовых углеводородов:

В обычных условиях данное органическое вещество является газом без цвета и запаха. А теперь можем перейти к главной теме — химическим свойствам этилена.
Главные химические свойства C2 H4
Изучение химических способностей этена будет разделено на отдельные блоки, в которых четко и детально будут расписаны подробности взаимодействий.
Реакции присоединения
Если для предельных органических соединений характерны реакции замещения, то для алкенов, в частности этилена, типичны реакции присоединения:

Реакция полимеризации
Полимеризация — это процесс соединения одинаковых простых молекул — мономеров, в более сложные — полимеры. Берется неограниченное количество молекул этилена, и при повышенных давлении и температуре, в присутствии катализатора образуется полиэтилен.
Важно! Обратите внимание, что в полиэтилене уже нет кратной связи, она разрывается в процессе реакции.
Реакции окисления
Реакция изомеризации
Данная реакция не может протекать с этиленом, потому что у него не существует изомеров.
Механизм реакции электрофильного замещения
Мы уже рассмотрели реакцию присоединения галогена к этилену. Но стоит отдельно рассказать о механизме данной реакции, который необходимо знать. В результате отталкивания от пи-связи этена в молекуле хлора происходит поляризация, благодаря которой один атом хлора становится частично положительно заряженным, а другой — частично отрицательно заряженным. Это приводит к смещению пи-связи и образованию пи-комплекса.

Применение этилена
Почему мы выделяем этот вопрос при изучении химических свойств этилена? Потому что применение данного органического вещества основано на всех его химических свойствах:
Благодаря этой статье, вы изучили и подробно рассмотрели все химические реакции, которые характерны для этилена — простейшего представителя алкенов. Перед этим кратко узнали о строении этого органического соединения, что позволило более четко взглянуть на его химическую активность в различных взаимодействиях. Мы оценили важность и пользу этена, а также его необходимость в современной жизни человека. Чтобы закрепить изученный материал, рекомендуем вам пройти тест, расположенный ниже и посмотреть познавательное видео.
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется этилен в химии, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову "Как пишется этилен в химии", предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.