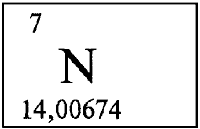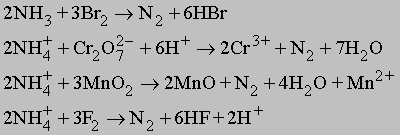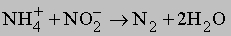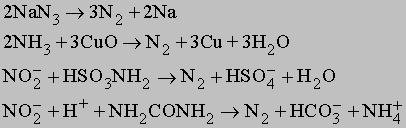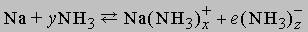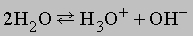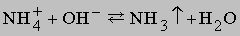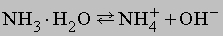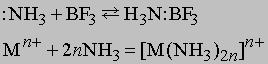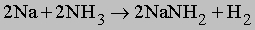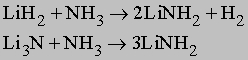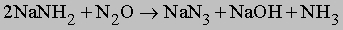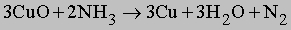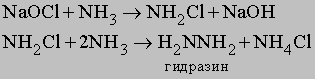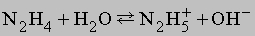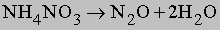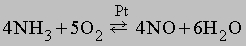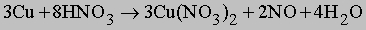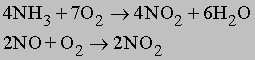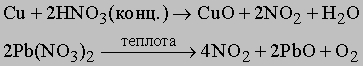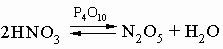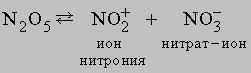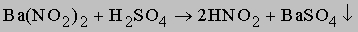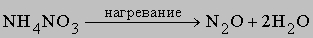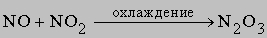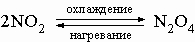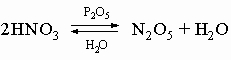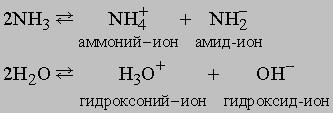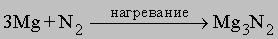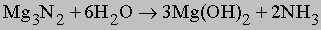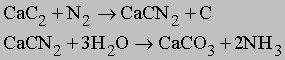Значение слова «азот»
[Франц. azote от греч. ’α- — не-, без- и ζωή — жизнь]
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
АЗО’Т, а, мн. нет, м. [от греч. отриц. a и zōē — жизнь]. Газ без цвета и запаха, входящий в состав воздуха. || Химический элемент (хим.).
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940); (электронная версия): Фундаментальная электронная библиотека
азо́т
1. неисч. хим. химический элемент с атомным номером 7, обозначается химическим символом N
2. неисч. хим. простое вещество с молекулярной формулой N2, в обычных условиях газ без цвета и запаха, химически пассивный ◆ Атмосферный воздух на 78 % состоит из азота.
3. исч. хим. жарг. атом азота [1]
Фразеологизмы и устойчивые сочетания
1. истор. древний богатый филистимский город, с храмом Дагона; теперь называется Ашдод
Делаем Карту слов лучше вместе

Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова младость (существительное):
Как правильно пишется азот или азот
Азот / Nitrogenium (N), 7
3,04 [1] (шкала Полинга)
0,808 г/см³ (−195,8 °C); при н.у. 0,001251 г/см³
Азо́т — элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 7. Обозначается символом N (лат. Nitrogenium ). Простое вещество азот (CAS-номер: 7727-37-9) — достаточно инертный при нормальных условиях двухатомный газ без цвета, вкуса и запаха (формула N2), из которого на три четверти состоит земная атмосфера.
Содержание
История открытия
В 1772 году Генри Кавендиш провёл следующий опыт: он многократно пропускал воздух над раскалённым углём, затем обрабатывал его щёлочью, в результате получался остаток, который Кавендиш назвал удушливым (или мефитическим) воздухом. С позиций современной химии ясно, что в реакции с раскалённым углём кислород воздуха связывался в углекислый газ, который затем поглощался щёлочью. При этом остаток газа представлял собой по большей части азот. Таким образом, Кавендиш выделил азот, но не сумел понять, что это новое простое вещество (химический элемент). В том же году Кавендиш сообщил об этом опыте Джозефу Пристли.
Пристли в это время проводил серию экспериментов, в которых также связывал кислород воздуха и удалял полученный углекислый газ, то есть также получал азот, однако, будучи сторонником господствующей в те времена теории флогистона, совершенно неверно истолковал полученные результаты (по его мнению, процесс был противоположным — не кислород удалялся из газовой смеси, а наоборот, в результате обжига воздух насыщался флогистоном; оставшийся воздух (азот) он и назвал насыщенным флогистоном, то есть флогистированным). Очевидно, что и Пристли, хотя и смог выделить азот, не сумел понять сути своего открытия, поэтому и не считается первооткрывателем азота.
Одновременно схожие эксперименты с тем же результатом проводил и Карл Шееле.
В 1772 году азот (под названием «испорченного воздуха») как простое вещество описал Даниэль Резерфорд, он опубликовал магистерскую диссертацию, где указал основные свойства азота (не реагирует со щелочами, не поддерживает горения, непригоден для дыхания). Именно Даниэль Резерфорд и считается первооткрывателем азота. Однако и Резерфорд был сторонником флогистонной теории, поэтому также не смог понять, что же он выделил. Таким образом, чётко определить первооткрывателя азота невозможно.
В дальнейшем азот был изучен Генри Кавендишем (интересен тот факт, что он сумел связать азот с кислородом при помощи разрядов электрического тока, а после поглощения оксидов азота в остатке получил небольшое количество газа, абсолютно инертного, хотя, как и в случае с азотом, не смог понять, что выделил новый химический элемент — инертный газ аргон).
Происхождение названия
Азо́т (от др.-греч. ἄζωτος — безжизненный, лат. nitrogenium ), вместо предыдущих названий («флогистированный», «мефитический» и «испорченный» воздух) предложил в 1787 году Антуан Лавуазье, который в то время в составе группы других французских учёных разрабатывал принципы химической номенклатуры. Как показано выше, в то время уже было известно, что азот не поддерживает ни горения, ни дыхания. Это свойство и сочли наиболее важным. Хотя впоследствии выяснилось, что азот, наоборот, крайне необходим для всех живых существ, название сохранилось во французском и русском языках.
Возможно, слово «азот» произошло от одного из двух арабских слов — либо от слова «аз-зат» («сущность» или «внутреннюю реальность»), либо от слова «зибак» («ртуть»)..
На латыни азот называется «nitrogenium», то есть «рождающий селитру»; английское название производится от латинского. В немецком языке используется название Stickstoff, что означает «удушающее вещество».
Азот в природе
Изотопы
Природный азот состоит из двух стабильных изотопов 14 N — 99,635 % и 15 N — 0,365 %.
Искусственно получены четырнадцать радиоактивных изотопов азота с массовыми числами от 10 до 13 и от 16 до 25. Все они являются очень короткоживущими изотопами. Самый стабильный из них 13 N имеет период полураспада 10 мин.
Спин ядер стабильных изотопов азота: 14 N — 1; 15 N — 1/2.
Распространённость
Вне пределов Земли азот обнаружен в газовых туманностях, солнечной атмосфере, на Уране, Нептуне, межзвёздном пространстве и др. Азот — четвёртый по распространённости элемент Солнечной системы (после водорода, гелия и кислорода).
Азот, в форме двухатомных молекул N2 составляет большую часть атмосферы, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объёму), то есть около 3,87·10 15 т.
Содержание азота в земной коре, по данным разных авторов, составляет (0,7—1,5)·10 15 т (причём в гумусе — порядка 6·10 10 т), а в мантии Земли — 1,3·10 16 т. Такое соотношение масс заставляет предположить, что главным источником азота служит верхняя часть мантии, откуда он поступает в другие оболочки Земли с извержениями вулканов.
Масса растворённого в гидросфере азота, учитывая, что одновременно происходят процессы растворения азота атмосферы в воде и выделения его в атмосферу, составляет около 2·10 13 т, кроме того примерно 7·10 11 т азота содержатся в гидросфере в виде соединений.
Биологическая роль
Азот является элементом, необходимым для существования животных и растений, он входит в состав белков (16—18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по числу атомов азота около 2 %, по массовой доле — около 2,5 % (четвёртое место после водорода, углерода и кислорода). В связи с этим значительное количество связанного азота содержится в живых организмах, «мёртвой органике» и дисперсном веществе морей и океанов. Это количество оценивается примерно в 1,9·10 11 т. В результате процессов гниения и разложения азотсодержащей органики, при условии благоприятных факторов окружающей среды, могут образоваться природные залежи полезных ископаемых, содержащие азот, например, «чилийская селитра» (нитрат натрия с примесями других соединений), норвежская, индийская селитры.
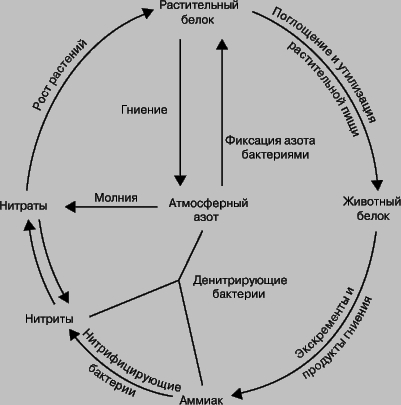
Круговорот азота в природе
Фиксация атмосферного азота в природе происходит по двум основным направлениям — абиогенному и биогенному. Первый путь включает главным образом реакции азота с кислородом. Так как азот химически весьма инертен, для окисления требуются большие количества энергии (высокие температуры). Эти условия достигаются при разрядах молний, когда температура достигает 25000 °C и более. При этом происходит образование различных оксидов азота. Существует также вероятность, что абиотическая фиксация происходит в результате фотокаталитических реакций на поверхности полупроводников или широкополосных диэлектриков (песок пустынь).
Однако основная часть молекулярного азота (около 1,4·10 8 т/год) фиксируется биотическим путём. Долгое время считалось, что связывать молекулярный азот могут только небольшое количество видов микроорганизмов (хотя и широко распространённых на поверхности Земли): бактерии Azotobacter и Clostridium, клубеньковые бактерии бобовых растений Rhizobium, цианобактерии Anabaena, Nostoc и др. Сейчас известно, что этой способностью обладают многие другие организмы в воде и почве, например, актиномицеты в клубнях ольхи и других деревьев (всего 160 видов). Все они превращают молекулярный азот в соединения аммония (NH4 + ). Этот процесс требует значительных затрат энергии (для фиксации 1 г атмосферного азота бактерии в клубеньках бобовых расходуют порядка 167,5 кДж, то есть окисляют примерно 10 г глюкозы). Таким образом, видна взаимная польза от симбиоза растений и азотфиксирующих бактерий — первые предоставляют вторым «место для проживания» и снабжают полученным в результате фотосинтеза «топливом» — глюкозой, вторые обеспечивают необходимый растениям азот в усваиваемой ими форме.
Азот в форме аммиака и соединений аммония, получающийся в процессах биогенной азотфиксации, быстро окисляется до нитратов и нитритов (этот процесс носит название нитрификации). Последние, не связанные тканями растений (и далее по пищевой цепи травоядными и хищниками), недолго остаются в почве. Большинство нитратов и нитритов хорошо растворимы, поэтому они смываются водой и в конце концов попадают в мировой океан (этот поток оценивается в 2,5—8·10 7 т/год).
Азот, включённый в ткани растений и животных, после их гибели подвергается аммонификации (разложению содержащих азот сложных соединений с выделением аммиака и ионов аммония) и денитрификации, то есть выделению атомарного азота, а также его оксидов. Эти процессы целиком происходят благодаря деятельности микроорганизмов в аэробных и анаэробных условиях.
В отсутствие деятельности человека процессы связывания азота и нитрификации практически полностью уравновешены противоположными реакциями денитрификации. Часть азота поступает в атмосферу из мантии с извержениями вулканов, часть прочно фиксируется в почвах и глинистых минералах, кроме того, постоянно идёт утечка азота из верхних слоёв атмосферы в межпланетное пространство.
Токсикология азота и его соединений
Сам по себе атмосферный азот достаточно инертен, чтобы оказывать непосредственное влияние на организм человека и млекопитающих. Тем не менее, при повышенном давлении он вызывает наркоз, опьянение или удушье (при недостатке кислорода); при быстром снижении давления азот вызывает кессонную болезнь.
Многие соединения азота очень активны и нередко токсичны.
Получение
В лабораториях его можно получать по реакции разложения нитрита аммония:
Реакция экзотермическая, идёт с выделением 80 ккал (335 кДж), поэтому требуется охлаждение сосуда при её протекании (хотя для начала реакции требуется нагревание нитрита аммония).
Практически эту реакцию выполняют, добавляя по каплям насыщенный раствор нитрита натрия в нагретый насыщенный раствор сульфата аммония, при этом образующийся в результате обменной реакции нитрит аммония мгновенно разлагается.
Выделяющийся при этом газ загрязнён аммиаком, оксидом азота (I) и кислородом, от которых его очищают, последовательно пропуская через растворы серной кислоты, сульфата железа (II) и над раскалённой медью. Затем азот осушают.
Ещё один лабораторный способ получения азота — нагревание смеси дихромата калия и сульфата аммония (в соотношении 2:1 по массе). Реакция идёт по уравнениям:

Наиболее чистый азот можно получить разложением азидов металлов:
Так называемый «воздушный», или «атмосферный» азот, то есть смесь азота с благородными газами, получают путём реакции воздуха с раскалённым коксом, при этом образуется так называемый «генераторный», или «воздушный», газ — сырьё для химических синтезов и топливо. При необходимости из него можно выделить азот, поглотив монооксид углерода.
Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом можно получить и «атмосферный азот». Также широко применяются азотные установки и станции, в которых используется метод адсорбционного и мембранного газоразделения.
Один из лабораторных способов — пропускание аммиака над оксидом меди (II) при температуре
Аммиак берут из его насыщенного раствора при нагревании. Количество CuO в 2 раза больше расчётного. Непосредственно перед применением азот очищают от примеси кислорода и аммиака пропусканием над медью и её оксидом (II) (тоже
700 °C), затем сушат концентрированной серной кислотой и сухой щёлочью. Процесс происходит довольно медленно, но он того стоит: газ получается весьма чистый.
Свойства
Физические свойства
При нормальных условиях азот это бесцветный газ, не имеет запаха, мало растворим в воде (2,3 мл/100г при 0 °C, 0,8 мл/100 г при 80 °C), плотность 1,2506 кг/м³ (при н.у.).
В жидком состоянии (темп. кипения −195,8 °C) — бесцветная, подвижная, как вода, жидкость. Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из него кислород.
При −209,86 °C азот переходит в твердое состояние в виде снегоподобной массы или больших белоснежных кристаллов. При контакте с воздухом поглощает из него кислород, при этом плавится, образуя раствор кислорода в азоте.
Известны три кристаллические модификации твёрдого азота. В интервале 36,61 — 63,29 К существует фаза β-N2 с гексагональной плотной упаковкой, пространственная группа P63/mmc, параметры решётки a=3,93 Å и c=6,50 Å. При температуре ниже 36,61 К устойчива фаза α-N2 с кубической решёткой, имеющая пространственную группу Pa3 или P213 и период a=5,660 Å. Под давлением более 3500 атмосфер и температуре ниже 83 K образуется гексагональная фаза γ-N2.
Химические свойства, строение молекулы
Даже при 3000 °C степень термической диссоциации N2 составляет всего 0,1 %, и лишь при температуре около 5000 °C достигает нескольких процентов (при нормальном давлении). В высоких слоях атмосферы происходит фотохимическая диссоциация молекул N2. В лабораторных условиях можно получить атомарный азот, пропуская газообразный N2 при сильном разряжении через поле высокочастотного электрического разряда. Атомарный азот намного активнее молекулярного: в частности, при обычной температуре он реагирует с серой, фосфором, мышьяком и с рядом металлов, например, со ртутью.
Вследствие большой прочности молекулы азота некоторые его соединения эндотермичны (многие галогениды, азиды, оксиды), то есть энтальпия их образования положительна, а соединения азота термически малоустойчивы и довольно легко разлагаются при нагревании. Именно поэтому азот на Земле находится по большей части в свободном состоянии.
Ввиду своей значительной инертности азот при обычных условиях реагирует только с литием:
при нагревании он реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды:

Наибольшее практическое значение имеет нитрид водорода (аммиак) NH3, получаемый взаимодействием водорода с азотом (см. ниже).
В электрическом разряде реагирует с кислородом, образуя оксид азота(II) NO.
Описано несколько десятков комплексов с молекулярным азотом.
Промышленное связывание атмосферного азота
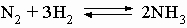
Наиболее распространён аммиачный способ связывания атмосферного азота. Обратимая реакция синтеза аммиака:
экзотермическая (тепловой эффект 92 кДж) и идёт с уменьшением объёма, поэтому для сдвига равновесия вправо в соответствии с принципом Ле Шателье — Брауна необходимо охлаждение смеси и высокие давления. Однако с кинетической точки зрения снижение температуры невыгодно, так как при этом сильно снижается скорость реакции — уже при 700 °C скорость реакции слишком мала для её практического использования.
В таких случаях используется катализ, так как подходящий катализатор позволяет увеличить скорость реакции без сдвига равновесия. В процессе поиска подходящего катализатора было испробовано около двадцати тысяч различных соединений. По совокупности свойств (каталитическая активность, стойкость к отравлению, дешевизна) наибольшее применение получил катализатор на основе металлического железа с примесями оксидов алюминия и калия. Процесс ведут при температуре 400—600 °C и давлениях 10—1000 атмосфер.
Следует отметить, что при давлениях выше 2000 атмосфер синтез аммиака из смеси водорода и азота идёт с высокой скоростью и без катализатора. Например, при 850 °C и 4500 атмосфер выход продукта составляет 97 %.
Существует и ещё один, менее распространённый способ промышленного связывания атмосферного азота — цианамидный метод, основанный на реакции карбида кальция с азотом при 1000 °C. Реакция происходит по уравнению:
Реакция экзотермична, её тепловой эффект 293 кДж.
Ежегодно из атмосферы Земли промышленным путём отбирается примерно 1·10 6 т азота.
Соединения азота
Степени окисления азота в соединениях −3, −2, −1, 0, +1, +2, +3, +4, +5.
Применение
Жидкий азот применяется как хладагент и для криотерапии.
Промышленные применения газообразного азота обусловлены его инертными свойствами. Газообразный азот пожаро- и взрывобезопасен, препятствует окислению, гниению. В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений. В горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды, для распирания пластов породы. В производстве электроники азот применяется для продувки областей, не допускающих наличия окисляющего кислорода. Если в процессе, традиционно проходящем с использованием воздуха, окисление или гниение являются негативными факторами — азот может успешно заместить воздух.
Важной областью применения азота является его использование для дальнейшего синтеза самых разнообразных соединений, содержащих азот, таких, как аммиак, азотные удобрения, взрывчатые вещества, красители и т. п. Большие количества азота используются в коксовом производстве («сухое тушение кокса») при выгрузке кокса из коксовых батарей, а также для «передавливания» топлива в ракетах из баков в насосы или двигатели.
В пищевой промышленности азот зарегистрирован в качестве пищевой добавки E941, как газовая среда для упаковки и хранения, хладагент, а жидкий азот применяется при разливе масел и негазированных напитков для создания избыточного давления и инертной среды в мягкой таре.
Газообразным азотом заполняют камеры шин шасси летательных аппаратов. Кроме того, в последнее время заполнение шин азотом стало популярно и среди автолюбителей, хотя однозначных доказательств эффективности использования азота вместо воздуха для наполнения автомобильных шин нет.
Жидкий азот нередко демонстрируется в кинофильмах в качестве вещества, способного мгновенно заморозить достаточно крупные объекты. Это широко распространённое заблуждение. Даже для замораживания цветка необходимо достаточно продолжительное время. Это связано отчасти с весьма низкой теплоёмкостью азота. По этой же причине весьма затруднительно охлаждать, скажем, замки до −196 °C и раскалывать их одним ударом.
Литр жидкого азота, испаряясь и нагреваясь до 20 °C, образует примерно 700 литров газа. По этой причине жидкий азот хранят в специальных сосудах Дьюара с вакуумной изоляцией открытого типа или криогенных ёмкостях под давлением. На этом же факте основан принцип тушения пожаров жидким азотом. Испаряясь, азот вытесняет кислород, необходимый для горения, и пожар прекращается. Так как азот, в отличие от воды, пены или порошка, просто испаряется и выветривается, азотное пожаротушение — самый эффективный с точки зрения сохранности ценностей механизм тушения пожаров.
Заморозка жидким азотом живых существ с возможностью последующей их разморозки проблематична. Проблема заключается в невозможности заморозить (и разморозить) существо достаточно быстро, чтобы неоднородность заморозки не сказалась на его жизненных функциях. Станислав Лем, фантазируя на эту тему в книге «Фиаско», придумал экстренную систему заморозки азотом, в которой шланг с азотом, выбивая зубы, вонзался в рот астронавта и внутрь его подавался обильный поток азота.
Маркировка баллонов
Баллоны с азотом окрашены в чёрный цвет, должны иметь надпись жёлтого цвета и коричневую полосу (согласно нормам РФ).
Интересные факты
Цитата из Большой Советской Энциклопедии издания 1952 г. (том 1, стр. 452, статья «Азот»):
Словари
252 
Химический элемент, газ без цвета и запаха, составляющий основную часть воздуха и являющийся одним из главных элементов питания растений.
|| Химический элемент (хим.).
Газ без цвета и запаха, химический элемент, не поддерживающий горения, главная составная часть воздуха, входящий в состав белков и нуклеиновых кислот (является одним из главных элементов питания растений).
Азот применяется как инертная среда для многих технологических процессов.
Нахождение в природе
В лаборатории чистый («химический») азот получают, добавляя при нагревании насыщенный раствор хлорида аммония NH4Cl к твердому нитриту натрия NaNO2:
Можно также нагревать твердый нитрит аммония:
Физические и химические свойства
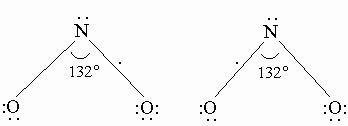
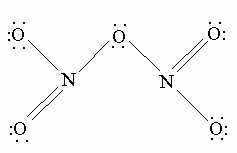
Энергия связи атомов в молекуле N2 очень велика и составляет 941,6 кДж/моль. Расстояние между центрами атомов в молекуле 0,110 нм. Это свидетельствует о том, что связь между атомами азота тройная. Высокая прочность молекулы N2 может быть объяснена в рамках метода молекулярных орбиталей. Энергетическая схема заполнения молекулярных орбиталей в молекуле N2 показывает, что электронами в ней заполнены только связывающие s- и p-орбитали. Молекула азота немагнитна (диамагнитна).
Известно несколько оксидов азота (см. АЗОТА ОКСИДЫ). С галогенами азот непосредственно не реагирует, косвенными путями получены NF3, NCl3, NBr3 и NI3, а также несколько оксигалогенидов (соединений, в состав которых, кроме азота, входят атомы и галогена, и кислорода, например, NOF3).
Азот не реагирует с серой, углеродом, фосфором, кремнием и некоторыми другими неметаллами.
При нагревании азот реагирует с магнием и щелочноземельными металлами, при этом возникают солеобразные нитриды общей формулы М3N2, которые разлагаются водой с образованием соответствующих гидроксидов и аммиака, например:
Аналогично ведут себя и нитриды щелочных металлов. Взаимодействие азота с переходными металлами приводит к образованию твердых металлоподобных нитридов различного состава. Например, при взаимодействии железа и азота образуются нитриды железа состава Fe2N и Fe4N. При нагревании азота с ацетиленом C2H2 может быть получен цианистый водород HCN.
Из сложных неорганических соединений азота наибольшее значение имеют азотная кислота (см. АЗОТНАЯ КИСЛОТА) HNO3, ее соли нитраты (см. НИТРАТЫ), а также азотистая кислота HNO2 и ее соли нитриты (см. НИТРИТЫ).
В промышленности газ азот используют главным образом для получения аммиака (см. АММИАК). Как химически инертный газ азот применяют для обеспечения инертной среды в различных химических и металлургических процессах, при перекачке горючих жидкостей. Жидкий азот широко используют как хладагент (см. ХЛАДАГЕНТ), его применяют в медицине, особенно в косметологии. Важное значение в поддержании плодородия почв имеют азотные минеральные удобрения (см. МИНЕРАЛЬНЫЕ УДОБРЕНИЯ).
Химический элемент, газ без цвета и запаха, не поддерживающий горения (составляет основную по объему или массе часть воздуха, является одним из главных элементов питания растений).
химический элемент (ат. номер 7) VA подгруппы периодической системы элементов. Атмосфера Земли содержит 78% (об.) азота. Чтобы показать, как велики эти запасы азота, отметим, что в атмосфере над каждым квадратным километром земной поверхности находится столько азота, что из него можно получить до 50 млн. т нитрата натрия или 10 млн. т аммиака (соединение азота с водородом) и все же это составляет малую долю азота, содержащегося в земной коре. Существование свободного азота свидетельствует о его инертности и трудности взаимодействия с другими элементами при обычной температуре. Связанный азот входит в состав как органической, так и неорганической материи. Растительный и животный мир содержит азот, связанный с углеродом и кислородом в белках. Помимо этого известны и могут быть получены в больших количествах азотсодержащие неорганические соединения, такие, как нитраты (NO3-), нитриты (NO2-), цианиды (CN-), нитриды (N3-) и азиды (N3-).
Историческая справка. Опыты А. Лавуазье, посвященные исследованию роли атмосферы в поддержании жизни и процессов горения, подтвердили существование относительно инертного вещества в атмосфере. Не установив элементную природу остающегося после сгорания газа, Лавуазье назвал его azote, что на древнегреческом означает «безжизненный». В 1772 Д.Резерфорд из Эдинбурга установил, что этот газ является элементом, и назвал его «вредный воздух». Латинское название азота происходит от греческих слов nitron и gen, что означает «образующий селитру».
Фиксация азота и азотный цикл. Термин «фиксация азота» означает процесс связывания атмосферного азота N2. В природе это может происходить двумя путями: либо бобовые растения, например горох, клевер и соя, накапливают на своих корнях клубеньки, в которых бактерии, фиксирующие азот, превращают его в нитраты, либо происходит окисление атмосферного азота кислородом в условиях разряда молнии. С.Аррениус установил, что таким способом фиксируется до 400 млн. т азота ежегодно. В атмосфере оксиды азота соединяются с дождевой водой, образуя азотную и азотистую кислоты. Кроме того, установлено, что с дождем и снегом на каждый гектар земли попадает ок. 6700 г азота; достигая почвы, они превращаются в нитриты и нитраты. Растения используют нитраты для образования растительных белковых веществ. Животные, питаясь этими растениями, усваивают белковые вещества растений и превращают их в животные белки. После смерти животных и растений происходит их разложение, азотные соединения превращаются в аммиак. Аммиак используется двумя путями: бактерии, не образующие нитратов, разрушают его до элементов, выделяя азот и водород, а другие бактерии образуют из него нитриты, которые другими бактериями окисляются до нитратов. Таким образом происходит круговорот азота в природе, или азотный цикл.
КРУГОВОРОТ АЗОТА В ПРИРОДЕ
Строение ядра и электронных оболочек. В природе существуют два стабильных изотопа азота: с массовым числом 14 (N содержит 7 протонов и 7 нейтронов) и с массовым числом 15 ( содержит 7 протонов и 8 нейтронов). Их соотношение составляет 99,635:0,365, поэтому атомная масса азота равна 14,008. Нестабильные изотопы азота 12N, 13N, 16N, 17N получены искусственно. Схематически электронное строение атома азота таково: 1s22s22px12py12pz1. Следовательно, на внешней (второй) электронной оболочке находится 5 электронов, которые могут участвовать в образовании химических связей; орбитали азота могут также принимать электроны, т.е. возможно образование соединений со степенью окисления от (-III) до (V), и они известны.
Получение и применение. Способ получения элементного азота зависит от требуемой его чистоты. В огромных количествах азот получают для синтеза аммиака, при этом допустимы небольшие примеси благородных газов.
Азот из атмосферы. Экономически выделение азота из атмосферы обусловлено дешевизной метода сжижения очищенного воздуха (пары воды, CO2, пыль, другие примеси удалены). Последовательные циклы сжатия, охлаждения и расширения такого воздуха приводят к его сжижению. Жидкий воздух подвергают фракционной перегонке при медленном подъеме температуры. Первыми выделяются благородные газы, затем азот, и остается жидкий кислород. Очистка достигается многократностью процессов фракционирования. Таким методом производят многие миллионы тонн азота ежегодно, преимущественно для синтеза аммиака, который является исходным сырьем в технологии производства различных азотсодержащих соединений для промышленности и сельского хозяйства. Кроме того, очищенную азотную атмосферу часто используют, когда недопустимо присутствие кислорода.
Лабораторные способы. Азот в небольших количествах можно получать в лаборатории разными способами, окисляя аммиак или ион аммония, например:
Очень удобен процесс окисления иона аммония нитрит-ионом:
При каталитическом разложении аммиака при высокой температуре тоже можно получить азот:
Физические свойства. Некоторые физические свойства азота приведены в табл. 1.
Таблица 1. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА
первый 14,54 второй 29,60
а Температура и давление, при которых плотности азота жидкого и газообразного состояния одинаковы.
б Количество энергии, необходимое для удаления первого внешнего и следующего за ним электронов, в расчете на 1 моль атомарного азота.
Таблица 2. СТЕПЕНИ ОКИСЛЕНИЯ АЗОТА И СООТВЕТСТВУЮЩИЕ СОЕДИНЕНИЯ
Степень окисления Примеры соединений
Ионные нитриды. Связь в этих соединениях предполагает переход электронов от металла к азоту с образованием иона N3-. К таким нитридам относятся Li3N, Mg3N2, Zn3N2 и Cu3N2. Кроме лития, другие щелочные металлы IA подгруппы нитридов не образуют. Ионные нитриды имеют высокие температуры плавления, реагируют с водой, образуя NH3 и гидроксиды металлов.
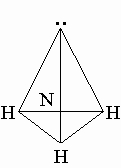
Строение молекулы. Молекула NH3 имеет почти пирамидальное строение. Угол связи H-N-H составляет 107°, что близко к величине тетраэдрического угла 109°. Неподеленная электронная пара эквивалентна присоединенной группе, в результате координационное число азота равно 4 и азот располагается в центре тетраэдра.
Cвойства аммиака. Некоторые физические свойств аммиака в сравнении с водой приведены в табл. 3.
Таблица 3. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА И ВОДЫ
Температуры кипения и плавления у аммиака намного ниже, чем у воды, несмотря на близость молекулярных масс и сходство строения молекул. Это объясняется относительно большей прочностью межмолекулярных связей у воды, чем у аммиака (такая межмолекулярная связь называется водородной).
Аммиак как растворитель. Высокая диэлектрическая проницаемость и дипольный момент жидкого аммиака позволяют использовать его как растворитель для полярных или ионных неорганических веществ. Аммиак-растворитель занимает промежуточное положение между водой и органическими растворителями типа этилового спирта. Щелочные и щелочноземельные металлы растворяются в аммиаке, образуя темносиние растворы. Можно полагать, что в растворе происходит сольватация и ионизация валентных электронов по схеме
Синий цвет связывают с сольватацией и движением электронов или с подвижностью «дырок» в жидкости. При высокой концентрации натрия в жидком аммиаке раствор принимает бронзовую окраску и отличается высокой электропроводностью. Несвязанный щелочной металл можно выделить из такого раствора испарением аммиака или добавлением хлорида натрия. Растворы металлов в аммиаке являются хорошими восстановителями. В жидком аммиаке происходит автоионизация
аналогично процессу, протекающему в воде
Некоторые химические свойства обеих систем сопоставлены в табл. 4. Жидкий аммиак как растворитель имеет преимущество в некоторых случаях, когда невозможно проводить реакции в воде из-за быстрого взаимодействия компонентов с водой (например, окисление и восстановление). Например, в жидком аммиаке кальций реагирует с KCl с образованием CaCl2 и K, поскольку CaCl2 нерастворим в жидком аммиаке, а К растворим, и реакция протекает полностью. В воде такая реакция невозможна из-за быстрого взаимодействия Ca с водой. Получение аммиака. Газообразный NH3 выделяется из солей аммония при действии сильного основания, например, NaOH:
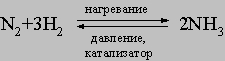
Метод применим в лабораторных условиях. Небольшие производства аммиака основаны также на гидролизе нитридов, например Mg3N2, водой. Цианамид кальция CaCN2 при взаимодействии с водой также образует аммиак. Основным промышленным методом получения аммиака является каталитический синтез его из атмосферного азота и водорода при высоких температуре и давлении:
Водород для этого синтеза получают термическим крекингом углеводородов, действием паров воды на уголь или железо, разложением спиртов парами воды или электролизом воды. На синтез аммиака получено множество патентов, отличающихся условиями проведения процесса (температура, давление, катализатор). Существует способ промышленного получения при термической перегонке угля. С технологической разработкой синтеза аммиака связаны имена Ф.Габера и К.Боша.
Химические свойства аммиака. Кроме реакций, упомянутых в табл. 4, аммиак реагирует с водой, образуя соединение NH3ЧH2O, которое часто ошибочно считают гидроксидом аммония NH4OH; в действительности существование NH4OH в растворе не доказано. Водный раствор аммиака («нашатырный спирт») состоит преимущественно из NH3, H2O и малых концентраций ионов NH4+ и OH-, образующихся при диссоциации
Любые ион или молекула, способные принимать электронную пару (электрофильное соединение), будут взаимодействовать с NH3 с образованием координационного соединения. Например:
Символ Mn+ представляет ион переходного металла (B-подгруппы периодической таблицы, например, Cu2+, Mn2+ и др.). Любая протонная (т.е. Н-содержащая) кислота реагирует с аммиаком в водном растворе с образованием солей аммония, таких, как нитрат аммония NH4NO3, хлорид аммония NH4Cl, сульфат аммония (NH4)2SO4, фосфат аммония (NH4)3PO4. Эти соли широко применяются в сельском хозяйстве как удобрения для введения азота в почву. Нитрат аммония кроме того применяют как недорогое взрывчатое вещество; впервые оно было применено с нефтяным топливом (дизельным маслом). Водный раствор аммиака применяют непосредственно для введения в почву или с орошающей водой. Мочевина NH2CONH2, получаемая синтезом из аммиака и углекислого газа, также является удобрением. Газообразный аммиак реагирует с металлами типа Na и K с образованием амидов:
Аммиак реагирует с гидридами и нитридами также с образованием амидов:
Амиды щелочных металлов (например, NaNH2) реагируют с N2O при нагревании, образуя азиды:
Газообразный NH3 восстанавливает оксиды тяжелых металлов до металлов при высокой температуре, по-видимому, благодаря водороду, образующемуся в результате разложения аммиака на N2 и H2:
Атомы водорода в молекуле NH3 могут замещаться на галоген. Иод реагирует с концентрированным раствором NH3, образуя смесь веществ, содержащую NI3. Это вещество очень неустойчиво и взрывается при малейшем механическом воздействии. При реакции NH3 c Cl2 образуются хлорамины NCl3, NHCl2 и NH2Cl. При воздействии на аммиак гипохлорита натрия NaOCl (образуется из NaOH и Cl2) конечным продуктом является гидразин:
В кислой среде (H+) гидразин образует растворимые соли гидразония типа [[NH2NH2H]]+X-. Легкость, с которой гидразин и некоторые его производные (например, метилгидразин) реагируют с кислородом, позволяет использовать его в качестве компонента жидкого ракетного топлива. Гидразин и все его производные сильно ядовиты. Оксиды азота. В соединениях с кислородом азот проявляет все степени окисления, образуя оксиды: N2O, NO, N2O3, NO2 (N2O4), N2O5. Имеется скудная информация об образовании пероксидов азота (NO3, NO4). Оксид азота(I) N2O (монооксид диазота) получается при термической диссоциации нитрата аммония:
Молекула имеет линейное строение
NO образуется также при термическом разложении азотной кислоты или при реакции меди с разбавленной азотной кислотой:
NO2 получается каталитическим окислением аммиака в избытке кислорода или окислением NO на воздухе:
а также по реакциям:
N2O5 легко растворяется во влаге воздуха, вновь образуя HNO3. Свойства N2O5 определяются равновесием
Азотистая кислота HNO2 не существует в чистом виде, однако водные растворы ее невысокой концентрации образуются при добавлении серной кислоты к нитриту бария:
Справочник азотчика. М., 1969 Некрасов Б.В. Основы общей химии. М., 1973 Проблемы фиксации азота. Неорганическая и физическая химия. М., 1982
один из пяти главных городов филистимских на восточном берегу Средиземного моря, между Аккароном и Аскалоном. Здесь находился храм Дагона, в котором филистимляне поставили ковчег завета (Нав. 11, 22; 13,3; 15, 47; Суд. 1, 18; Деян. 8, 40).
азо́т, азо́ты, азо́та, азо́тов, азо́ту, азо́там, азо́том, азо́тами, азо́те, азо́тах
сущ., кол-во синонимов: 8
Слово «азот» стало известно и употребляется в русском языке с XVIII в. как научный термин, называющий химический элемент, бесцветный газ.
— Монополист в воздухе.
— Удобрение, витающее в воздухе.
— Воздух на три четверти.
— Газ, который закачивают в шины гоночного болида.
— Этот газ, составляющая воздуха, практически отсутствовал в первичной атмосфере Земли 4,5 млрд лет назад.
— Газ, делающий металл хрупким.
— Главный компонент вдыхаемого вами воздуха, которым в чистом виде дышать нельзя.
— Газ, чья жидкость служит для охлаждения сверхточных приборов.
— Какой газ в жидком состоянии хранят в сосуде Дьюара?
— Газ, заморозивший Терминатора II.
— Какой газ тушит огонь?
— Самый распространённый элемент в атмосфере.
— Химический элемент, N.
— Газ, из которого на 78% состоит воздух.
— Химический элемент, один из основных питательных веществ растений.
— Химический элемент, составная часть воздуха.
— В 1887 году биолог Томас Гексли предсказывал гибель человечества из-за того, что растения используют весь этот элемент из почвы, а месторождения чилийской селитры истощатся.
— Хорваты называют этот газ «душиком».
— Химический элемент, газ.
— На латыни этот газ называется «nitrogenium», то есть «рождающий селитру».
— Название этого газа произошло от латинского слова «безжизненный».
— Основа всех нитратов.
— Магический меч Парацельса.
ПОДГРУППА VA. СЕМЕЙСТВО АЗОТА ФОСФОРА
Тенденция изменения свойств от неметаллических до металлических, которая выявлена в подгруппах IIIA и IVA, характерна и для этой подгруппы. Переход к металличности (хотя и нерезкий) начинается с мышьяка, у которого в отличие от фосфора уже заполнен 18 электронами электронный слой, расположенный под валентными электронами (табл. 6). Однако ни As, ни Sb не имеют типичных металлических свойств, как можно было бы ожидать у элементов с такой электронной структурой. Полностью металлическая природа элемента проявляется в этой подгруппе только у висмута, хотя и его металлические свойства не ярко выражены, особенно по проводимости.
Химический элемент азот, N, седьмой элемент периодической таблицы элементов и первый элемент подгруппы VA. Наиболее распространенная форма азота изотоп 147N, в ядре которого содержится семь протонов и семь нейтронов. Общее содержание этого изотопа азота в природе равно 99,635%, остальное количество (0,365%) составляет изотоп 157N, содержащий в ядре 7 протонов и восемь нейтронов; атомная масса азота соответственно равна 14,008.
Около 79% (об.) азота в атмосфере состоит из двухатомных молекул N2. В природе существует примерный баланс азота: с одной стороны, азот из атмосферы усваивается бактериями и расходуется в химических и электрических (молния) процессах, а с другой, азот возвращается в атмосферу при разложении азотсодержащих веществ. Азот бесцветный газ. Он имеет ничтожную растворимость в воде, всего 23 мл/л при 0° C и 1 атм.
Азот выделяют из воздуха сжижением. При этом вначале азот и кислород отделяются от CO2, паров H2O и некоторых примесей химическими и механическими методами (адсорбция, охлаждение, фильтрация). При медленном нагревании жидкий воздух подвергается фракционной перегонке и при этом азот отделяется от остающегося жидкого кислорода. Благородные газы (He, Ne, Ar, Kr, Xe) выкипают раньше, чем азот, и, если необходимо, их сжижают вместе.
Химическая связь в молекуле азота очень прочная, поэтому азот совершенно инертен при низких температурах. В условиях электрического разряда или электрической дуги азот соединяется с кислородом, образуя несколько оксидов, в основном оксид азота(II) NO и оксид азота(IV) NO2. Известны и другие оксиды азота, их получают по следующим реакциям:
1) оксид азота(I) N2O
2) оксид азота(III) N2O3
3) димер оксида азота(IV) N2O4
4) оксид азота(V) N2O5
Аммиак. При высоких температуре и давлении азот соединяется с водородом на поверхности платинового катализатора, образуя важное соединение аммиак:
Этот процесс (в промышленности применяют метод Габера или метод Клода) относится к процессам фиксации азота, так как образующийся из химически инертного молекулярного атмосферного азота аммиак способен к участию в химических реакциях и образованию других соединений азота и может использоваться для удобрения почвы. Количества азота в атмосфере, находящегося над 1 кв. километром земной поверхности, теоретически достаточно для получения 7 млн. т аммиака. Среди других соединений азота, пригодных в качестве удобрений для почвы и получаемых из аммиака, известны нитрат аммония NH4NO3, получаемый по реакции аммиака с азотной кислотой, фосфат аммония (NH4)3PO4, получаемый по реакции аммиака с фосфорной кислотой H3PO4, и мочевина, образующаяся из аммиака и CO2. Из аммиака также можно получать азотную кислоту HNO3 (окислением аммиака на воздухе с поглощением оксидов азота водой), гидразин NH2NH2 (по реакции аммиака с гипохлоритом натрия NaOCl). Гидразин и некоторые его производные используются в качестве ракетного топлива. Аммиак, гидразин и азотистоводородная кислота HN3 это гидриды азота. Аммиак и вода имеют ряд сходных свойств, позволяющих использовать аммиак как растворитель для некоторых неорганических веществ. Для сравнения приведены два процесса автоионизации аммиака и воды:
Нитриды. При высокой температуре азот реагирует с некоторыми металлами, образуя соединения класса нитридов. Например,
Нитрид магния гидролизуется:
Другие азотсодержащие соединения. Азот также реагирует с карбидом кальция CaC2 при высокой температуре с образованием цианамида кальция CaCN2. При гидролизе цианамида образуется аммиак:
Азот, образуя связь с углеродом, входит в состав многих природных органических соединений, например аминокислот RCHNH2COOH, аминов RNH2 и амидов RCONH2
ФОСФОР, МЫШЬЯК, СУРЬМА, ВИСМУТ
Получение. Некоторые элементы этой подгруппы встречаются в свободном состоянии и известны с древних времен; они относительно легко получаются из их оксидов или сульфидов. Сурьма иногда встречается в свободном состоянии, а другие элементы в основном в виде оксидов или сульфидов и реже в соединениях с другими неметаллами (см. табл. 6). Фосфор занимает 12-е место по распространенности элементов в природе. Он входит в состав многих горных пород и содержится в живых организмах (в костях, зубах и т.д.). Фосфор впервые был выделен из человеческой мочи. Химические связи PO в фосфат-ионе PO43одни из наиболее прочных, поэтому для получения свободного фосфора требуются большие затраты энергии. В промышленности фосфор получают при прокаливании смеси фосфата кальция, оксида кремния(IV) (песка) и кокса при высокой температуре в соответствии с реакцией Ca3(PO4)2 + 3SiO2 + 5C (r) 3CaSiO3 + 0,5P4 + 5CO
Фосфор возгоняют и плавят, в результате образуется белая модификация фосфора, которую хранят под слоем холодной воды (с холодной водой он не реагирует). Другие элементы этого семейства получают из оксидов восстановлением углеродом.
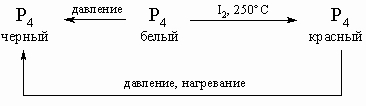
Аллотропия. Все элементы подгруппы, встречающиеся в свободном состоянии, имеют аллотропные модификации (состояния с различной кристаллической или атомной структурой вещества). С ростом атомного номера многообразие и сложность модификаций постепенно уменьшаются. У фосфора известны более 10 аллотропических модификаций, из которых наиболее важные белый, красный и черный фосфор; взаимопревращения между ними представлены следующей схемой:
Отметим некоторые различия в свойствах. Белая модификация как более реакционноспособная активно реагирует с молекулярным кислородом, поэтому белый фосфор применяют в устройствах для воспламенения. Он растворим в CS2, но нерастворим в холодной воде. Белый фосфор очень ядовит, вызывает сильные ожоги и работа с ним требует особой осторожности. Белый фосфор имеет тетраэдрическое строение, компактность такой молекулы объясняет высокую летучесть фосфора. Ковалентные связи в тетраэдре не очень прочные, чем и объясняется образование оксидов, некоторых сульфидов и других соединений. Красная модификация фосфора значительно менее реакционноспособна, чем белая; красный фосфор нерастворим в любых растворителях (как и черный), воде и не так ядовит. Структура ближе к форме связанных треугольников, чем к тетраэдру. Соединения, образуемые из белого или красного фосфора, идентичны. Черный фосфор обладает металличностью некоторой проводимостью и блеском. Мышьяк образует аллотропные модификации, частично подобные модификациям фосфора. Сурьма существенно отличается от фосфора и мышьяка, а висмут демонстрирует многие свойства, характерные для металлических структур.
Применение. Фосфор применяется в основном для химических синтезов, другие элементы находят применение в технологии сплавов. Сурьму добавляют к свинцу для увеличения твердости; сплавы, содержащие до 12% (масс.) сурьмы, применяют в производстве аккумуляторов. Сплавы свинца с висмутом, как и с другими элементами этого семейства, используют в производстве легкоплавких материалов, например, сплава Вуда (Pb, Bi, Sn, Cd). Соединения мышьяка являются инсектицидами. Фосфид натрия (Na3P), синтезируемый из элементов, применяют для изготовления морских сигнальных огней. При реакции фосфидов с водой образуется ядовитое вещество фосфин PH3, запах которого часто обнаруживается при реакции цинка или железа с HCl в водной среде, так как фосфиды могут присутствовать как примеси.
Реакции. Для всех элементов подгруппы характерно общее строение внешнего электронного слоя ns2np3, однако трудно достаточно точно предсказать химические свойства элементов. Азот проявляет все степени окисления от III до V, у фосфора (см. табл. 6) реализуются почти все степени окисления от III до V. Разнообразие степеней окисления уменьшается с ростом массы элемента; висмут в степени окисления V неустойчив, легко восстанавливается до степени окисления III, основной для висмута. В особых условиях все же можно получить соединения этих элементов с необычными степенями окисления. Азот может принимать только 8 электронов от 4 доноров, а остальные элементы являются акцепторами 10, 12 и более электронов (от 5, 6 и более доноров или лигандов). Однако в этом у них мало общего, определенные сходства и различия более четко проявляются при рассмотрении соединений этих элементов.
Оксиды. Кроме азота, все элементы подгруппы VA активно реагируют с кислородом, фосфор образует оксид P(V) P4O10, а другие, более тяжелые элементы только оксиды в степени окисления III. Более легкие элементы образуют оксиды тетраэдрического строения. Для мышьяка и сурьмы кроме As4O6 и Sb4O6 известны также As2O5, Sb2O4 и Sb2O5, но структуры их недостаточно изучены. As2O5 и Sb2O5 получают дегидратацией соответствующих кислот, H3AsO4 и HSb(OH)6. Sb2O4 образуется при прокаливании Sb4O6 или Sb2O5 на воздухе.
Кислоты. Фосфорные кислоты легко получаются при растворении оксидов фосфора. Схема образования многообразных кислот и солей фосфора приведена ниже:
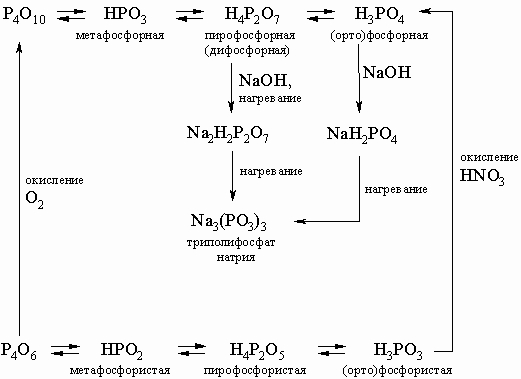
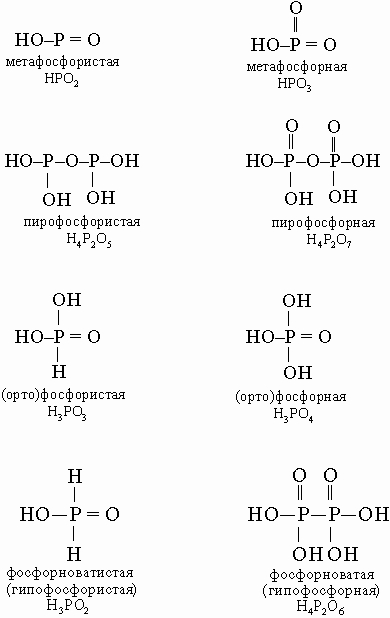
В этой схеме отсутствует фосфорноватистая (гипофосфористая) кислота H3PO2 (сильный восстановитель, образуется в небольших количествах при реакции белого фосфора с кипящей водой), а также фосфорноватая (гипофосфорная) кислота H4P2O6 (получается по реакции красного фосфора с NaOCl в кислой среде). Ниже приводятся структурные формулы некоторых кислот фосфора:
Кислоты других элементов, проявляющих больше металлических свойств, отчасти сходны по форме, однако с ростом молекулярной массы уменьшается способность атомов образовывать прочные двойные связи (такие, как P=O). Поэтому образуются одиночные OH-группы, например, состав ортосурьмяной кислоты HSb(OH)6, а не H3SbO4.
Фосфорные кислоты и их соли находят многочисленные применения в промышленности. Средние фосфаты и полифосфаты Na3P3O6 и более сложного состава применяют в многотоннажном производстве моющих средств, в процессах умягчения и очистки воды. Фосфат кальция CaH4P2O8 применяют при изготовлении муки и в качестве заменителя дрожжей. Ca3P2O8 применяют в производстве зубных порошков и паст, пирофосфаты расходуются для изготовления буровых растворов, в стекольном производстве, в водоподготовке, для очистки металлов и антикоррозионной защиты. Тысячи тонн фосфатов используют как удобрение в сельском хозяйстве: практически нерастворимый Ca3(PO4)2 переводят в растворимую форму Ca(H2PO4)2 добавлением серной или азотной кислоты, причем при использовании азотной кислоты в почву вводится помимо фосфора также и азот в усвояемой форме.
Сульфиды. Сера реагирует непосредственно со всеми элементами подгруппы VA, с фосфором образуются P4S3, P4S7, P4S5, а с P4O10 образуется оксосульфид P4O6S2. P4S3 используют для производства легковоспламеняющихся (небезопасных) спичек, а для изготовления безопасных спичек применяют смесь P4S3 и Sb2S3: сульфид сурьмы входит в состав спичечной головки вместе с окислителем KClO3, а смесь P4S3 и Sb2S3 с песком покрывает боковую поверхность спичечного коробка. Существование As2S5 и Sb2S5 не установлено надежно, а образующийся Bi2S5 самопроизвольно разлагается на S и Bi2S3.
Гидриды. Изменения свойств гидридов элементов этой подгруппы вполне предсказуемы. Аммиак NH3 стабильное соединение со слабыми основными свойствами (донор электронной пары), а в жидком состоянии слабый донор H+. Устойчивость гидридов в подгруппе убывает с увеличением атомного номера, ослабевают донорные способности электронной пары, но возрастает способность к отщеплению водорода; получить BiH3 не просто.
Галогениды. В ряду галогенидов систематичности свойств не наблюдается. Только BiF3 является ионным соединением, что связано с максимальной металличностью висмута в этой подгруппе элементов. Все элементы образуют галогениды состава MX3, а фосфор также и P2Cl4 и P2I4. Среди галогенидов MX5 не установлено образование AsCl5, а висмут образует только BiF5, легко разлагающийся на F2 и BiF3 (поэтому BiF5 хороший фторирующий агент). Фосфор несмотря на малый радиус способен образовывать PCl5 и даже PBr5. Устойчивость этих галогенидов фосфора объясняется слабым окислительным действием P(V) в отличие от Bi(V), а также особенностями строения галогенида (в случае хлорида PCl4+ PCl6). Галогениды MX3 несмотря на наличие неподеленной электронной пары не образуют аддуктов по донорно-акцепторному механизму. Все галогениды энергично реагируют с водой (гидролиз), например:
Однако гидролиз галогенидов азота(III) протекает иначе, чем у галогенидов остальных элементов этой группы.
Взаимодействие с кислотами. Элементы этой группы по-разному реагируют с кислотами. Ни один из них самопроизвольно не взаимодействует с HCl с выделением водорода. Кислоты-окислители, такие, как HNO3, реагируют с As и Sb; сурьма при длительной обработке образует Sb2O4. Висмут растворяется в азотной кислоте, образуя нитрат Bi(NO3)3. Сульфаты мышьяка, сурьмы и висмута можно получать при растворении соответствующих оксидов в серной кислоте.