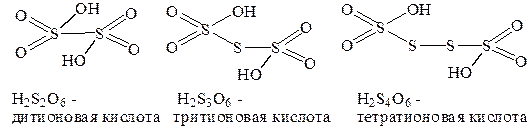Register
Do you already have an account? Login
Login
Don’t you have an account yet? Register
Newsletter
Submit to our newsletter to receive exclusive stories delivered to you inbox!
Суррикат Мими
1)Как классифицируют гидроксиды? Напишите три формулы гидроксидов и назовите их) 2)Напишите уравнения реакций при помощи которых можно получить а) растворимое основание б) практически нерастворимое основание
Лучший ответ:
Мари Умняшка
-К каждому металлу( не металлу) или их оксидов, соответствует свой гидроксид
Основные гидроксиды (основания) — только гидроксиды металлов со степенью окисления +1, +2
Амфотерные гидроксиды, гидроксиды металлов со степенью окисления +3, +4 и нескольких металлов со степенью окисления +2, эти гидроксиды в зависимости от условий реакций проявляют кислотные или основные свойства, нерастворимые в воде вещества
Гидроксиды также делятся на :
— по числу гидроксильных групп :
одноосновные,
двухосновные
трехосновные,
— по растворимости в воде (амфотерные все не растворимы):
Проверить на растворимость можно при помощи табл. растворимости
NaOH- гидроксид натрия( основный)
Al(OH)3-гидроксид алюминия (амфотерный)
H2SO4-серная кислота(кислотный)
2Na + 2H₂O = 2NaOH + H₂
взаимодействие натрия с водой. Натрий метал со степенью окисления +1 и в табл. растворимости стоит буква Р
2NaOH + FeSO₄ = Fe(OH)₂ + Na₂SO₄
Ну тут у нас типичный не растворимы гидроксид железа 2. Проверку осуществляем опять же по таблице
Урок №44. Гидроксиды. Основания: классификация, номенклатура, получение
Гидроксиды
ОСНОВАНИЯ
NaOH – гидроксид натрия,
KOH – гидроксид калия,
Ca(OH) 2 – гидроксид кальция,
Fe(OH) 3 – гидроксид железа (III),
Ba(OH) 2 – гидроксид бария.
Классификация оснований
Щёлочи – это основания растворимые в воде.
К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью как кислоты.
Классификация оснований по числу групп ОН:
Физические свойства
Большинство оснований – твёрдые вещества с различной растворимостью в воде.
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ
1. Металл + H 2 O = ЩЁЛОЧЬ + Н 2 ↑
2Na + 2H 2 O = 2NaOH + H 2
2. ОКСИД МЕТАЛЛА + H 2 O = ЩЁЛОЧЬ
Na 2 O + H 2 O = 2 NaOH
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba, Ra, Sr)
СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
Ме х А у + Ме * (OH) n = Me(OH) у ↓+Ме * х А n
CuSO 4 + 2 NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
ВЫПОЛНИТЕ ЗАДАНИЯ:
№1. Классифицируйте формулы:
№2. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P 2 O 5 , Ca(OH) 2 , CO, Al(OH) 3 , BeO, Mg(OH) 2 , K 2 O, ZnO, KOH, CrO 3
№3. Приведите по два уравнения реакций получения следующих оснований:
Урок №5 Составление формул гидроксидов (оснований)
При помощи таблицы Менделеева научить составлять формулы оснований, правильно их называть.
Сложные вещества классифицируются на оксиды, гидроксиды и соли. Гидроксиды по характеру бывают основные (образованы из основных оксидов) и кислотные (образованы из кислотных оксидов). Название ГИДРОКСИД исторически закрепилось только за основными гидроксидами (по-другому основания), а кислотные гидроксиды назывются кислотами.
ПРИМЕР: Возьмем гидроксид кальция (техническое название гашеная известь, известковое молоко). На первое место ставим металл кальций, на второе OH группу, валентность кальция 2, значит формула Ca(OH)2. Индекс 2 ставится за скобкой. Читается кальций-о-аш-дважды.
ПРИМЕР: Возьмем гидроксид алюминия (входит в состав лекарства альмагель).По таблице Менделеева алюминий трехвалентен, значит формула будет Al(OH)3 читается алюминий-о-аш-трижды.
Гидроксиды первой группы и Ca(OH)2 Ba(OH)2 называются еще щелочами, потому что растворяются в воде. Это очень сильные основания, поэтому их так же называют едкими щелочами.
Если металл переменной валентности, не забудь указать ее в названии. Fe(OH)2 гидроксид железа(2), Fe(OH)3 гидроксид железа (3). Цифры в круглых скобках лучше писать римскими.
Кот ученый: А я знаю, что KOH и LiOH используются в кадмиево-никелевых и железо-никелевых аккумуляторах.
Правильно. но не только в них. Без щелочей и других оснований невозможно представить себе строительство, легкую промышленность (текстильное, кожевенное), целлилозно-бумажное и многие другие производства, всех не перечислишь.
Как видишь, это очень важные вещества, научись составлять их формулы. Пока! Faina
Гидроксиды – основные (основания), амфотерные, кислотные (оксокислоты).
В соответствии с преимущественно ионным характером химической связи Э-ОН основные гидроксиды (основания) при растворении в воде диссоциируют с образованием гидроксид-ионов и катионов, причем, в зависимости от эффективности (степени) диссоциации различают сильные основания (NaOH, Ba(OH)2), диссоциирующие практически нацело, основания средней силы (Tl(OH), Mg(OH)2, Cr(OH)2) и слабые основания (Сu(OH), Fe(OH)2), диссоциация которых протекает частично:
Kислоты располагаются в порядке убывания их силы (активности) в так называемом ряду активности кислот:
Сильные Средней силы
Амфотерные гидроксиды в основном плохо растворимы в воде и проявляют как слабые основные, так и кислотные свойства:
Образование в процессе диссоциации гидроксидов катионов гидроксония, или гидроксид-ионов определяет важнейшее химическое свойство гидроксидов – реакцию нейтрализации, приводящую к образованию воды и соли при взаимодействии оснований и кислот:
Обладая кислотно-основной двойственностью, амфотерные гидроксиды в реакциях нейтрализации могут выступать как в качестве основания, так и кислоты:
HIO + NaOH = NaIO + H2O
Подобно амфотерным оксидам металлов, взаимодействие с основаниями их гидроксидов в водных растворах приводит к образованию солей, содержащих не оксо-, а гидроксокомплексные анионы:
Образование же оксосолей происходит при взаимодействии амфотерных гидроксидов со щелочными расплавами:
По растворимости основания делятся на растворимые и нерастворимые. Основания щелочных (Li, Na, K, Rb, Cs) и щелочноземельных (Ca, Sr, Ba) металлов являются растворимыми в воде и называются щелочами.
Систематические названия основных и амфотерных гидроксидов образуются из слова гидроксид и русского названия элемента в родительном падеже с указанием (для элементов с переменной степенью окисления) римскими цифрами в круглых скобках степени окисления элемента:
Тривиальные названия некоторых гидроксидов, в основном используемые в технической литературе, приведены в приложении 2.
Следует отметить специфику названия водного раствора аммиака, частичная диссоциация которого приводит к образованию в растворе гидроксид-ионов и проявлению слабых основных свойств. Ранее полагали, что в водном растворе аммиак образует гидроксид аммония состава NH4OH. Однако в настоящее время установлено, что основной формой существования аммиака в водном растворе является его гидратированные молекулы, которые условно записывают в виде NH3×H2O и называют гидрат аммиака. Подобно аммиаку, водные растворы гидразина N2H4 и гидроксиламина NH2OH также в основном содержат гидратированные молекулы, которые называют: N2H4×H2O – гидрат гидразина и NH2OH×H2O – гидрат гидроксиламина.

10. Приведите систематические названия гидроксидов, классифицируйте их по кислотности и растворимости: LiOH, Sr(OH)2, Cu(OH)2, Cd(OH)2, Al(OH)3, Cr(OH)3. Приведите формулы соответствующих им оксидов.
11. Приведите молекулярные и графические формулы гидроксидов: гидроксид железа (III), гидроксид берилия, гидроксид лития, гидроксид хрома (III), гидроксид магния. Какие из данных гидроксидов будут взаимодействовать а) с гидроксидом калия, б) с оксидом бария, в) с соляной кислотой? Написать уравнения реакций.
12. Приведите реакции, демонстрирующие кислотно-основные свойства гидроксидов бария, цинка, калия и хрома (III), а также методы их получения.
Систематические названия кислотных гидроксидов (оксокислот)строятся по правилам номенклатуры для комплексных соединений, которые будут рассмотрены ниже. В тоже время, в отечественной практике широко используются традиционные названия распространенных оксокислот – угольная, серная, фосфорная и т.д. Их применение допустимо, но только для ограниченного круга действительно наиболее распространенных кислот, а в остальных случаях следует применять систематические названия.
Традиционное название оксокислоты состоит из двух слов: названия кислоты, выраженного прилагательным и группового слова кислота.Название кислоты образуется из русского названия кислотообразующего элемента (если в названии элемента есть окончание «й», «о», «а», то оно опускается) с добавлением, в зависимости от степени окисления элемента, различных окончаний (табл. 1.3, 1.4). По традиции H2CO3 называют угольной, а не углеродной кислотой.
В соответствии с менделеевским правилом «четности» для кислотообразующих p-элементов IV-VI группы наиболее характерны степени окисления соответствующие номеру группы N, а также N-2 и N-4.
В некоторых случаях происходит образование двух форм кислот, в которых кислотообразующий элемент находится в одинаковой степени окисления. К названию кислоты с бóльшим количеством гидроксо-групп прибавляется приставка орто-, а к названию кислоты с мéньшим числом гидроксо-групп прибавляется приставка мета-.
Таблица 3. Традиционные названия оксокислот р-элементов III-VI группы.
| N | Э z+ | Окончание | Название кислоты |
| Высшая степень окисления элемента N | |||
| III | B 3+ | -ная | H3BO3 ортоборная, HBO2 метаборная,H2B4O7 тетраборная |
| Al 3+ | -евая | H3AlO3 ортоалюминиевая, HАlO2 метаалюминевая | |
| IV | C 4+ | -ная | H2CO3 угольная |
| Si 4+ | -евая | H4SiO4 ортокремниевая, H2SiO3 метакремниевая | |
| Ge 4+ | -евая | H4GeO4 ортогерманиевая, H2GeO3 метагерманиевая | |
| Sn 4+ | -янная | H4SnO4 ортооловянная, H2SnO3 метаоловянная | |
| V | N 5+ | -ная | HNO3 азотная |
| P 5+ | -ная | H3PO4 ортофосфорная, HPO3 метафосфорная, H4P2O7 дифосфорная, H5P3O10 трифосфорная | |
| As 5+ | -овая | H3AsO4 ортомышьяковая, HasO3 метамышьяковая | |
| Sb 5+ | -яная | H3SbO4 ортосурьмяная, HSbO3 метасурьмяная | |
| VI | S 6+ | -ная | H2SO4 серная, H2S2O7 дисерная |
| Se 6+ | -овая | H2SeO4 селеновая | |
| Te 6+ | -овая | H6TeO6 ортотеллуровая, H2TeO4 метателлуровая | |
| Степень окисления элемента N-2 | |||
| V | N 3+ | -истая | HNO2 азотистая |
| P 3+ | -истая | H2PHO3 фосфористая (фосфоновая) | |
| As 3+ | -овистая | H3AsO3 ортомышьяковистая, HasO2 метамышьяковистая | |
| Sb 3+ | -янистая | H3SbO3 ортосурьмянистая, HSbO2 метасурьмянистая | |
| VI | S 4+ | -нистая | H2SO3 сернистая |
| Se 4+ | -истая | H2SeO3 селенистая | |
| Te 4+ | -истая | H2TeO3 теллуристая | |
| Степень окисления элемента N-4 | |||
| V | N + | -новатистая | H2N2O2 азотноватистая |
| P + | -новатистая | HPH2O2 фосфорноватистая (фосфиновая) |
Традиционные названия оксокислот галогенов (табл. 4) в высшей степени окисления N, также образуются добавлением к названию элемента окончания –ная. Однако, для оксокислот галогенов в степени окисления N-2 используются окончания –новатая, а окончание –истаяприменяется для названия кислот со степенью окисления галогенов N-4. Оксокислоты галогенов с наиболее низкими степенями окисления N-6 имеют окончания –новатистая.
Таблица 4. Традиционные названия оксокислот р-элементов VII группы.
| N | Э z+ | Окончание | Название кислоты |
| Высшая степень окисления элемента N | |||
| VII | Cl 7+ | -ная | HClO4 хлорная |
| Br 7+ | HBrO4 бромная | ||
| I 7+ | H5IO6 ортоиодная, HIO4 метаиодная | ||
| Степень окисления элемента N-2 | |||
| VII | Cl 5+ | -новатая | HClO3 хлорноватая |
| Br 5+ | HBrO3 бромноватая | ||
| I 5+ | HIO3 иодноватая | ||
| Степень окисления элемента N-4 | |||
| VII | Cl 3+ | -истая | HClO2 хлористая |
| Br 3+ | HBrO2 бромистая | ||
| I 3+ | HIO2 иодистая | ||
| Степень окисления элемента N-6 | |||
| VII | Cl + | -оватистая | HClO хлорноватистая |
| Br + | HBrO бромноватистая | ||
| I + | HIO иодноватистая |

14. Приведите молекулярные и графические формулы следующих оксокислот: бромноватистая, иодная, селенистая, ортотеллуровая, метамышьяковая, дикремниевая, метаоловянная, фосфористая (фосфоновая), фосфорноватистая (фосфиновая), пентафосфорная, метаванадиевая.
15. Приведите реакции, демонстрирующие общие методы получения оксокислот. Приведите примеры оксидов элементов в промежуточных степенях окисления, которые при взаимодействии с водой образуют две кислоты.
16. Напишите реакции дегидратации следующих кислот: H3BO3, HMnO4, H2S2O7, HNO2, H3PO4, H2WO4, H3AsO3, H2CrO4. Приведите названия кислот и получающихся кислотных оксидов (ангидридов кислот).
17. Какие из перечисленных веществ будут взаимодействовать с соляной кислотой: Zn, CO, Mg(OH)2, CaCO3, Cu, N2O5, Al(OH)3, Na2SiO3, BaO? Напишите уравнения реакций.
18. Напишите реакции, демонстрирующие кислотный характер следующих оксидов, назовите соответствующие им кислоты: P4O10, SeO3, N2O3, NO2, SO2, As2O5.
Пероксокислоты.

При записи формул пероксокислот рекомендуется пероксидную группу заключать в круглые скобки и записывать в правой части формулы. Традиционные названия пероксокислот образуются из названия соответствущей оксокислоты с добавлением приставки пероксо-. При наличии в составе пероксокислоты нескольких пероксидных группировок их количество указывается численной приставкой: ди-, три-, тетра-и т.д. Например: HNO2(O2) пероксоазотная кислота, H3PO2(O2)2 дипероксофосфорная кислота.

9.4. Тиокислоты, политионовые и другие замещенные оксокислоты*- раздел для углубленного изучения.
Традиционные названия тиокислот образуются из названия соответствующей оксокислоты с добавлением приставки тио-;при замещении двух и более атомов кислорода на атомы серы их количество указывается численными приставками: ди-, три-, тетра-и т.д.
Оксокислоты общей формулы H2(O3S-Sn-SO3) (n = 0¸4) называют политионовыми. Характерной особенностью их строения (за исключение H2S2O6) является наличие мостиковых атомов серы, объединяющих две структурные
В дитионовой кислоте две структурные группировки объединениы непосредственно атомами серы-кислотообразователями H2(O3S-SO3). Традиционные названия политионовых кислот состояи из чмсловой приставки, указывающей общее количество атомов серы в составе и группового окончания –тионоваякислота.
По традиции, замещенные серные кислоты называют сульфоновыми кислотами:

11. Приведите молекулярные и графические формулы кислот: тиосерная, тритионовая, дитиосурьмяная, амидосульфоновая, диброммышьяковая, амидоугольная.
Бескислородные кислоты.

Систематическое название бескислородных кислот образуется из русского названия элемента или специального названия псевдогалогенидной группировки с добавлением соединительной гласной –о и словосочетания водородная кислота:
Исторически для водных растворов ряда бескислородных кислот в химической практике применяют и тривиальные названия (см. приложение 2):
12. Приведите систематические и тривиальные названия бескислород-ных кислот: HCl, HCN, HBr, HNCS, HI, H2S, HF, H2Se.
13. Приведите формулы следующих кислот: синильная, бромоводородная, плавиковая, азидоводородная, сероводородная, родановодородная, иодоводородная, циановодородная, тиоционатоводородная кислота.
Галогенангидриды.

Некоторые галогенангидриды могут быть рассмотрены как производные неустойчивых оксокислот – например, CCl4 и PCl5 формально являются хлорангидридами полностью гидратированных кислотных гидроксидов углерода (IV) H4CO4 и фосфора (V) H5PO5, в которых число гидроксидных групп совпадает со степенью окисления элемента-кислотообразователя. Галогенангидриды могут содержать либо атомы только одного галогена, либо атомы разных галогенов: POCl3, POBrCl2, POIBrCl.
В химической практике для галогенангидридов используют несколько методов построения их названий:
— по правилам систематической номенклатуры для сложных соединений с использованием латинских числовых приставок указывающих количество электроотрицательных галогенидных и оксидных ионов галогенангидрида:
— по правилам систематической номенклатуры для бинарных соединений с указанием по методу Штока римскими цифрами в круглых скобках степени окисления элемента:
Характерным химическим свойством галогенангидридов является их эффективное взаимодействие с водой с образованием галогеноводородной и оксокислоты:

14. Приведите систематические и традиционные названия галогенангидридов и напишите реакции их взаимодействия с водой: SbOCl, SeO2F2, NOBr, NO2F2, NF3, AsOCl2F, CO2Cl2, SOCl2, SO2Br2.
15. Приведите молекулярные и графические формулы галогенангидридов: хлорид-оксид бора, бромид кремния(IV), дифторид-оксид кремния, сульфурилфторид, дихлорангидрид селенистой кислоты, сульфурилбромид, тионилхлорид, хлоробромойодоангидрид ортофосфорной кислоты, дихлоробромоангидрид ортомышьяковой кислоты, тионилфторид.
Соли.

Таблица 1.5. Кислотно-основные реакции солеобразования.
| Соединения | Реакция солеобразования | |
| Основные | Кислотные | |
| NaF | PF5 | NaF + PF5 = Na[PF6] |
| Na2O | P2O5 | 3Na2O + P2O5 = 2Na3[PO4] Na2O + P2O5 = 2Na[PO3] |
| Na2S | P2S5 | 3Na2S + P2S5 = 2Na3[PS4] Na2S + P2S5 = 2Na[PS3] |
| Na3N | P3N5 | Na3N + P3N5 = Na4[PN3] |
| NaH | AlH3 | NaH + AlH3 = Na[AlH4] |
| NaOH | Al(OH)3 | NaOH + Al(OH)3 = Na[Al(OH)4] NaOH + Al(OH)3 = Na[AlO2] + H2O |
| NaNO3 | I(NO3) | NaNO3 + I(NO3) = Na[I(NO3)2] |
| NaOH | HNO3 | NaOH + HNO3 = Na[NO3] + H2O |
| Al(OH)3 | H3PO4 | Al(OH)3 + H3PO4 = Al[PO4] + 6H2O 2Al(OH)3 + 3H3PO4 = Al2[HPO4]3 + 6H2O Al(OH)3 + 3H3PO4 = Al[H2PO4]3 +3H2O 3Al(OH)3 + 2H3PO4 = (AlOH)3[PO4]2 + 6H2O 3Al(OH)3 + H3PO4 = |
| NaOH + Ba(OH)2 | H3PO4 | NaOH + Ba(OH)2 + H3PO4 = (NaBa)[PO4] + 3H2O |
| Al(OH)3 | H2SO4+ HNO3 | Al(OH)3 + H2SO4 + HNO3 = Al[(SO4)NO3] + H2O |
В составе солей можно выделить катионную и анионную составляющие, являющиеся производными исходных основных и кислотных соединений и имеющих преимущественно ионный характер химической связи. Вследствие этого в расплавах и растворах соли подвергаются процессу электролитической диссоциации, приводящей к образованию катионов и анионов.
В зависимости от состава соли классифицируются по природе катионов и анионов:
— соли со сложными катионами на основе двух разных ионов металла или иона аммония и металла (<(KAl)[SO4]2, <(NH4)2Fe>[SO4]2) называются двойными солями, а соли со сложными анионами (Ca[(ClO)Cl], Fe[(SO4)NO3]) – смешаннымисолями:
 |
— в зависимости от того, анионы каких кислот входят в состав соли, выделяют: соли оксокислот и бескислородных кислот (Na2SO4 и Na2S), а также соли различных замещенных оксокислот (Na2S2O8, Na2SO3S, NaSO3Cl и т.д.):
 |
называются основными. Такие соли могут быть рассмотрены как продукты частичного замещения гидроксидных групп в основных гидроксидах на группировки, являющиеся кислотными остатками соответствующих оксо- или бескислородных кислот:
 |
— соли, анионы которых содержат атомы водорода ((NH4)[HSO4], NaHS) и способны проявлять кислотные свойства за счет образования ионов гидроксония при электролитической диссоциации аниона – например:
называются кислыми. Такие соли могут быть рассмотрены как продукты частичного замещения водорода в кислотах на катионы металла или аммония:
— соли, являющиеся продуктами полного замещения гидроксидных групп на кислотные остатки или атомов водорода на катионы металла (аммония), называются средними илинормальными.
Некоторые соли при кристаллизации из водных растворов образуют кристаллические решетки, содержащие молекулы воды – например: CuSO4×5H2O, Na2SO4×10H2O. Такие соли называются кристаллогидратами.
Как видно из табл. 1.5, кислые и основные соли образуются в результате реакций нейтрализации при различных соотношениях многосновных кислот и многокислотных оснований и легко переходят как друг в друга, так и в средние соли: Al(H2PO4)3 + Al(OH)3 = Al2(HPO4)3 + 3H2O
Систематические названия средних солей бескислородных солей образуют по общим правилам для бинарных соединений:
Систематические названия солей оксокислот и их производных образуются по правилам номенклатуры для комплексных соединений, которые будут рассмотрены далее. В то же время, как и для кислот, в химической практике для наиболее распространенных солей оксокислот широко используют традиционные названия.
Для галогенов в степени окисления +7 в названии анионов используют приставку пер- и окончание –ат; для степеней окисления: +5 – окончание —ат, +3 – окончание –ит и для наиболее низкой +1 – приставку гипо-и окончание –ит.
Различные приставки: мета-, орто-, ди-, три- и т.д., используемые в названии оксокислот для указания их формы, сохраняются и в названиях анионов.
Для оксоанионов образованных d-элементами в основном используются систематические названия и только для ограниченного круга анионов (Табл. I-5.) в химической практике применяют традиционные названия.
В целом, традиционное название средних солей оксокислот строится из названия аниона (групповое слово –ион опускается) и русского названия катиона в родительном падеже с указанием римскими цифрами в круглых скобках его степени окисления (если она может быть переменной):
Таблица 6. Традиционные названия оксоанионов p-элементов III-VI групп.