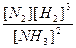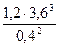Физическая химия
Химическая кинетика
Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики.
1. Скорость химической реакции
Дадим определение основному понятию химической кинетики – скорости химической реакции:
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Первое определение является наиболее строгим; из него следует, что скорость химической реакции можно также выражать как изменение во времени любого параметра состояния системы, зависящего от числа частиц какого-либо реагирующего вещества, отнесенное к единице объема или поверхности – электропроводности, оптической плотности, диэлектрической проницаемости и т.д. и т.п. Однако наиболее часто в химии рассматривается зависимость концентрации реагентов от времени. В случае односторонних (необратимых) химических реакций (здесь и далее рассматриваются только односторонние реакции) очевидно, что концентрации исходных веществ во времени постоянно уменьшаются (ΔСисх 0). Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рисунок 2.1).
Рис. 2.1 Кинетические кривые для исходных веществ (А) и продуктов реакции (В).
Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
Рис. 2.2 Графическое определение Vист.
Необходимо отметить, что в том случае, если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение концентрации какого реагента определялось. Очевидно, что в реакции
концентрации водорода, кислорода и воды изменяются в различной степени:
Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и т.д.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
Химическая кинетика. Скорость химических реакций
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
pV = νRT
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
Физическая химия
Химическая кинетика
Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики.
1. Скорость химической реакции
Дадим определение основному понятию химической кинетики – скорости химической реакции:
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Первое определение является наиболее строгим; из него следует, что скорость химической реакции можно также выражать как изменение во времени любого параметра состояния системы, зависящего от числа частиц какого-либо реагирующего вещества, отнесенное к единице объема или поверхности – электропроводности, оптической плотности, диэлектрической проницаемости и т.д. и т.п. Однако наиболее часто в химии рассматривается зависимость концентрации реагентов от времени. В случае односторонних (необратимых) химических реакций (здесь и далее рассматриваются только односторонние реакции) очевидно, что концентрации исходных веществ во времени постоянно уменьшаются (ΔСисх 0). Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рисунок 2.1).
Рис. 2.1 Кинетические кривые для исходных веществ (А) и продуктов реакции (В).
Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
Рис. 2.2 Графическое определение Vист.
Необходимо отметить, что в том случае, если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение концентрации какого реагента определялось. Очевидно, что в реакции
концентрации водорода, кислорода и воды изменяются в различной степени:
Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и т.д.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
ХИМИЧЕСКАЯ КИНЕТИКА



Химическая кинетика — это раздел химии, изучающий скорости реакций и влияние на них различных факторов.
Скорость каждой конкретной реакции в отсутствие катализатора зависит от концентраций реагентов и от температуры. Скорость гетерогенных реакций, протекающих на межфазной поверхности раздела, зависит также от величины этой поверхности.
Влияние концентраций реагентов на скорость реакций устанавливается законом действующих масс: при фиксированной температуре скорость реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам.
Механизмом реакции называют совокупность стадий химической реакции, в результате которых исходные вещества превращаются в конечные. Реакции могут быть одностадийными и многостадийными. Скорость реакции определяется скоростью самой медленной ее стадии (лимитирующей стадии).
Различают гомогенные и гетерогенные химические реакции. Реакции, протекающие в однофазной (однородной) системе, например, жидкой или газообразной, называются гомогенными. Такие реакции протекают во всем объеме системы. Реакции, протекающие в многофазных системах (состоящих из двух или более фаз, например, газообразной и твердой фазы) называются гетерогенными. Такие реакции протекают только на поверхности раздела фаз. Скорость гетерогенной реакции определяется изменением концентрации реагирующих веществ на единице поверхности в единицу времени.
Молекулярностью реакции называется число частиц, участвующих в элементарном акте химического взаимодействия. В реальных реакциях молекулярность может быть равна 1, 2, 3. В простых реакциях, протекающих в одну стадию, порядок совпадает с молекулярностью. Закон действующих масс справедлив для простых реакций. В случае сложных реакций, протекающих в несколько стадий, закон применим к любой отдельной реакции, но не к их сумме.
Зависимость скорости реакции от температуры объясняется тем, что, как уже отмечалось, скорость реакции зависит от числа соударений участвующих в реакции частиц (атомов, молекул, ионов). Но не все соударения приводят к химическому взаимодействию. Для того чтобы реакция произошла, частицы должны обладать некоторым избыточным количеством энергии (по сравнению со средней величиной), называемым энергией активации (EА). Чем выше температура, тем больше частиц имеет энергию, большую или равную EА. Поэтому скорость реакции увеличивается с повышением температуры. Константа скорости химической реакции определяется числом эффективных столкновений, т.е. числом активных молекул, способных вступить в химическую реакцию. Зависимость константы скорости реакции от температуры и энергии активации выражается уравнением Аррениуса:
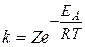
где k – константа скорости реакции, Z – постоянная, называемая стерическим фактором и зависящая от числа столкновений, приводящих к реакции; е – основание натурального логарифма (е = 2,7183. ); 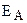

Химическое равновесие устанавливается в обратимых реакциях — в реакциях, которые могут протекать как в прямом, так и в обратном направлении. Если реакция аА + bВ ↔ cC + dD) обратима, это означает, что реагенты А и В способны превращаться в продукты С и D (прямая реакция), а продукты С и D в свою очередь могут, реагируя между собой, вновь образовывать исходные вещества А и В (обратная реакция).
Термодинамическим условием химического равновесия является неизменность энергии Гиббса реакции, т.е. rG = 0, а кинетическим условием равновесия — равенство скоростей прямой (v1) и обратной (v2) реакции: v1 = v2.
Так как в состоянии химического равновесия и прямая, и обратная реакции протекают с одинаковыми скоростями, концентрации реагентов и продуктов во времени не изменяются. Эти не изменяющиеся во времени концентрации называются равновесными. Равновесные концентрации, в отличие от неравновесных, изменяющихся в ходе реакции, принято обозначать особым образом, а именно, формулой вещества, заключённой в квадратные скобки. Например, записи [Н2], [NН3] означают, что речь идёт о равновесных концентрациях водорода и аммиака.
При заданной температуре соотношение равновесных концентраций реагентов и продуктов есть величина постоянная и характерная для каждой реакции. Это соотношение количественно характеризуется величиной константы химического равновесия Кс, равной отношению произведения равновесных концентраций продуктов к произведению равновесных концентраций реагентов, возведённых в степени, равные их стехиометрическим коэффициентам.
Для обратимой реакции аА + bВ ↔ cС + dD выражение Кс имеет вид:
Кс= 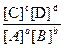
Для реакций с участием газов константа химического равновесия может быть выражена не только через равновесные концентрации, но и через равновесные парциальные давления газов. В этом случае символ константы равновесия «К» индексируется не символом концентрации «с», а символом давления «р».
В равновесном состоянии, характеризующимся равенством скоростей прямой и обратной реакции, система может находиться сколь угодно долго, если не происходит изменения условий. При изменении условий равенство скоростей v1 = v2 нарушается, одна из двух реакций начинает протекать с большей скоростью. Это выражают, говоря, что в системе происходит смещение (сдвиг) химического равновесия.
Если в результате изменения условий в системе с большей скоростью начинает протекать прямая реакция, т.е. v1 > v2 , равновесие смещается в сторону прямой реакции — вправо и, наоборот, если скорость обратной реакции становится больше скорости прямой реакции, т.е. выполняется условие v2 > v1, происходит сдвиг равновесия в сторону обратной реакции — влево.
Задача 1. Для данной химической реакции напишите кинетическое уравнение и определите теоретический порядок реакции. Рассчитайте, как изменится скорость реакции при указанных изменениях условий протекания реакции: Fe2O3(тв) + 3CO(г) → 2Fe(тв) + 3CO2(г)
Во сколько раз изменится (увеличится или уменьшится) скорость реакции если:
а) увеличить давление в 2 раза;
б) увеличить объем реакционной смеси в 2 раза
в) повысить температуру на 40?С (γ = 2)
г) понизить температуру на 20?С (γ = 2)
Fe2O3 (тв) + 3CO(г) → 2Fe (тв) + 3CO2(г) – реакция гетерогенная (участвуют вещества в различающихся фазовых состояниях).
Кинетическое уравнение: υ1 = k · с 3 (CO),
Теоретический порядок реакции: 3 (cумма показателей степеней концентраций в кинетическом уравнении называется теоретическим порядком реакции).
Расчет изменения скорости реакции:
а) при увеличении давления в 2 раза: скрость реакции до увеличения давления описывается кинетическим уравнением:
υ1 = k · с 3 (CO), где с 3 (CO) – начальная (исходная) концентрация оксида углерода (II).
При увеличении давления происходит и увеличение концентрации, т.е. если давление увеличить в 2 раза, то и концентрация увеличится в 2 раза, поэтому кинетическое уравнение реакции после изменения давления имеет следующий вид:
υ2 = k · (2с) 3 (CO), где (2с) 3 (CO) концентрация оксида углерода (II) после повышения давления в системе в 2 раза.
Изменение скорости реакции ( 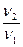
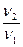
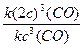
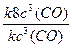
б) при увеличении объема реакционной смеси в 2 раза:
увеличение объема реакционной смеси в 2 раза приведет к уменьшению концентрации газа в 2 раза: υ1 = k · с 3 (CO), где с 3 (CO) – начальная (исходная) концентрация оксида углерода (II).
υ2 = k 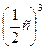
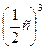
Изменение скорости реакции ( 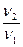
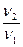
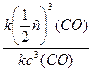
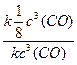
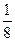
в) повышение температуры на 40°С (γ = 2):
При изменении температуры скорость реакции изменяется по правилу Вант-Гоффа:
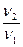
г) понижение температуры на 20°С (γ = 2):
При изменении температуры скорость реакции изменяется по правилу Вант-Гоффа:
Задача 2. 1) Для обратимых реакций
CuO(тв) + CO(г) ↔ Cu(тв) + CO2(г) + QN2 (г) + O2 (г) ↔ 2NO (г) – Q, определите, в какую сторону сместится равновесие реакции, если:
а) увеличить температуру; б) уменьшить температуру
2) Для обратимых реакций:
С(тв) + О2(г) ↔ СО2(г), определите, в какую сторону сместится равновесие реакции, если:
а) увеличить давление; б) уменьшить давление
3) Для обратимой реакции:
Fe2O3(тв) + 3H2(г) ↔ 2Fe(тв) + 3H2O (г), определите, в какую сторону сместится равновесие реакции, если:
а) увеличить концентрацию Н2;
б) уменьшить концентрацию Н2;
в) увеличить концентрацию H2O
г) уменьшить концентрацию H2O
Направление, в котором смещается химическое равновесие, определяется по принципу Ле Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
1) Увеличение температуры смещает равновесие в сторону эндотермической реакции (–Q), уменьшение температуры смещает равновесие в сторону экзотермической реакции (+ Q).
В данном случае:
следовательно:
а) при увеличении температуры равновесие сместится в сторону обратной реакции (в сторону образования реагентов, влево (←)),
б) при уменьшении температуры равновесие сместится в сторону прямой реакции (в сторону образования продуктов, вправо (→)).
В данном случае:
прямая реакция N2(г) + O2(г) → 2NO(г) – Q – эндотермическая,
обратная реакция 2NO (г) → N2(г) + O2(г) + Q – экзотермическая,
следовательно:
а) при увеличении температуры равновесие сместится в сторону прямой реакции (в сторону образования продуктов, вправо(→))
б) при уменьшении температуры равновесие сместится в сторону обратной реакции (в сторону образования реагентов, влево(←)).
2) Увеличение давления смещает равновесие в сторону той реакции, в которой количество молекул газов уменьшается. Уменьшение давления смещает равновесие в сторону той реакции, в которой количество молекул газов увеличивается.
В системе C2H2(г) + 2H2(г) ↔ C2H6(г) прямая реакция (C2H2(г) + 2H2(г) → C2H6(г)) протекает с уменьшением количества молекул газов (из трех молекул исходных газов образуется одна молекула конечного продукта), а обратная реакция
(C2H6(г) → C2H2(г) + 2H2(г)) – протекает с увеличением числа молекул (из одной молекулы C2H6 образуется три новые (одна молекула C2H2 и две молекулы H2 ).
Следовательно:
а) увеличение давления смещает равновесие в сторону прямой реакции (в сторону образования продуктов, вправо(→));
б) уменьшение давления смещает равновесие в сторону обратной реакции (в сторону образования реагентов, влево(←)).
В системе 3S(тв) + H2О(г) ↔ 2H2S(г) + SО2(г) прямая реакция (3S(тв) + H2О(г) → 2H2S(г) + SО2(г)) протекает с увеличением количества молекул газов, а обратная (2H2S(г) + SО2(г) → 3S(тв) + H2О(г)) – протекает с уменьшением молекул газов ( S(сера) – твердое вещество, количества молекул твердых веществ не учитываются).
Следовательно:
а) увеличение давления смещает равновесие в сторону обратной реакции (в сторону образования реагентов, влево (←));
б) уменьшение давления смещает равновесие в сторону прямой реакции (в сторону образования продуктов, вправо (→)).
В системе С(тв) + О2(г) ↔ СО2(г) количества молекул газов среди реагентов и среди продуктов равны (одна молекула О2 и одна молекула СО2(г)), следовательно изменение давления (увеличение или уменьшение) не повлияет на смещение химического равновесия в данной системе.
а) увеличение давления равновесие не смещает;
б) уменьшение давления равновесие не смещает.
3) а) увеличение концентрации реагентов смещает равновесие в сторону образования продуктов, следовательно:
для данной реакции Fe2O3(тв) + 3H2(г) ↔ 2Fe(тв) + 3H2O (г) увеличение концентрации реагента Н2 приведет к смещению равновесия в сторону прямой реакции (в сторону образования продуктов, вправо (→)).
б) уменьшение концентрации реагентов смещает равновесие в сторону образования реагентов, следовательно:
для данной реакции Fe2O3(тв) + 3H2(г) ↔ 2Fe(тв) + 3H2O (г) увеличение концентрации реагента Н2 приведет к смещению равновесия в сторону обратной реакции (в сторону образования реагентов, влево (←));
в) увеличение концентрации продуктов смещает равновесие в сторону образования реагентов, следовательно:
для данной реакции Fe2O3(тв) + 3H2(г) ↔ 2Fe(тв) + 3H2O (г) увеличение концентрации продукта Н2О приведет к смещению равновесия в сторону обратной реакции (в сторону образования реагентов, влево (←));
г) уменьшение концентрации продуктов смещает равновесие в сторону образования продуктов, следовательно:
для данной реакции Fe2O3(тв) + 3H2(г) ↔ 2Fe(тв) + 3H2O (г) уменьшение концентрации продукта Н2О приведет к смещению равновесия в сторону прямой реакции (в сторону образования продуктов, вправо (→)).
Задача 3. 1) Для обратимой реакции Fe2O3(тв) + 3CO(г) ↔ 2Fe(тв) + 3CO2(г) рассчитайте константу равновесия, если начальная концентрация СО равна 3 моль/л, к моменту наступления равновесия прореагировало 75% СО.
2) Для обратимой реакции S(тв) + H2(г) ↔ H2S(г) рассчитайте равновесные концентрации веществ, если начальная концентрация H2 равна 3 моль/л, а константа равновесия Кр = 15.
В) Для обратимой реакции 2NH3(г) ↔ 3H2(г) + N2(г) рассчитайте начальную концентрацию NH3 и константу равновесия данной реакции, если равновесные концентрации веществ равны [NH3] = 0,4 моль/л, [N2] = 1,2 моль/л, [Н2] = 3,6 моль/л.
Для решения данных задач удобно пользоваться таблицей следующего вида:
| Реагенты и продукты реакции | Реагенты | Продукты |
| Начальные концентрации | ||
| Прореагировало к моменту наступления равновесия | ||
| Равновесные концентрации |
1) Константа равновесия в гетерогенных реакциях зависит только от концентрации газов, поэтому количества твердых веществ (Fe2O3(тв) и Fe(тв)) не учитываются.
В строку начальных концентраций вписываем начальную концентрацию CO – 3 моль/л. Начальная концентрация CO2 равна нулю (это продукт реакции, которого в момент начала реакции еще не образовалось).
По условию к моменту наступления равновесия прореагировало 75% СО, т.е. 3 моль 0,75 = 2,25 моль.
В результате реакции образовалось 2,25 моль CO2, т.к. по уравнению реакции количество CO2 равно количеству CO.
После реакции останется следующие количество CO:
Таким образом, равновесные концентрации будут равны: [CO] = 0,75 моль/л [CO2] = 2,25 моль/л
| Реагенты и продукты реакции | Реагенты | Продукты | ||
| Fe2O3(тв) | 3CO(г) | 2Fe(тв) | 3CO2(г) | |
| Начальные концентрации | – | 3 | – | – |
| Прореагировало к моменту наступления равновесия | – | 2,25 | – | 2,25 |
| Равновесные концентрации | – | 0,75 | – | 2,25 |
Рассчитываем константу химического равновесия (в соответствии с Законом действующих масс: в состоянии химического равновесия при определенной температуре произведение концентраций продуктов реакции в степенях, показатели которых равны соответствующим коэффициентам в стехиометрическом уравнении реакции, деленное на аналогичное произведение концентраций реагентов в соответствующих степенях, представляет собой постоянную величину)
Кр = 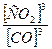
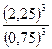
2) Составляем таблицу по уравнению реакции:
| Реагенты и продукты реакции | Реагенты | Продукты | |
| S(тв) | H2(г) | H2S(г) | |
| Начальные концентрации | – | 3 | 0 |
| Прореагировало к моменту наступления равновесия | – | х | х |
| Равновесные концентрации | – | 3-х | х |
В гетерогенных реакциях учитываются только концентрации газов.
Начальная концентрация H2 равна по условию 3 моль/л. Начальная концентрация H2S равна нулю (это продукт реакции, которого в момент начала реакции еще не образовалось).
Пусть образоваллось х моль H2. В этом случае концентрация H2S также будет равна х моль (т.к. по уравнению реакции их соотношение 1:1). Равновесная концентрация H2 рассчитывается:
Сравн = Снач – Спрореаг = (3 – х) моль, а равновесная концентрация H2S: Сравн =
Выражение для константы равновесия данной реакции имеет следующий вид:
Кр = 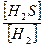
15 = 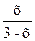
Таким образом, равновесная концентрация H2S:
Равновесная концентрация H2:
3) Составляем таблицу по уравнению реакции:
| Реагенты и продукты реакции | Реагенты | Продукты | |
| 2NH3(г) | 3H2(г) | N2(г) | |
| Начальные концентрации | 2,8 | 0 | 0 |
| Прореагировало к моменту наступления равновесия | 2,4 | 3,6 | 1,2 |
| Равновесные концентрации | 0,4 | 3,6 | 1,2 |
В строку равновесных концентраций записываем данные в задаче концентрации веществ. Количество прореагировавшего NH3 можно рассчитать по количеству любого из полученных веществ: например, соотношение NH3 и N2 по уравнению реакции составляет 2:1, значит, если после реакции образовалось 1,2 моль N2, то NH3 прореагировало в 2 раза больше : n(NH3) = 2 · 1,2 = 2,4 моль.
Начальная концентрация NH3 рассчитывается :
Кр =