Составление уравнений реакций окисления-восстановления
Для протекания окислительно-восстановительных реакций (ОВР) необходимо одновременное присутствие веществ, взаимно противоположных по своей способности отдавать или присоединять электроны. Кроме этого, протекание некоторых реакций окисления-восстановления возможно лишь при определенных условиях (реакция среды, температура, катализатор, концентрация веществ и др).
Чтобы определить вероятность протекания ОВР обычно пользуются значениями ионизационных потенциалов, сродства к электрону и электроотрицательностей. При количественном определении направления окислительно-восстановительных реакций удобно пользоваться стандартными значениями энергии Гиббса образования исходных или конечных веществ, а также изменением энергии Гиббса или Гельмгольца реакции.
Мерой интенсивности реакций окисления-восстановления являются стандартные окислительно-восстановительные потенциалы.
Алгоритм cоставления уравнений реакций окисления-восстановления
При составлении уравнений реакций окисления-восстановления необходимо придерживаться определенной последовательности:
1. Найти среди исходных веществ окислитель и восстановитель
Для этого прежде всего необходимо расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Расставим степени окисления:
В кислой среде Br — окисляется до Br2, т.е. отдает 2 электрона и является восстановителем, а Mn +7 восстанавливается до Mn +2 и является окислителем.
2. Записать продукты реакции
Правильно определить продукты реакции помогут ваши знания о строении атомов элементов, их свойствах и свойствах их соединений.
Важно помнить, что в реакциях межатомного и межмолекулярного окисления-восстановления, свободный кислород, как правило, не выделяется.
Выделение кислорода
Выделение кислорода происходит при взаимодействии пероксидов с сильными окислителями, а также в некоторых реакциях с участием озона и фтора. Например,
Характер среды
Кислая среда
При написании продуктов реакции необходимо учитывать характер среды. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов – хлориды, бромиды, сульфаты, нитраты.
Для создания кислой среды, как правило используют разбавленную серную кислоту. Соляная и азотная кислоты для подкисления используются реже, т.к. азотная кислота сама является окислителем, а соляная кислота в присутствии сильных окислителей обладает восстановительными свойствами.
Щелочная среда
Щелочную среду создают, как правило, растворами KOH или NaOH. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Чтобы не ошибиться при написании продуктов реакций, вначале следует написать продукты окисления и восстановления, а потом только другие вещества, степень окисления которых не изменяется в процессе реакции.
Итак, образуемые в результате реакции продукты, определяются условиями проведения реакции и природой окислителя и восстановителя. Ниже представлены схемы окислительно-восстановительных реакций соединений марганца и хрома в различных средах, а также азотной и серной кислот.
Азотная кислота
В результате реакции азотной кислоты с металлами, в зависимости от ее концентрации и активности металла, образуются нитраты, вода и различные продукты восстановления кислоты, указанные в таблице ниже. См. также химические свойства азотной кислоты
Серная кислота
Разбавленная серная кислота не является окислителем и реагирует с металлами, как обычная кислота. Если металл стоит в электрохимическом ряду напряжения металлов до водорода, то при его взаимодействии с кислотой происходит выделение водорода. Если металл находится после водорода в этом ряду, то взаимодействия не происходит.
Концентрированная серная кислота активными металлами (до Zn) восстанавливается до S и H2S, а менее активными (расположенные после водорода и в непосредственной близости от него в ряду напряжения металлов) до SO2. См. также химические свойства серной кислоты
Благородные металлы — золото Au и платина Pt не окисляются даже концентрированной серной кислотой.
А такие достаточно активные металлы, как Al, Fe, Cr при обычных условиях пассивируются и не взаимодействуют с концентрированной H2SO4, однако при нагревании реакции становятся возможными.
3. Подобрать коэффициенты
Коэффициенты в ОВР подбирают, учитывая число отданных и принятых электронов. Следует помнить, что общее число электронов, отданных восстановителем, должно равняться общему числу электронов, принятых окислителем.
Существует несколько методов подбора коэффициентов, из которых чаще всего используют Метод электронного баланса и ионно-электронный метод (метод полуреакций). В соответствующих разделах, а также в разделе Задачи к разделу Окислительно-восстановительные реакции приведены примеры составления окислительно-восстановительных реакций.
Окислительно-восстановительные реакции для «чайников»
Все химические реакции делятся на два вида:
Второй тип реакций называют окислительно-восстановительными.
Возникает логичный вопрос, а почему, собственно, такие реакции получили название окислительно-восстановительных, а, не, скажем, окислительно-изменительных? И, вообще, что это за «зверь» такой окисление?
Для того, чтобы обстоятельно ответить на эти вопросы, предварительно следует разобрать такие понятия, как «валентность», «электроотрицательность» и «степень окисления».
| Окислительно-восстановительные реакции сопровождаются перемещением электронов от одних атомов (молекул, ионов) к другим |
Изложение дальнейшего материала ведется с учетом того, что читатель знаком с понятиями «атом» и «электрон». Вкратце лишь напомним, что атом элемента состоит из ядра (положительно заряженного) и электронов (отрицательно заряженных), которые вращаются по своим орбиталям вокруг ядра.
Что происходит, когда атом отдает свои электроны? Поскольку электроны являются отрицательно заряженными частицами, то, уменьшение их количества автоматически приводит к увеличению заряда атома.
Атом (молекула, ион), получивший электрон, наоборот, уменьшает свой заряд.
ВНИМАНИЕ! Теперь начнём «путать следы».
В общем, надо признать, что такая терминология не лишена логики, ведь, если переложить язык химии на повседневную жизнь, то:
Продолжаем «путать следы» дальше.
Подводим краткий итог сказанному:
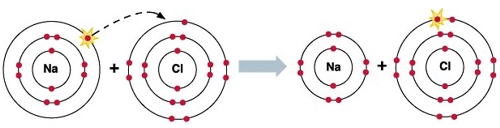
На рисунке выше показано взаимодействие атома натрия с атомом хлора, в ходе которого, натрий отдает один свой электрон атому хлора. В этой реакции натрий является элементом-восстановителем, в ходе реакции он окисляется (степень окисления натрия увеличивается); атом хлора является элементом-окислителем, в ходе реакции он восстанавливается (степень окисления хлора уменьшается).
Следует понимать, что в окислительно-восстановительных реакциях кол-во отдаваемых электронов веществом-восстановителем, обязательно равно кол-ву электронов, принятых веществом-окислителем. Если кредитор дал взаймы 100 долларов, то заемщик получил кредит в 100 долларов.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
В качестве примера составим уравнение реакции сероводорода с раствором калия перманганата в кислой среде методом полуреакций. Ранее это уравнение было составлено методом электронного баланса.
В ходе реакции происходит разложение молекул сероводорода на серу и водород, о чем свидетельствует постепенное помутнение раствора перманганата калия (сера выпадает в осадок). Процесс окисления сероводорода запишем в виде уравнения полуреакции окисления:
Поскольку в левой и правой частях схемы кол-во атомов серы и водорода равно, то стрелку можно заменить на знак равенства, уравняв предварительно число зарядов в исходном веществе и продуктах реакции:
Чтобы уравнять заряды в левой и правой части схемы, в левую часть надо добавить 5 электронов (в левой части сумма зарядов +7, а в левой +2):
Для получения суммарного уравнения реакции, необходимо почленно сложить две полуреакции, предварительно уравняв кол-во отданных и полученных электронов, по аналогии с методом электронного баланса:
Результат аналогичен уравнению, полученному методом электронного баланса.
Правила составления уравнений ОВР методом полуреакций
Достоинства метода полуреакций:
Пример составления уравнения ОВР для кислотной среды
Составление уравнения реакции серы с азотной кислотой:
Пример составления уравнения ОВР для кислотной среды
«Фокус» уравнивания кол-ва атомов кислорода и водорода для уравнений ОВР в щелочной среде заключается в следующем:
Пример составления уравнения ОВР для нейтральной среды
Среду нейтральной можно счситать лишь условно, в любом случае, среда будет либо слабощелочной, либо слабокислотной.
Более подробно составление уравнений окислительно-восстановительных реакций методом полуреакций в различных средах рассмотрено на странице Влияние среды на протекание ОВР.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Статья по химии для 11 класс на тему «Определение продуктов в окислительно-восстановительных реакциях».
«Управление общеобразовательной организацией:
новые тенденции и современные технологии»
Свидетельство и скидка на обучение каждому участнику
Статья по химии для 11 класс на тему «Определение продуктов в окислительно-восстановительных реакциях».
11 класс (подготовка к ЕГЭ)
учитель химии МАОУ «Лицей 29» г. Тамбов
Дегтярева Елена Эдуардовна.
Окислительно-восстановительными (ОВР) называются реакции, в ходе которых происходит изменение степеней окисления атомов, образующих вещества.
Для того, чтобы определить какое из веществ является окислителем, а какое восстановителем необходимо определить степени окисления атомов в данных веществах.
Соединения элементы, в которых проявляют высокие положительные степени окисления, являются окислителями. Примеры типичных окислителей приведены в таблице 1
Галогены в высших положительных степенях окисления
Галогены в промежуточных положительных степенях окисления
Халькогены и другие неметаллы в положительных степенях окисления
Неметаллы- простые вещества
Неметаллы в промежуточных отрицательных степенях окисления
Металлы в высших положительных степенях окисления
Металлы в промежуточных положительных степенях окисления
Соединения, с низшей отрицательной степенью окисления проявляют только восстановительные свойства. Примеры типичных окислителей приведены в таблице 2.
Металлы – простые вещества
Неметаллы в низшей отрицательной степени окисления
Металлы в промежуточной положительной степени окисления
Неметаллы- простые вещества
Неметаллы в промежуточных отрицательных степенях окисления
Неметаллы- простые вещества
неметаллы в промежуточных положительной степени окисления
Рассматривая типичные окислители и восстановители, можно заметить, что многие вещества способны проявлять в зависимости от условий как восстановительные, так и окислительные свойства, т.е. обладают двойственностью окислительно-восстановительных свойств. Причин такой двойственности несколько:
1) в состав вещества могут входить элементы, один из которых проявляет свойства окислителя, а другой – восстановителя. Например, хлороводород (и его водный раствор соляная кислота) проявляют окислительные свойства при взаимодействии с металлами за счёт катиона водорода Н + и восстановительные – благодаря наличию атома галогена в в минимальной степени окисления.
С a 0 +2H +1 Cl = Ca +2 Cl 2 +H 2 0
2) вещество может содержать химический элемент в промежуточной степени окисления. Этот элемент может выступить в качестве восстановителя и повысить свою степень окисления, а может проявить и окислительные свойства – понизить степень окисления.
Например: пероксид водорода содержит кислород в промежуточной степени окисления, поэтому в реакциях может выступать в роли окислителя, и в роли восстановителя, а так же участвовать в реакции диспропорционирования. Пероксид водорода восстанавливается в зависимости от среды:
H 2 O 2 + 2 e – → 2 OH – ( H 2 O 2 – окислитель в нейтральной среде)
H 2 O 2 + 2 e – + 2 H + → 2 H 2 O ( H 2 O 2 – окислитель в кислой среде)
H 2 O 2 – 2 e – → O 2 ↑ + 2 H + ( H 2 O 2 – восстановитель)
2 KI + H 2 O 2 = I 2 + 2 KOH – нейтральная среда
восстановитель окислитель среда
восстановитель окислитель среда
В окислительно-восстановительных реакциях, сложным является, определить продукт на выходе. Чтобы определить продукты реакции в ОВР необходимо знать, до какой степени окисления восстанавливается или окисляется данное соединение.
1). Кислородсодержащие соединения галогенов при восстановлении переходят в соответствующие галогениды:
NaClO 3 + восст. → NaCl
Исключение – если в роли восстановителя выступает соответствующий галогенид-анион, то в ходе реакции выделяется свободный галоген:
окислит. восст. среда
2). Свободные галогены являются сильными окислителями и в ходе ОВР, как правило, переходят в соответствующие галогенид-анионы:
3) KMnO 4 – окислитель, – в зависимости от реакции среды при восстановлении переходит в различные формы:
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
Типичные восстановители – это, как правило:
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители :
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
C 0 + 4H N +5 O3(конц) = C +4 O2 ↑ + 4 N +4 O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование ) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
Mn +7 + 1e = Mn +6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Е сли среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
KMnO4 + неМе (низшая с.о.) = неМе 0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме 0 = Ме (стабильная с.о.) + др. продукты
Схема восстановления хроматов/бихроматов
Соединения хрома VI окисляют:
Хромат/бихромат + неМе (отрицательная с.о.) = неМе 0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме 0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As +5 + другие продукты
Разложение нитратов
Например:
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония :
При нагревании нитрат аммония разлагается. При температуре до 270 о С образуется оксид азота (I) («веселящий газ») и вода:
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород :
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
Нитрат никеля (II) разлагается до нитрита при нагревании до 150 о С под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Взаимодействие металлов с серной кислотой
Например :
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием ;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Cu 0 + 2H2 S +6 O4(конц) = Cu +2 SO4 + S +4 O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S 2- (в зависимости от температуры, степени измельчения и активности металла).
Пероксид водорода
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например :